姜黄素对脂多糖诱导人脐静脉内皮细胞炎症反应的影响及分子机制
高玉兰,姚永良,俞黎娅,吴建红,浦雄勇,黄锋,夏龙飞
(1.江苏大学附属昆山第一人民医院放免科,江苏苏州215300;2.江苏大学附属昆山第一人民医院检验科,江苏苏州215300;3.江苏大学医学院,江苏镇江212013)
姜黄素对脂多糖诱导人脐静脉内皮细胞炎症反应的影响及分子机制
高玉兰1,姚永良2,俞黎娅2,吴建红2,浦雄勇2,黄锋2,夏龙飞3
(1.江苏大学附属昆山第一人民医院放免科,江苏苏州215300;2.江苏大学附属昆山第一人民医院检验科,江苏苏州215300;3.江苏大学医学院,江苏镇江212013)
目的研究姜黄素对脂多糖(LPS)诱导人脐静脉内皮细胞(HUVEC)炎症因子表达的影响,初步探讨可能的分子机制。方法使用LPS(1 μg)和姜黄素(5 μmol/L、15 μmol/L或30 μmol/L)处理HUVEC细胞24 h,收集细胞总RNA,实时定量PCR(RT-PCR)和ELISA方法检测细胞TNF-α、MCP-1水平;Western blot检测细胞TLR4、MAPKs、NF-κB p65、磷酸化-NF-κB p65及NF-κB抑制蛋白IκBα的表达情况。结果与空白对照组比较,姜黄素能显著抑制LPS诱导HUVEC细胞TNF-α、MCP-1和TLR4的过表达(P<0.05),明显降低NF-κB p65和MAPKs的磷酸化及IκBα蛋白降解(P<0.05)。结论姜黄素可能基于抑制TLR4/NF-κB,从而影响LPS诱导HUVEC细胞炎症因子的表达。
姜黄素;动脉粥样硬化;脂多糖;核因子-κB;人脐静脉内皮细胞
作为心脑血管疾病的共同病理基础,动脉粥样硬化(atherosclerosis,AS)是一种累及全身血管的病变,其最主要的特征变化就是血管壁内脂质及炎症细胞聚集[1]。目前研究表明AS是内皮细胞功能发生紊乱后的炎症反应及在此基础上的损伤-修复过程,是血管炎症性损伤的重要表现[2]。脂多糖是革兰氏阴性细菌细胞壁中对热抵抗、只有当细菌崩解破坏后才释放出来的非蛋白质成分,是血管内皮细胞的强烈激活剂[3-4]。近年来的最新研究发现,在AS的发生发展进程中,某些炎症因子,如肿瘤坏死因子-α (TNF-α)及单核细胞趋化蛋白-1(MCP-1)等起着关键性作用,脂多糖可通过TLR4/NF-κB途径[5],间接调控炎症因子的表达,从而激活血管内皮细胞(VEC),诱导细胞粘附分子1(ICAM-1)、血管细胞粘附分子1 (VCAM-1)及E选择素在VEC表面的表达增强,促使单核细胞、中性粒细胞及T淋巴细胞等与血管内皮细胞相结合,通过释放蛋白酶及氧自由基直接损伤血管内皮细胞[3],亦可通过体液免疫反应间接损伤血管内皮细胞[4],最终加速AS的进程[5]。姜黄素(curcumin)是一种从姜科植物姜黄等的根茎中提取得到的天然多酚,由于其存在的普遍性,姜黄素早已用于各类疾病的治疗[6]。姜黄素已被发现具有抗炎、抗致癌和抗氧化作用等多种药理作用[7-9],Sikora等[10]研究发现姜黄素也有降血脂、抗动脉粥样硬化的功效,从而认为其有保护心血管的作用。Zhong等[11]的最新研究报道表明:氧化性低密度脂蛋白(OX-LDL)能诱导血管平滑肌细胞(VSMCs)炎症因子过表达,然而姜黄素能抑制这一过程。但是,关于姜黄素能否对LPS诱导血管内皮的损伤产生影响,目前尚无相关性的研究报道。因此,本研究旨在探讨姜黄素能否影响LPS诱导HUVEC炎症因子的表达,并在此基础上初步探讨可能的分子机制。
1 材料与方法
1.1 试剂HUVEC细胞(上海中国科学院细胞研究所),DMEM培养基、胎牛血清(FBS)和胰蛋白酶(美国Gibco公司),ELISA检测试剂盒TNF-α和MCP-1(Thermo Fisher Scientific公司),兔抗人TLR4、NF-κB p65、ERK1/2、p38 MAPK、JNK1/2、p-NF-κB p65、p-ERK1/2、p-p38MAPK和p-JNK1/2单克隆抗体以及兔抗人NF-κB抑制蛋白(IκB-α)多克隆抗体(Cell Signaling公司),兔抗人p38MAPK单克隆抗体(SantaCruz公司),兔抗人β-actin抗体(Protein Tech Group公司),辣根过氧化物酶(HRP)标记的羊抗兔抗体(南京生兴生物技术公司),RIPA裂解液(江苏碧云天生物技术有限公司),总RNA抽提试剂Trizol (Invitrogen公司),ECL显色剂(GE Healthcare公司),逆转录试剂盒及定量PCR试剂盒(北京康为世纪生物科技有限公司),TAK-242(MedChem Express公司),姜黄素、LPS(Sigma公司),采用Oligo7.0设计并由上海生物工程公司合成引物,其他试剂均为国产分析纯。
1.2 方法
1.2.1 HUVEC细胞培养HUVEC的细胞培养采用含10%FBS、100 U/mL青霉素和100 U/mL链霉素的DMEM培养液,置于5%CO2浓度、饱和湿度及37℃恒温的孵育箱中培养,待细胞铺满75%~85%培养瓶底部时,0.25%胰酶消化,细胞传代,实验时采用第3~8代细胞,待细胞生长融合成单层后用于实验。
1.2.2 细胞总RNA的提取和逆转录取1.2.1中培养的状态良好的HUVEC细胞,将其按2×106个/孔的密度接种于6孔板,培养24 h,1 mL无血清DMEM培养基饥饿过夜。根据需要将细胞用不同梯度浓度的姜黄素(5 μmol/L、10 μmol/L或30 μmol/L)预处理1 h,空白对照组为0 μmol/L,然后加入LPS(1 μg/mL)刺激2 h,弃掉培养液,磷酸盐缓冲液(PBS)洗三次,随后加入1 mL Trizol裂解,将收集的细胞裂解液转移至EP管(1.5 mL)中,混匀后于室温条件下放置20 min,确保裂解充分。最后,将裂解充分的细胞液,按照Trizol说明书的步骤提取细胞总RNA,然后根据逆转录试剂盒说明书,将提取的RNA反转录为cDNA,用于检测mRNA的表达。
1.2.3 细胞蛋白裂解物的制备按照1.2.2描述的步骤,依次对HUVEC细胞培养、饥饿过夜、预处理、刺激、缓冲液清洗后,将细胞收集于1.5 mL的EP管中,加入50 μL预冷的细胞裂解液,冰上裂解1 h后,离心收集上清液,用BCA法检测上清液的细胞蛋白浓度,于-70℃冰箱中分装保存。
1.2.4 实时定量PCR(RT-PCR)检测TNF-α和MCP-1 mRNA RT-qPCR循环参数为:95℃预变性5 min;一个循环:95℃15 s,62℃20 s,72℃20 s;38个循环扩增。本实验以β-actin为内参基因。TNF-α引物序列为上游:5′-CCATGTCTTTCTACCCTAATC-3′,下游:5′-AGCTGCTCTGTCGGATGAGCA-3′,扩增片段为157bp;MCP-1引物序列为:上游:5′-GCTCGCTCAGCCAGATGCAAT-3′,下游:5′-TGGG TTGTGGAGTGAGTGTTC-3′,扩增片段为257 bp;β-actin引物序列为:上游:5′-CACGAAACTACCTTCA ACTCC-3′,下游:5′-CATACTCCT-GCTTGCTGATC-3′,扩增片段为262 bp。目的基因的相对表达水平,其数值等于目的基因拷贝数与β-actin拷贝数的比值。
1.2.5 Western blotting分析取1.2.3中收集的细胞蛋白裂解上清液标本(总蛋白100 μg),加入Loading buffer作用,开水煮沸10 min后,进行10% SDS-PAGE电泳,然后350 mA转膜2 h,将膜置于5%的脱脂牛奶中室温封闭1 h;再分别用相应的兔抗人抗体,4℃孵育过夜;用TBS/T洗5次,5 min/次;然后用HRP标记的羊抗兔IgG,室温孵育1 h;再用TBS/T洗5次,5 min/次,ECL显色系统定影显色,使用光密度分析软件处理分析。
1.2.6 ELISA检测细胞培养上清TNF-α和MCP-1水平按照1.2.2描述的步骤,依次对HUVEC细胞培养24 h、饥饿过夜、预处理1 h、刺激24 h后,收集刺激后的细胞培养上清液,按照ELISA试剂盒说明书的步骤,分别检测该上清液中TNF-α和MCP-1的蛋白含量。
1.2.7 TLR4信号通路测定为了探究姜黄素是否是通过抑制TLR4的炎症反应而抑制其他炎症因子的过表达,故用TLR4抑制剂TAK-242(5 μmol/L)和/或姜黄素(30 μg/mL)预处理HUVEC细胞1 h后,然后用LPS刺激(1 μg/mL)处理24 h后,采用上述方法,分别检测该上清液中TNF-α和MCP-1的蛋白含量。
1.2.8 NF-κB信号通路测定为了观察姜黄素是否通过抑制NF-κB的途径,从而抑制LPS诱导HUVEC细胞TNF-α和MCP-1的表达,首先采用30 μmol/L姜黄素干预细胞,然后用LPS(1 μg/mL)处理细胞,收集刺激后24 h细胞总蛋白,利用相应抗体进行Western blot分析。
1.3 统计学方法应用软件SPSS19.0进行数据分析,计量资料以均数±标准差表示。采用单因素方差分析方法(One-way ANOVA)对单因素处理组间的数据进行比较,P<0.05表示差异具有统计学意义。
2 结果
2.1 姜黄素对LPS诱导HUVEC细胞TNF-α和 MCP-1表达的干预效应本实验研究中,首先用不同梯度浓度(5 μmol/L、10 μmol/L或30 μmol/L)的姜黄素预先处理HUVEC细胞,然后加入1 μg/mL的LPS分别刺激2 h和24 h,分别收集刺激2 h和24 h后的细胞及相应的上清液,用于TNF-α和MCP-1基因和蛋白表达的分析。结果表明:LPS能够诱导HUVEC细胞TNF-α和MCP-1 mRNA和蛋白表达明显地的升高,并且姜黄素以浓度依赖性方式抑制TNF-α和MCP-1的过表达(图1),与空白对照组比较差异有统计学意义(P<0.05),见表1。
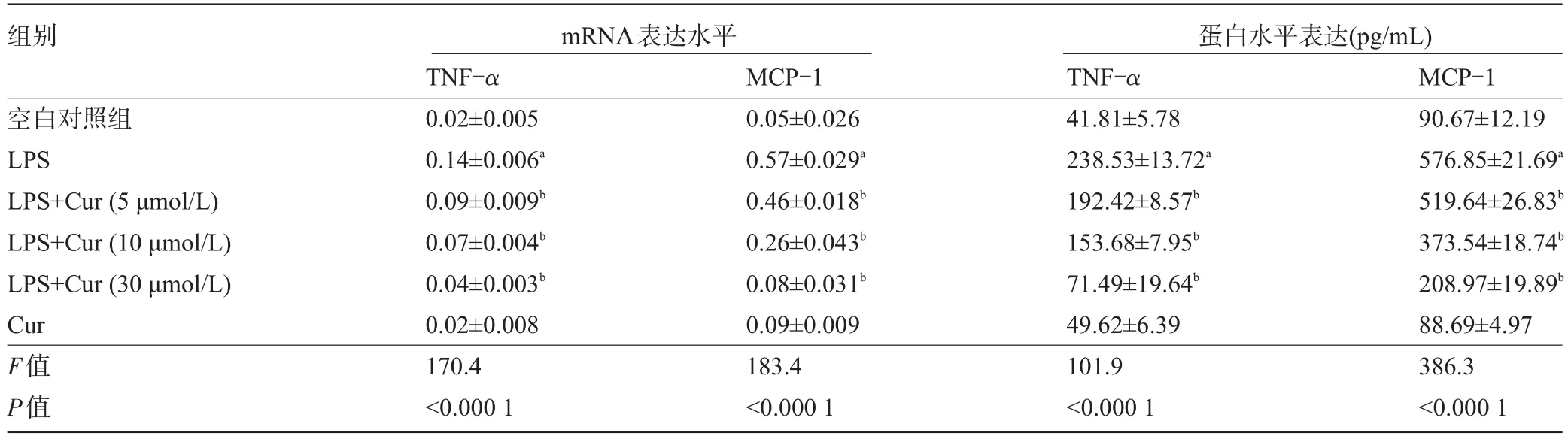
表1 姜黄素对LPS诱导HUVEC细胞表达TNF-α和MCP-1的影响

图1 姜黄素对LPS诱导HUVEC细胞表达TNF-α和MCP-1的影响
2.2 姜黄素对LPS刺激炎症因子过表达的抑制效应与TLR4之间的关系LPS(1 μ g/mL)刺激HUVEC细胞24 h后,TLR4 mRNA和蛋白表达显著增加(图2A、图2B)。然而,在用姜黄素(30 μmol/L)预处理的HUVEC细胞中,能够抑制LPS刺激TLR4 mRNA(图2A)和蛋白(图2B)的过表达。结果如图2C和图2D所示,用TAK-242和姜黄素预处理的都能部分抑制LPS诱导HUVEC细胞TNF-α和MCP-1的过表达。此外,TAK-242和姜黄素联合用药能协同逆转LPS诱导的TNF-α和MCP-1的表达(图2C、图2D)。结果表明TLR4可能涉及姜黄素抑制LPS诱导HUVEC的炎症,见表2。
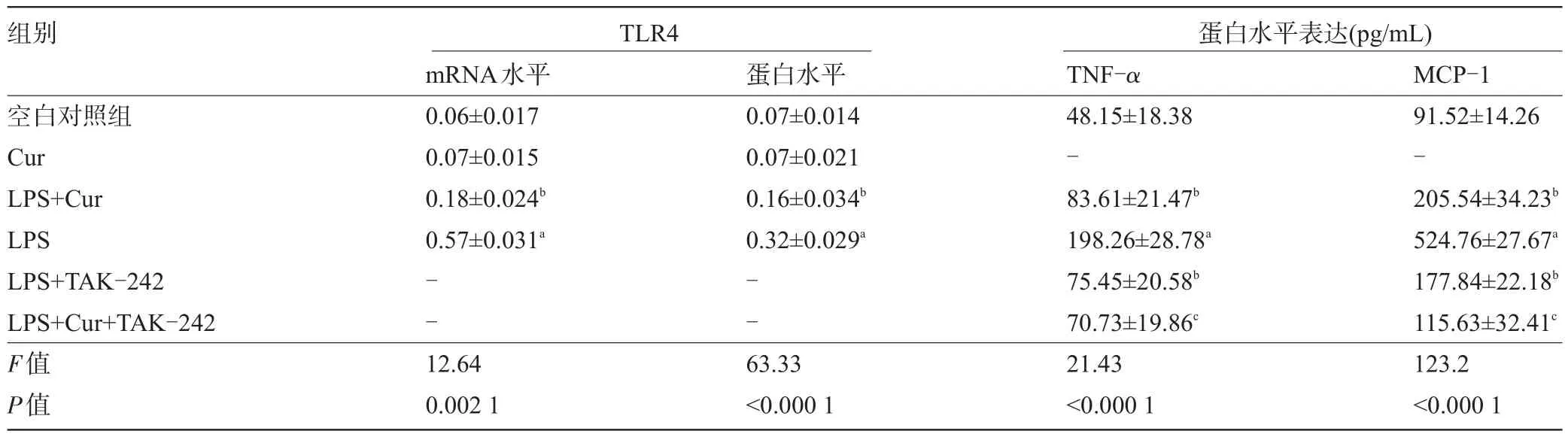
表2 姜黄素对LPS诱导HUVEC细胞表达TLR4、TNF-α和MCP-1的影响

图2 姜黄素对LPS诱导HUVEC细胞炎症的抑制效应与TLR4之间的关系
2.3 姜黄素对LPS刺激HUVEC细胞NF-κB p65磷酸化和IκB-α蛋白的影响用LPS刺激HUVEC细胞24 h后,IκBα蛋白显著降低,而NF-κB p65的磷酸化显著增加;与空白对照组比较,姜黄素能明显抑制IκBα蛋白降解和p-NF-κB p65的表达,见图3。
2.4 姜黄素对LPS刺激HUVEC细胞MAPK信号途径的影响MAPK信号传导途径是重要的级联反应,为了确定MAPK信号传导途径是否参与了姜黄素抑制LPS诱导的炎症反应。而与对照组比较,LPS (1 μg/mL)处理HUVEC细胞30 min,p38MAPK、ERK1/2及JNK1/2的磷酸化是显著增加。然而,姜黄素预处理HUVEC细胞1 h后,能显著减弱MAPKs(p38MAPK、ERK1/2及JNK1/2)的磷酸化(图4)。这些实验结果表明,该MAPK信号途径参与了姜黄素抑制LPS诱导HUVEC细胞的炎症反应。

图3 姜黄素对LPS诱导HUVEC细胞p-NF-κB p65及IκBα的影响

图4 姜黄素对LPS刺激HUVEC细胞MAPKs信号通路磷酸化的影响
3 讨论
AS作为心脑血管疾病的共同病理基础,在其早期的病理进程中,炎症细胞(特别是单核细胞)与活化的血管内皮细胞(ECs)发生粘附和迁移的过程,被认为是形成AS最重要的始动环节。大量的研究已经表明AS是由多因素导致的,在AS和斑块不稳定性的发生、发展中,持久的、低级别的炎症反应扮演重要的作用[1]。MCP-1可以招募单核细胞进入内膜和动脉壁,从而在炎症中扮演重要角色[12]。TNF-α则可以通过提高其他炎性细胞因子等的产生,促进粘附分子的表达来影响白细胞、单核细胞、淋巴细胞等与血管内皮细胞之间的粘附及迁移,从而加剧AS病变的进程,并引发形成不稳定性的斑块[13]。此外,炎症因子的表达同时受转录因子NF-κB的调节。有文献报道LPS可激活TLR4/NF-κ B途径上调内皮细胞MCP-1和TNF-α等炎症因子,参与单核细胞聚集,启动进一步炎症反应[14]。
目前治疗AS的主要方法是以降血脂为主,辅以使用对血管内皮细胞损伤、血栓形成、免疫损伤起抑制作用的药物。姜黄素是治疗AS的常用药物。近年来的研究发现,姜黄素在缓解炎症反应、抗免疫性疾病、抗氧化等方面也发挥了重要作用。美国VITY维他命杂志报道,姜黄素具有抗炎、抗凝、降脂、抗氧化、消除自由基等抗AS和抑制肿瘤生长等多种重要的药理作用[15-18]。而且,近期Zhong等[11]报道姜黄素能抑制血管细胞粘附分子-1(VCAM-1)的过表达。
本研究结果发现,LPS能显著增加HUVEC细胞TNF-α和MCP-1的表达,这与先前的报道一致[15-18]。更重要的是,姜黄素能以浓度依赖的方式有效地抑制LPS诱导的促炎性细胞因子(TNF-α和MCP-1)的过表达。此外,已有一些研究证实在不同类型的细胞中,姜黄素也能抑制ox-LDL、PMA诱导的炎症[19-20]。因此,我们认为姜黄素的抗炎作用可能是多重的,而不是特异性针对脂多糖的。我们猜测可能的机制是姜黄素通过抑制TLR4-MAPKs/NF-κB途径来调控HUVEC细胞TNF-α和MCP-1的表达。实验研究结果也验证了这一猜测,姜黄素不仅可以抑制LPS诱导HUVEC细胞TLR4 mRNA和蛋白的表达,也能减弱NF-κB p65和MAPKs(p38MAPK、ERK1/2及JNK1/2)的磷酸化。说明姜黄素可通过抑制TNF-α和MCP-1的表达,减少单核细胞向炎症部位的迁移以及内皮细胞的损伤,从而达到抗AS的作用。这可能是姜黄素抗AS的作用机制之一,为临床应用及治疗提供了合理的思路和有效的实验室资料。
综上所述,姜黄素能衰减LPS诱导HUVEC细胞TNF-α和MCP-1的表达;姜黄素抑制炎症反应的能力,可能部分是基于抑制TLR4的活化、抑制ERK1/2、p38 MAPKs、JNK1/2和NF-κB的磷酸化。因此,本实验研究为姜黄素作为治疗AS等慢性炎症性疾病潜在的治疗剂而提供了新的且更加有力的实验依据。
[1]Libby P,Ridker PM,Hansson GK,et al.Inflammation in atherosclerosis:from pathophysiology to practice[J].J Am Coll Cardiol,2009, 54(23):2129-2138.
[2]Hansson GK.Inflammation,atherosclerosis and coronary artery disease[J].N Engl J Med,2005,352(16):1685-1695.
[3]Zhang WJ,Wei H,Hagen T,et al.Alpha-lipoic acid attenuates LPS-inducedinflammatoryresponsesbyactivatingthephosphoinositide 3-kinase/Akt signaling pathway[J].Proc Natl Acad Sci USA,2007,104(10):4077-4082.
[4]何玉辉,刘惠亮.粘附分子与动脉粥样硬化关系的研究进展[J].疑难病杂志,2006,5(2):155-157.
[5]Ji Y,Liu J,Wang Z,et al.PPARγ agonist rosiglitazone ameliorates LPS-induced inflammation in vascular smooth muscle cells via the TLR4/TRIF/IRF3/IP-10 signaling pathway[J].Cytokine,2011,55 (3):409-419.
[6]陈思砚,潘静,陈生弟.姜黄素在神经系统疾病治疗中的应用[J].上海交通大学学报(医学版),2010,30(6):732-734,741.
[7]Manju S,Sreenivasan K.Conjugation of curcumin onto hyaluronic acid enhances its aqueous solubility and stability[J].J Colloid Interface Sci,2011,359(1):318-325.
[8]Virmani R,Farb A.Pathology of in-stent restenosis[J].Curr Opin Lipidol,1999,10(6):499-506.
[9]Moreno PR,Palacios IF,Leon MN,et al.Histopathologic comparison of human coronary in-stent and post-balloon angioplasty restenotic tissue[J].Am J Cardiol,1999,84(4):462-466
[10]Sikora E,Scapagnini G,Barbagallo M.Curcumin,inflammation,ageing and age-related diseases[J].ImmunAgeing,2010,7(1):1.
[11]Zhong Y,Liu T,Guo Z.Curcumin inhibits ox-LDL-induced MCP-1 expression by suppressing the p38MAPK and NF-kappaB pathways in rat vascular smooth muscle cells[J].Inflamm Res,2012,61(1): 61-67.
[12]Nelken NA,Coughlin SR,Gordon D,et al.Monocyte chemoattractant protein-1 in human atheromatous plaques[J].J Clin Invest, 1991,88(4):1121-1127.
[13]Boyle JJ,Weissberg PL,Bennett MR.Tumor necrosis factor-alpha promotes macrophage-induced vascular smooth muscle cell apoptosis by direct and autocrine mechanisms[J].Arterioscler Thromb Vasc Biol,2003,23(9):1553-1558.
[14]Heo SK,Yun HJ,Noh EK,et al.LPS induces inflammatory responses in human aortic vascular smooth muscle cells via Toll like receptor 4 expression and nitric oxide production[J].Immunol Lett,2008, 120(1-2):57-64.
[15]龙明智,陈磊磊.姜黄素的药理作用[J].国外医学:中医中药分册, 2003,25(5):270-272.
[16]林梅瑟,杨德业,赵志光,等.姜黄素对动脉粥样硬化兔血脂和血管内皮功能的影响[J].心脑血管病防治,2007,7(2):89-91.
[17]胡静,李立.姜黄素药理作用研究现状[J].检验医学与临床,2007,4 (12):1186-1187
[18]贾绍华,张舜尧.姜黄素药理作用研究进展[J].中国现代药物应用, 2009,3(22):188-189.
[19]Um MY,Hwang KH,Choi WH,et al.Curcumin attenuates adhesion molecules and matrix metalloproteinase expression in hypercholesterolemic rabbits[J].Nutr Res,2014,34(10):886-893.
[20]Zhou Y,Zhang T,Wang X,et al.Curcumin modulates macrophage polarization through the inhibition of the toll-Like receptor 4 expression and its signaling pathways[J].Cell Physiol Biochem,2015,36 (2):631-641.
Effect of curcumin on inflammatory response induced by lipopolysaccharide in human umbilical vein endothelial cells and its molecular mechanisms.
GAO Yu-lan1,YAO Yong-liang2,YU Li-ya2,WU Jian-hong2,PU Xiong-yong2, HUANG Feng2,XIA Long-fei3.1.Department of Radioimmunoassay,the First People's Hospital of Kunshan Affiliated to Jiangsu University,Suzhou 215300,Jiangsu,CHINA;2.Department of Clinical Laboratory,the First People's Hospital of Kunshan Affiliated to Jiangsu University,Suzhou 215300,Jiangsu,CHINA;3.School of Medicine,Jiangsu University, Zhenjiang 212013,Jiangsu,CHINA
ObjectiveTo investigate the effect of curcumin on the expression of inflammatory response induced by lipopolysaccharide(LPS)in human umbilical vein endothelial cells(HUVEC)and to explore its molecular mechanisms.Methods The total RNA was extracted from HUVEC treated with LPS(1 μg/L)and curcumin(5,15,or 30 μmol/L)for 24 h.The levels of tumor necrosis factor-α(TNF-α)and monocyte chemoattractant protein-1(MCP-1) were detected using real-time reverse transcriptase polymerase chain reaction(RT-PCR)and enzyme-linked immunosorbent assay(ELISA).Western blot was used to detect the activation of Toll like receptor 4(TLR4),mitogen-activated protein kinases(MAPKs),nuclear factor kappa B(NF-κB)p65,phosphor-NF-κB p65 and nuclear factor of kappa light polypeptide gene enhancer in B-cells inhibitor alpha(IκBα)in the cells.ResultsCompared with the untreated cells,curcumin significantly inhibited the overexpression of TNF-α,MCP-1 and TLR4 in HUVEC cells induced by LPS(P<0.05),which also significantly reduced NF-κB p65 and MAPKs phosphorylation and IκBα protein degradation.ConclusionCurcumin suppresses LPS-induced inflammatory response in HUVEC in vitro via inhibiting the TLR4/NF-κB pathways.
Curcumin;Atherosclerosis;Lipopolysaccharide(LPS);Nuclear factor kappa B(NF-κB);Human umbilical vein endothelial cells(HUVEC)
10.3969/j.issn.1003-6350.2017.15.003
R543
A
1003—6350(2017)15—2418—06
2016-12-01)
江苏省昆山市社会发展科技专项项目(编号:KS1645)
黄锋。E-mail:huangfengksrmyy@163.com

