基因芯片技术检测分枝杆菌和异烟肼、利福平耐药性在结核性脓胸诊断中的应用
林秀华,赖国祥,陈雨燕,郑 丹,周银发,陈晓红
基因芯片技术检测分枝杆菌和异烟肼、利福平耐药性在结核性脓胸诊断中的应用
林秀华1,赖国祥1,陈雨燕3,郑 丹4,周银发5,陈晓红2
目的探讨基因芯片技术检测分枝杆菌和异烟肼(INH)、利福平(RFP)耐药性在结核性脓胸诊断中的临床应用价值。方法收集2011年1月至2015年12月临床疑似结核性脓胸患者182例的脓液标本,分别应用基因芯片技术和快速培养法进行检测,比较两种方法的特异性和敏感性;同时选取36例临床确诊为结核性脓胸患者,且基因芯片法和MGIT培养法均为阳性的标本进行INH、RFP耐药性检测。以MGIT培养法的药敏结果为标准,评价基因芯片法的灵敏度、特异度和符合率。结果182例疑似结核性脓胸患者中,135例临床确诊为结核性脓胸,基因芯片法和快速培养法的特异性均为95.7%(45/47),灵敏度分别为48.9%(66/135)和26.7%(36/135),二者比较有统计学差异(χ2=80.5,P<0.05)。基因芯片法检测RFP耐药性灵敏度、特异度和符合率均为100%;而检测INH耐药性的灵敏度、特异度和符合率分别为50.0%(1/2)和97.1%(33/34)和94.4%。结论基因芯片技术检测分枝杆菌具有较高的、特异性,可快速鉴别出非结核分枝杆菌,且可有效检测结核分枝杆菌异烟肼和利福平的耐药性,对结核性脓胸的早期诊断与治疗有重要意义。
基因芯片;分枝杆菌;耐药性;结核性脓胸
渗出性胸膜炎不及时治疗或治疗不当,或胸膜下结核病灶向胸膜腔破溃,大量干酪物质及结核菌进入胸膜腔,就可发展为脓胸[1]。这类患者多发病缓慢,症状较轻且无明显特异性,容易漏诊或误诊。若早期诊断,积极治疗,疗效多数良好,相反,若未及时诊治,则可出现胸膜明显肥厚、胸廓塌陷等,需行胸膜纤维板剥脱术、胸廓改形术或胸膜肺切除术等,严重影响生活质量,预后差。结核性脓胸的传统诊断方法主要是脓液直接涂片找抗酸杆菌,其敏感性不超过5%,特异性也低,无法区分出非结核分枝杆菌(NTM)。结核菌培养的营养要求较高、生长缓慢、需要菌种鉴定,耗时长、阳性率低,故急需一种敏感、快速且特异性高的新技术应用于临床。
基因芯片技术,也称DNA微阵列芯片技术,是近年发展起来的又一新的分子生物学研究工具。它具有操作简便、准确、快速、特异性高、信息量大、成本较低等特点。近年来有国外学者将其应用于结核病耐药基因的研究[2-3],也可对可疑的临床标本进行分枝杆菌属DNA[4-5]的检测。国内也有研究报道:以传统分枝杆菌菌种鉴定方法为对照,应用DNA芯片技术对134株临床分离株进行菌种鉴定,结果两种方法鉴定结果一致和基本一致共112株,吻合率为83.6%[6],提示DNA芯片检测技术可以简便、快速、准确地对大多数分枝杆菌进行鉴定。为评价基因芯片技术在结核性脓胸中的价值,本文回顾性分析182例疑似结核性脓胸患者的检测数据,现报道如下。
1 材料与方法
1.1 一般资料 收集2011年1月至2015年12月福建省福州肺科医院及南京军区福州总医院门诊就诊及住院的疑似结核性脓胸患者182例,其中男性87例,女性95例,年龄20~82岁,平均年龄54.8岁。1.2 疑似结核性脓胸患者入选标准 1)有结核病史、症状、体征;2)胸腔穿刺所得脓液稀薄、淡黄色或含有干酪样物质,脓液细胞总数大于10×109/L,以淋巴细胞为主,蛋白大于40 g/L,比重大于1.020;3)具有助于诊断的X线与B超检查结果。
1.3 结核性脓胸的确诊标准 满足以上疑似结核性脓胸入选标准后加以下任何一点。1)脓液涂片找抗酸杆菌阳性和结核TB-DNA阳性,抗结核治疗有效;2)脓液结核菌培养阳性或菌种鉴定检出结核分枝杆菌符合群。
1.4 仪器与试剂 应用北京博奥生物有限公司生产的分枝杆菌菌种鉴定芯片及Lux ScanTM10K/B 微阵列芯片扫描仪等配套仪器进行检测。应用美国BD公司生产的BACTEC MGIT960结核菌快速培养仪行结核菌培养。
1.5 基因芯片检测 应用芯片检测结核分枝杆菌复合群和16种NTM,同时可检测异烟肼、利福平的耐药性。
1.5.1 标本处理 吸取混匀的脓液标本400 μL,加入1.5 mL离心管中,加入等量的10%氢氧化钠,震荡混匀1~3 min,室温静置15 min。
1.5.2 分枝杆菌菌种鉴定及耐药位点检测 按基因芯片试剂盒说明书的操作流程顺序进行,包括核酸提取、PCR扩增、芯片杂交、芯片洗涤、芯片扫描。
1.6 结核菌快速培养法
1.6.1 脓液标本的收集和处理 严格遵守无菌操作规程,收集脓液于无菌试管内供检查。
1.6.2 培养 吸取约5 mL脓液加入带有螺旋帽的50 mL离心管中,加入与标本等量的NaOH-枸橼酸钠前处理液,盖紧盖子,充分漩涡振荡,直至彻底液化。室温静置15~20 min(不超过25 min,以防杀死结核菌)后,将该管放入震荡器中,整个过程轻微混合。加入PBS(PH6.8)至45 mL,盖紧盖子;3 000 g离心15 min,然后弃去上清,留沉淀。加入1~2 mLPBS(PH6.8),混合均匀,以制备成悬浊液。抽取0. 5mL的沉淀物接种在已加入0.8 mL营养添加剂和抑菌剂的MGIT培养管内,扫描MGIT培养管后将其放入BACTEC MGIT960全自动分枝杆菌培养仪孵育检测。
1.6.3 结果判断 接种过的MGIT试管放入BACTEC MGIT960仪器的孵育抽屉,保存温度在37±1 ℃,由仪器自动监测。系统报告阳性后取菌液涂片进行抗酸染色,同时经菌种鉴定为结核分枝杆菌后报告结核分枝杆菌培养阳性;培养42 d仪器仍报告阴性,肉眼观察无细菌生长,则为结核分枝杆菌培养阴性。若见NTM生长,则重新培养一次并进行确认后报告NTM培养阳性。
1.7 统计学处理 采用SPSS 13.0软件完成数据统计分析,用率描述分类计数资料,计算基因芯片法行菌种鉴定和耐药位点检测的敏感性、特异性,以及结核菌培养法的敏感性和特异性,采用卡方检验比较两种方法在检测分枝杆菌敏感性、特异性方面的差异,P<0.05为差异有统计学意义。
2 结 果
2.1 基因芯片法与快速培养法的检测结果 对纳入分析的182例患者进行统计,经临床确诊135例阳性(结核性脓胸),47例阴性(2例NTM和45例为脓胸);基因芯片法与快速培养法的两例假阳性标本均是NTM;以临床确诊为金标准,基因芯片法检测结核分枝杆菌的特异性与MGIT培养法一致均为95.7%(45/47),但基因芯片法的敏感性为48.9%(66/135),MGIT培养法的敏感性为26.7%(36/135)。基因芯片法与MGIT培养法的结核分枝杆菌阳性检出率有统计学差异(χ2=80.5,P<0.05)。(见表1、表2)
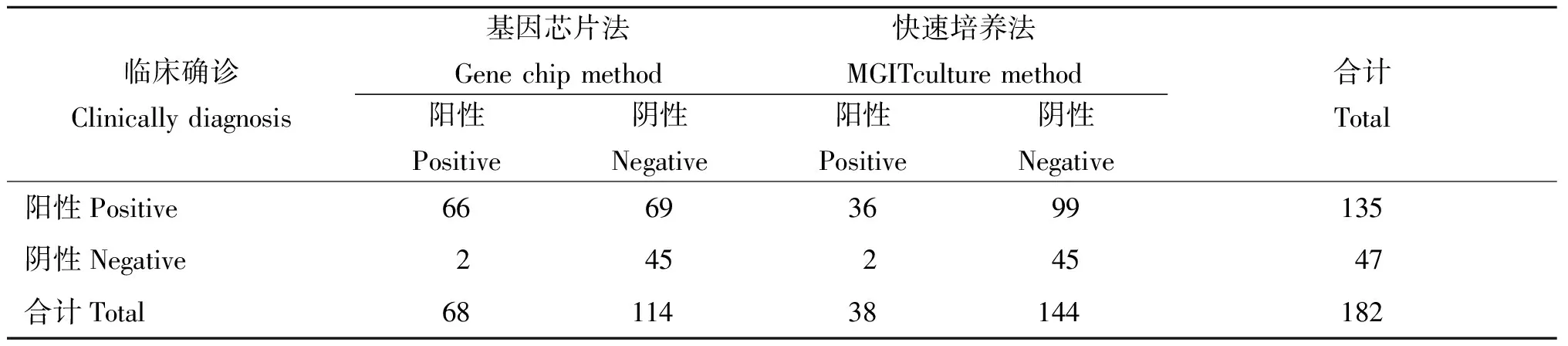
表1 基因芯片法与快速培养法的检测结果(例)Tab.1 Results of gene chip method and MGIT culture method
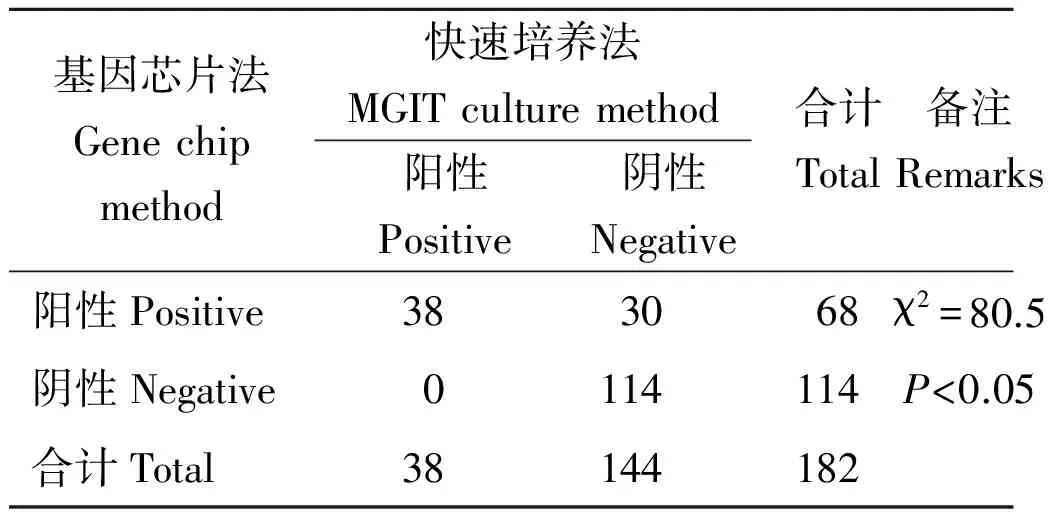
表2 基因芯片法与快速培养法卡方检验Tab.2 Chi-square test between gene chip method and MGIT culture method
2.2 NTM检测结果 本组病例共检出2例非结核分枝杆菌,经博奥基因芯片检测结果为胞内分枝杆菌1株,龟/脓肿分枝杆菌1株。
2.3 基因芯片法检测结核分枝杆菌对异烟肼的耐药性结果 从确诊为结核性脓胸的患者标本中选取36例基因芯片法和MGIT培养法均为阳性的标本进行INH、RFP耐药性检测。以MGIT培养法的药敏结果为标准,基因芯片法检测RFP耐药性灵敏度、特异性和符合率均为100%;而检测INH耐药性的灵敏度与特异度和符合率分别为50.0%(1/2)和97.1%(33/34)和94.4%。(见表3)

表3 基因芯片法检测结核分枝杆菌对异烟肼的耐药性(例)Tab.3 Detection of Mycobacterium tuberculosis resistance to isoniazid by gene chip method
3 讨 论
基因芯片诞生于1992年,自从将其应用在结核分枝杆菌菌种鉴定方面后[7],引起了国内外众多学者的研究兴趣,近年来逐渐成为结核病诊断的一项新技术。它可以在一张芯片上同时检测多达数百个标本,检测时间短(≤6 h),所需标本量少,可对痰液、尿液、胸腹水、心包积液、脓液、脑脊液、肺泡灌洗液等多种临床标本检测出结核分枝杆菌(复合群)与临床常见的16个种、群的NTM,主要是应用反向斑点杂交的方法对结核分枝杆菌基因的保守区域进行检测,结果由软件自动判读,能明显减少人为因素的影响,可重复性强,便于临床实验室开展检测。而且,基因芯片法灵敏度和特异性高,检测成本低,对我国结核病的早期诊断、鉴别诊断和治疗有重要意义。
本研究将基因芯片技术应用于脓液的检测,其敏感性高于快速培养法,特异性与培养法无明显差异。赵连爽等[8]应用基因芯片技术对不同类型的标本进行分枝杆菌菌种鉴定,发现穿刺脓液的阳性率最高,为33.3%。本研究中分枝杆菌检出阳性率稍高,考虑可能与上述研究中标本量少(仅6例),且均非结核性脓胸患者有关。基因芯片法检测分枝杆菌的阳性率与疾病的范围、部位、病程、标本含菌量、所留取标本的质量、操作过程等因素均有关。张立群等[9]的研究中发现标本的液化对检测结果有较大影响,样本浓度对结果的影响较小。特别是对于胸水或腹水等蛋白含量高的标本,经过高温灭活处理后呈胶冻状,对核酸的提取有较大影响。故为了保证结果的敏感性、可重复性,在基因芯片技术的操作过程中必须严格进行质量控制。
本研究提示:基因芯片法不仅是一种方便、快捷、敏感、特异的检测手段,而且可鉴别出NTM引起的结核性脓胸。NTM感染引起的脓胸的临床表现与结核分枝杆菌感染类似,临床无法区分,抗酸染色也无法鉴别,且NTM对大多数一、二线抗结核药物均耐药,若不能得到及时诊断和治疗,甚至可引起全身播散性疾病[10-12]。近年来,随着人免疫缺陷病毒感染人数的不断增加、激素等各种免疫抑制剂的广泛应用、NTM鉴定技术的提高、临床医生对NTM病的警惕性增强、医源性感染机会增多等,NTM病逐渐增多[13-14]。对于临床上病史长、中毒症状轻,有慢性肺部疾病、规则抗结核后疗效欠佳的结核性脓胸患者,应考虑到NTM播散的可能。
此外,基因芯片法可在7-8 h内对脓液进行INH、RFP的耐药检测,极大地缩短了检测时间,满足了临床快速检测的需求。本研究基因芯片法RFP耐药性检测结果与MGIT培养法一致,符合率100%,与邓叶华[15]、欧维正的研究结果一致[16]。RFP的耐药机制主要是rpoB基因的突变,导致空间构象发生变化,阻止了与FRP的结合,约95%在所分离的rpoB序列内的不同部位存在突变。冉兵等研究表明[17],基因芯片方法具有较好的诊断价值;以传统的药敏法为金标准,基因芯片方法特异度、敏感度,诊断OR值均较高,说明其在结核菌对RFP耐药检出率较高,可作为临床结核分枝杆菌检测的辅助手段。
不过,以快速培养法为金标准,基因芯片法对INH耐药性检出的特异度高,灵敏度较低。现有的研究证实INH的耐药涉及多个基因的多个位点突变,该芯片仅能检测KatG和inhA两个位点,而KatG和InhA基因位点突变引起的INH耐药只占总INH耐药的70%[18]。同时,也由于结核分枝杆菌对INH耐药性存在地域性差异,不同地区检测结果不一致,有待将来在全国范围内进行大规模检测,明确各地区INH相关耐药基因的具体特征,制定出适合各个地区的基因芯片。
综上所述,基因芯片法不仅可以及时明确诊断,而且可以早期快速获得菌株的耐药性,在我国结核病高患病率高耐药率高死亡率的国情下对结核性脓胸的诊治具有重要的意义。
[1] Yan BY,Duanmu HJ.Tuberculosis[M].Beijing:Beijing Publishing House,2003:576-587.(in Chinese)
严碧涯,端木宏谨.结核病学[M].北京:北京出版社,2003:576-587.
[2] Bravo LT, Tuohy MJ, Ang C, et al. Pyrosequencing for rapid detection ofMycobacteriumtuberculosisresistance to rifampin, isoniazid, and fluoroquinolones[J]. Clin Microbiol, 2009, 47(12): 3985-3990.DOI: 10.1128/JCM.01229-09
[3] Pietzka AT, Indra A, Stoger A, et al. Rapid identification of multigrug-resistantMycobacteriumtuberculosisisolate by rpoB gene scanning using high-resolution melting curve PCR analysis[J]. J Antimicrob Chemother, 2009, 63: 1121-1127.DOI: 10.1093/jac/dkp124
[4] Ahmad S, Mokaddas E. Recent advances in the diagnosis and treatment of multidrug-resistant tuberculosis[J]. Respir Med, 2009, 103(12): 1777-1790.DOI: 10.1016/j.rmed.2009.07.010
[5] Zhu L, Jiang G, Wang S, et al. Biochip system for rapid and accurate identification of mycobacterial species from isolates and sputum[J]. J Clin Microbiol, 2010, 48(10): 3654-3660.DOI: 10.1128/JCM.00158-10
[6] Huang MX,Wang L,Zhang LS,et al.Rapid identification ofMycobacteriumspecies by DNA chip[J].Chin J Zoonoses,2010,26(6):555-557.(in Chinese)
黄明翔,王琳,张丽水,等.DNA芯片鉴定分枝杆菌的研究[J].中国人兽共患病学报,2010,26(6):555-557.
[7] Gingeras TR, Ghandour G, Wang E, et al. Simultaneous genotyping and species identification using hybridization pattern recognition analysis of genericMycobacteriumDNA arrays[J]. Genome Res, 1998, 8(5): 435-448.DOI:10.1101/gr.8.5.435
[8] Zhao LS,Dai D,Chen X,et al.Diagnostic value of gene chip in identification of mycobacterium and detection of drug ‐resistant genes[J].Lab Med Clin,2014,11 (12):1595-1598.(in Chinese)
赵连爽,代娣,陈昕,等.基因芯片在分枝杆菌菌种鉴定及结核耐药基因检测的诊断价值[J].检验医学与临床,2014,11(12):1595-1598.
[9] Zhang LQ,Wang YX,Yao CY,et al.High specificity gene chip methods for detection ofMycobacteriumtuberculosis:a clinical evaluation[J]. Chin J Nosocomiol,2010,20 (11) :1505-1508.(in Chinese)
张立群,王云霞,姚春艳,等.高特异性基因芯片法检测结核分枝杆菌的临床应用评价[J].中华医院感染学杂志,2010,20(11):1505-1508.
[10] Jia FZ,Li LJ.Infectious disease[M].Nanjing:Jiangsu Science and Technology Press, 2010: 545-550.(in Chinese)
贾辅忠,李兰娟.感染病学[M].南京:江苏科学技术出版社,2010:545-550.
[11] Tang SJ,Gao W.Clinical tuberculosis[M].Beijing:People’s Health Publishing House,2011:700-709.(in Chinese)
唐神结,高文.临床结核病学[M].北京:人民卫生出版社,2011:700-709.
[12] Taiwo B, Glassroth J. Nontuberculous mycobacterial lung diseases[J]. Infect Dis Clin North Am, 2010, 24: 769-789.DOI: 10.1016/j.idc.2010.04.008
[13] Ma Y.Focus on diagnosis and treatment of non-tuberculous mycobacteria lung disease[J].Chin J Tuberc Respir Dis,2011,34:566-568.(in Chinese)
马玙.关注非结核分枝杆菌肺病的诊断与治疗[J].中华结核和呼吸杂志,2011,34:566-568.
[14] Ma Y,Wang J.Pay attention to the identification of non-tuberculosis mycobacteria and pulmonary tuberculosis[J]. J Clin Pulm Med,20l0,15:301-302.
[15] Deng YH,Xiang YG,Ma XH,et al.Identification of drug-resistance gene type inMycobacteriumtuberculosisby gene chip in Hunan province[J].Int J Lab Med,2015,36(22):3223-3226.(in Chinese)
邓叶华,向延根,马小华,等.基因芯片法用于检测长沙地区结核分枝杆菌耐药性研究[J].国际检验医学杂志,2015,36(22):3223-3226.
[16] Ou WZ,Chen ZH,Chen J,et al.Determination of resistance genes Kat G and inh A inMycobacteriumtuberculosisisolates from Guizhou Province by gene chip[J]. Chin J Zoonoses,2015,31(7):655-658.DOI:10.3969/cjz.j.issn.1002-2694.2015.07.013(in Chinese)
欧维正,陈峥宏,陈静,等. 基因芯片技术检测贵州省结核分枝杆菌耐药基因KatG和inhA[J].中国人兽共患病学报,2015,31(7):655-658.
[17] Ran B,Cai L.Diagnostic accuracy of gene chip in identifying rifampicin resistanceMycobacteriumtuberculosis:a Meta-analysis[J].Chin J Antituberc,2015,37(1):56-65.
[18] Zhang CL,Zhao LN,Ren H.Application of gene chip technology to detect the four kinds of TB research of drug sensitive test[J].Harbin Medical J,2015,35(3):182-184.
Chen Xiao-hong, Email: cxhong6886@126.com
GenechiptechnologyfordetectingmycobacteriaandMycobacteriumtuberculosisresistanceofisoniazidandrifampinintheapplicationoftuberculousempyema
LIN Xiu-hua1, LAI Guo-xiang1, CHEN Yu-yan3, ZHENG Dan4, ZHOU Yin-fa5, CHEN Xiao-hong2
(1.DepartmentofRespiratoryandCriticalCareMedicine,FuzhouGeneralHospitalaffiliatedtoFujianMedicaluniversity,Fuzhou,350025,China;2.DepartmentofTuberculosis,FuzhoupulmonaryhospitalaffiliatedtoFujianMedicaluniversity,Fuzhou350008,China;3.Thethirdpeople'shospitalaffiliatedtoFujianuniversityoftraditionalChinesemedicine,Fuzhou350108,China;4.DepartmentofClinicallaboratory,FuzhoupulmonaryhospitalaffiliatedtoFujianMedicaluniversity,Fuzhou350008,China;5.Fujianprovincialcenterfordiseasecontrolandprevention,Fuzhou350008,China)
To evaluate the clinical value of gene chip technology (GCT) in detecting the mycoba-cteria, isoniazid and rifampin resistance of patients diagnosed tuberculous empyema.The 182 patients who met the inclusion criteria were enrolled to this study from January 2011 to December 2015, whose pus mycobacterial species were detected by GCT and MGIT, the simultaneous and sensitivity of them were compared. Meanwhile, 36 patients diagnosed tuberculous empyema were selected to detect isoniazid and rifampin resistance.The simultaneous and sensitivity of GCT were evaluated base on the standard of MGIT. The 135 patients were diagnosed by tuberculous empyema. The specificity of GCT was same to MGIT (95.7%), the the sensitivity was 48.9%(66/135)in GCT,26.7% in MGIT, there was significant difference between them (χ2=80.5,P<0.05).The sensitivity, specificity and coincidence rate of GCT in rifampin resistance were 100%,the sensitivity, specificityand coincidence rate in INH were 50.0%(1/2),97.1%(33/34) and 94.4%. Gene chip technology for detection of mycobacteria has high sensitivity and specificity, which can identify non-tuberculous mycobacteria quickly. And it can also effectively detect the resistance ofMycobacteriumtuberculosisto isoniazid and rifampicin.It has important significance in early diagnosis and treatment of tuberculous empyema.
gene chip;Mycobacterium; resistance; tuberculous empyema
10.3969/j.issn.1002-2694.2017.08.011
福建省卫生和计划生育委员会青年科研课题(No.2014-1-74)
陈晓红,Email: cxhong6886@126.com
1.福建医科大学福州总医院临床医学院呼吸与危重症医学科,福州 350025; 2.福建医科大学教学医院福州肺科医院结核科,福州 350008; 3.福建中医药大学附属第三人民医院,福州 350108; 4.福建医科大学教学医院福州肺科医院检验科,福州 350008; 5.福建省疾病预防控制中心,福州 350001
Supported by the Youth Research Project of Fujian Provincial Health and Family Planning Commission (No.2014-1-74)
R378.9
:A
:1002-2694(2017)08-0720-04
2016-12-09编辑:张智芳

