先天性白内障家系致病基因筛查及相关生物信息学分析
庄晓彤,肖伟
(1.沈阳市第四人民医院眼科,沈阳 110031;2.中国医科大学附属盛京医院眼科,沈阳 110004)
·论著·
先天性白内障家系致病基因筛查及相关生物信息学分析
庄晓彤1,肖伟2
(1.沈阳市第四人民医院眼科,沈阳 110031;2.中国医科大学附属盛京医院眼科,沈阳 110004)
目的 直接测序检测先天性白内障家系突变,探讨先天性白内障的可能机制。方法收集1个常染色体显性遗传的先天性白内障家系,进行候选基因(CRYGD基因)外显子测序筛查突变后,利用生物数据库分析CRYGD蛋白质野生型及突变型的理化特性以及翻译后的修饰、功能域、二级结构和三级结构等。结果对CRYGD基因直接测序显示,碱基第452位插入GACT 4个碱基,发生了移码突变。突变后等电点的变化影响晶状体细胞内的pH值。功能结构域变短,蛋白质内部重复性变化,从而影响蛋白功能。结论发现了CRYGD基因1个新的突变位点—Tyr151X,该突变为首次报道的由插入突变引起先天性白内障的CRYGD基因移码突变。
CRYGD基因;生物信息学;基因突变;先天性白内障
先天性白内障是一种临床常见的晶状体疾病,主要是胎儿发育过程中晶状体代谢异常形成不同程度、不同形式的晶状体混浊,它不仅使视网膜成像模糊,而且阻止视通路发育,造成单侧或双侧的视力损害甚至失明。晶状体蛋白是重要的结构蛋白,根据晶体蛋白的分子结构分为3种,3种晶体蛋白的成分比例以及空间排列顺序对于维持晶状体的透明性非常重要[1]。目前发现的很多先天性白内障家系都是由于晶体蛋白基因突变引起,约占50%以上,因此该基因成为先天性白内障重要的致病候选基因。本研究对象是1个常染色体显性遗传的四代家系,所有患者均表现为特征性前极缝性“Y”字形核混浊,到目前为止的相关报道中与其关系最为密切的是晶状体蛋白基因CRYGD,所以本研究对家系成员以CRYGD基因作为候选基因直接测序。
生物信息学应用先进的数据管理技术、数学分析模型和计算机软件,通过对生物信息查询、搜索和比较分析,揭示分子的结构,功能和进化等相关知识[2]。本研究通过对蛋白质序列和结构分析及蛋白质空间结构预测模拟及功能模拟,推测突变引起白内障的可能机制。
1 材料与方法
1.1 研究对象
选取中国医科大学附属盛京医院眼科就诊的具有常染色体显性遗传特点的先天性白内障家系,该家系传递4代(图1),共有成员14人,其中患者4例,无近亲婚姻史。严格遵循赫尔辛基宣言,在征得所有患者及其家属同意后对家系成员进行采样(取外周静脉血5 mL),并进行详细的临床检查。
1.2 基因测序
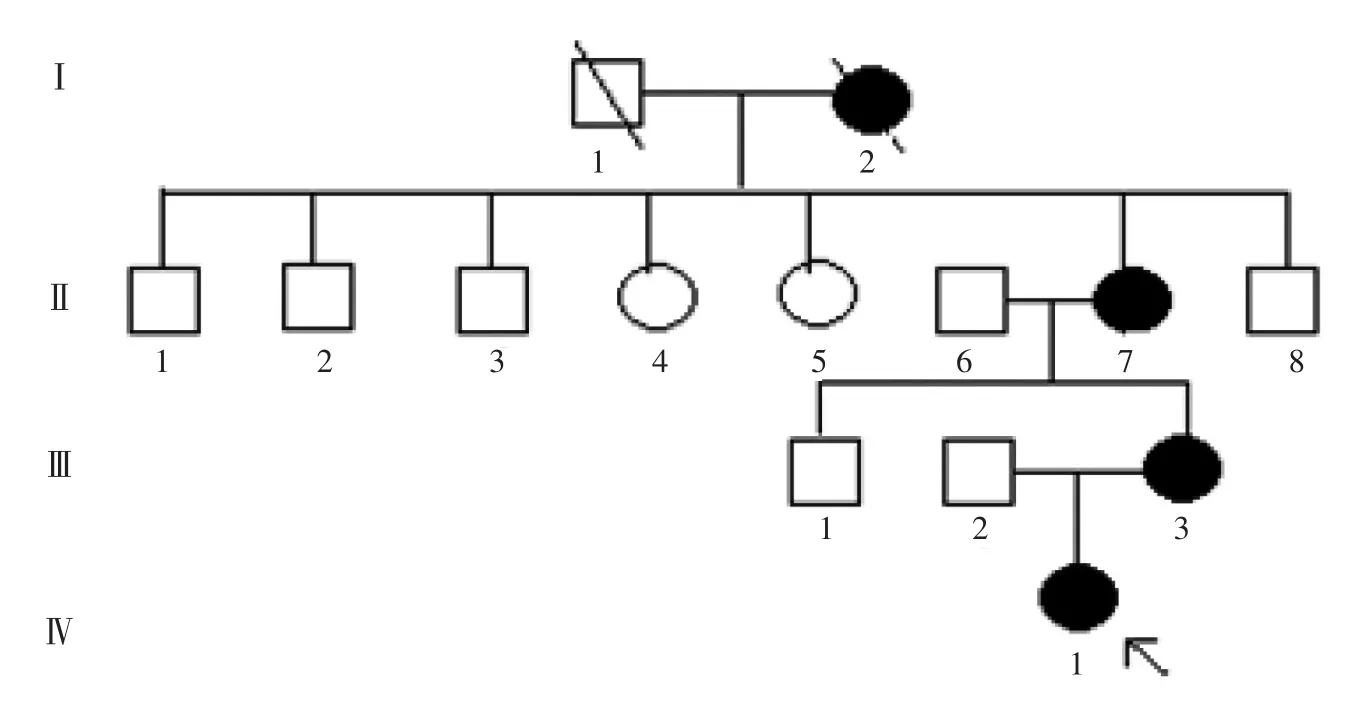
图1 先天性白内障家系图Fig.1 Pedigree of a Chinese family with autosomal dominant nuclear cataract
采用TIANamp Blood DNA Kit血液基因组试剂盒进行基因组DNA提取,紫外分光光度计检测样本DNA纯度和浓度。将提取的基因组(1 μL)以特定的引物进行PCR扩增,PCR结束后,取2 μL PCR产物于1%的琼脂糖凝胶上电泳,以证实扩增片段为目的片段。纯化后PCR产物(20~25 μL)送至北京美吉生物科技发展公司,使用美国ABIPRISMTM3730XL DNA自动测序仪,应用双脱氧末端进行双向测序。
1.3 野生型和突变型相关生物信息学分析
利用生物数据库NCBI(www.ncbi.nlm.nih.gov),Expasy(http://www.expasy.org/tools)和Radar(http:// www.ebi.ac.uk/Radar/index.html)生物网络软件包进行相关分析:突变后蛋白质的理化性质改变(分子量、等电点、氨基酸组成等),一级结构中糖基化、脂酰化、磷酸化、硫酸化等修饰位点和模序的变化。并构建蛋白质三维空间结构图。
2 结果
2.1 基因测序结果
对CRYGD基因直接测序显示,碱基第452位插入GACT 4个碱基,这个插入使碱基序列发生了移码突变,原碱基序列由TAT移码突变成终止密码TGA,导致转录提前终止。见图2。
2.2CRYGD基因相关生物信息学分析
2.2.1 蛋白质理化性质分析结果:野生型CRYGD通过软件分析,等电点为7.0,不稳定指数54.89,高于阈值(40),提示在溶液中性质不稳定,亲水性指数-0.804。突变型与野生型相比较,等电点为6.05,发生了明显变化,可能会引起蛋白质分子之间静电作用。不稳定指数变得更高,为56.82,提示突变型的CRYGD更加不稳定,亲水性指数变为-0.799,提示突变型CRYGD对于水的溶解性也有变化。见表1。
2.2.2 Expasy(http://www.expasy.org/tools)分析结果:野生型含有1个天门冬胺酰糖基化位点(50~53),1个酪蛋白激酶磷酸化位点(5~8);2个潜在的N-肉豆蔻酰位点(71~76、158~163);5个潜在的蛋白质激酶C磷酸化位点(35~37、75~77、78~80、87~89、166~168);1个细胞黏附序列(60~62);1个酪氨酸激酶磷酸化位点(91~98);4个晶体结构蛋白Greek Key序列(2~40、41~83、82~128、129~171)。CRYGD突变后功能结构域发生明显改变:1个N-肉豆蔻酰位点(158~163)缺失;1个蛋白质激酶C磷酸化位点(166~168)缺失;第4个晶体结构蛋白Greek Key序列(129~171)提前终止,功能结构域变短,缺失24个氨基酸。野生型CRYGD内部重复序列为4段,突变型内部重复序列为3段,并且氨基酸的长度明显缩短。
2.3 运用Swiss-model software(version3.7)网络蛋白质分析软件,预测CRYGD蛋白野生型和突变型的三级结构变化
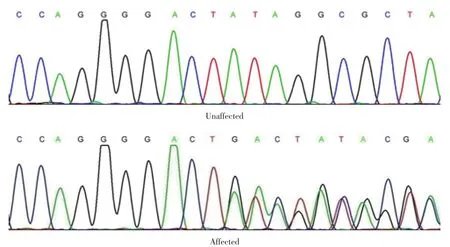
图2 家系成员CRYGD第3外显子测序图(示突变部分)Fig.2 Sequence map of exon 3 in CRYGD in the pedigree(the mutation is indicated)
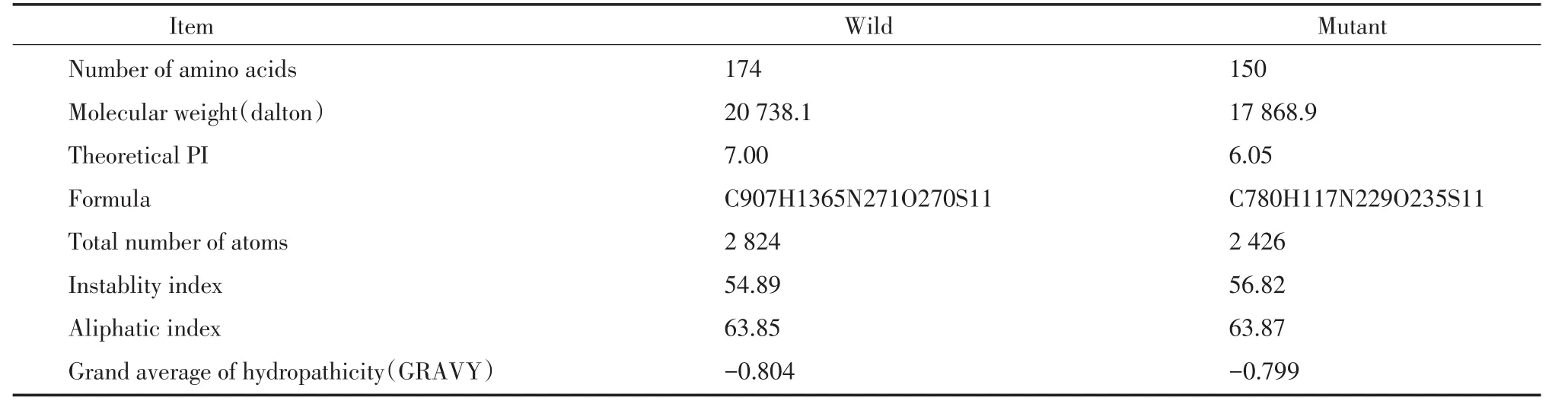
表1 野生型与突变型理化性质比较Tab.1 Comparison of CRYGD wild⁃type and mutant type
从三维结构上看,突变后该蛋白缺失了1个alpha螺旋和1段beta折叠,属于非常剧烈的突变。可以预计突变后立体结构不稳定,很可能生物学功能也将丧失。见图3。
3 讨论
本研究选择的是1个常染色体显性遗传的四代家系,所有的患者均表现为特征性前极缝性“Y”字形核混浊,到目前为止的相关报道中与其关系最为密切的是定位于2q33~35的晶状体蛋白基因CRYGD,由于该基因外显子仅有3个,而且编码区包含的碱基数只有608 bp,由174个氨基酸构成。所以对家系成员进行以CRYGD基因作为候选基因直接测序。结果表明在第3外显子第452碱基处发现了插入突变,插入的4个碱基直接导致了碱基的移码,终止密码提前出现,蛋白转录提前终止。
迄今为止,关于CRYGD基因的相关报道[3-5]大多数为单碱基的错义突变(包括R15C、P24T、R37S、R59H、E107A、W157X等),目前仅有1例报道[6]为单碱基的缺失造成移码突变(G165fs)。本研究第1次发现了因为CRYGD基因的碱基插入所导致的移码突变。
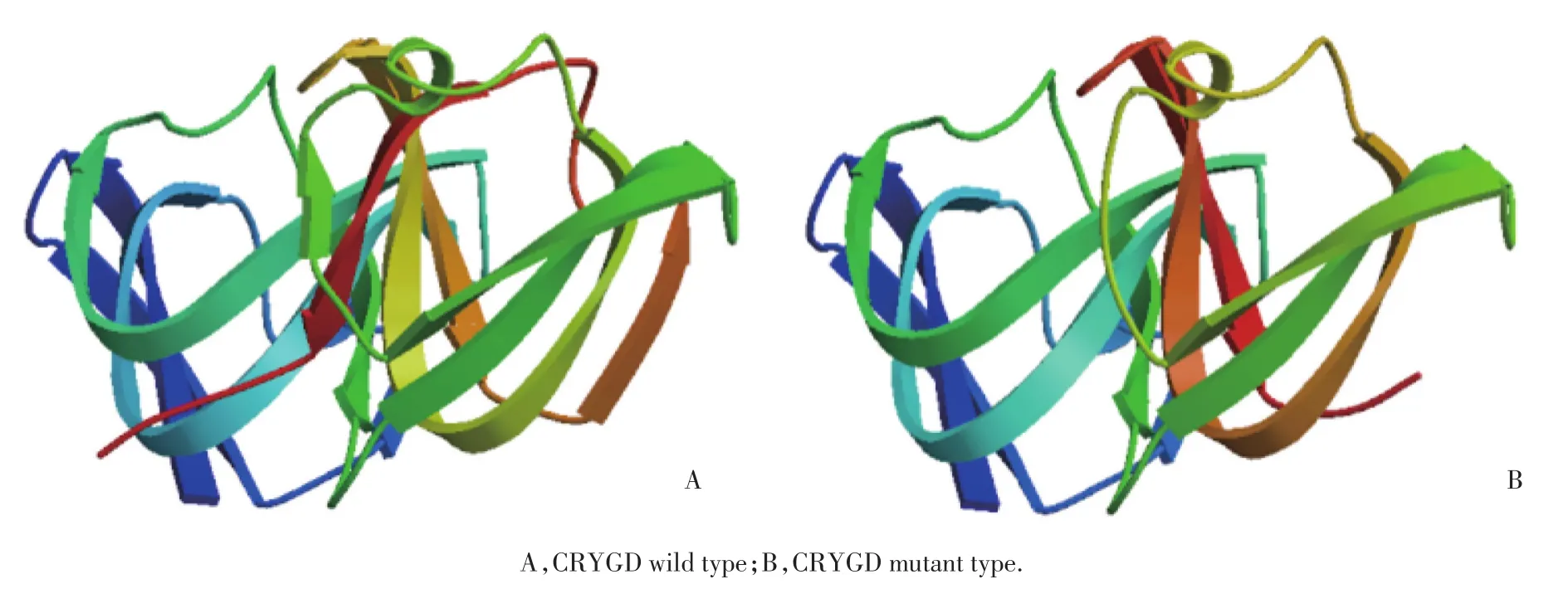
图3 CRYGD蛋白野生型和突变型的三级结构变化Fig.3 Comparison of the tertiary structure of wild⁃type and mutant CRYGD
利用基因组编码区的信息分析把野生型和突变型的DNA序列信息,通过多种生物学软件对野生型蛋白和突变型蛋白进行比较,发现其可能从以下几个方面,导致白内障的发生:(1)突变后等电点的变化影响晶状体细胞内的pH。生理条件下晶状体细胞内pH为7.0,野生型的CRYGD等电点也为7.0,这意味着CRYGD蛋白将不带电荷,均匀分布在晶状体纤维细胞中,从而保持晶状体的透明性[7-8];突变后,等电点下降为6.05,影响晶状体蛋白电荷性质,蛋白质间异常的静电作用可能会使其相互聚集,产生沉淀,影响晶状体蛋白的正常排列,导致白内障产生。(2)功能结构域变短突变使转录提前终止,第4个晶体结构蛋白Greek Key序列129~171提前终止,缺失24个氨基酸,整个CRYGD蛋白质的功能结构域变短,可能影响到蛋白质的正确折叠。(3)蛋白质内部的重复性变化。目前认为蛋白质内部重复片段在蛋白质序列进化的过程中具有重要意义,许多蛋白质通过内部复制进行进化,所以蛋白质内部的重复性与其功能和内部结构单位有关[9-11]。Tyr151X突变使得蛋白质内部的重复性发生改变,可能进而影响到蛋白质的功能。(4)蛋白质的三级结构变化将CRYGD及其突变序列分别输入Swiss-model,数据库将序列与蛋白质结构数据库中的蛋白质三维结构进行匹配,输回三维图像。从三维结构上看,突变后该蛋白缺失了1个alpha螺旋和1段beta折叠,属于非常剧烈的突变。可以预计突变后立体结构不稳定,很可能生物学功能也将丧失。
目前随着基因定位和克隆技术的不断发展,越来越多的先天性白内障致病基因被发现和克隆,极大地推动了白内障遗传学研究。但是由于受实验对象的限制,在发现致病基因后有时也很难对突变蛋白的结构、功能以及导致白内障的机制开展深入研究。生物信息学通过对DNA和蛋白质序列和结构分析,解读核酸和蛋白质序列中所表达的结构和功能的生物信息,计算机辅助蛋白建模则为预测和分析突变蛋白结构提供基础,为研究其功能及参与白内障发病机制提供思路。
[1]WISTOW G.The Human crystalline gene families[J].Hum Genomics,2012,6(1):26.DOI:10.1186/1479-7364-6-26.
[2]黄韧.生物信息学网络资源与应用[M].广州:中山大学出版社,2006:1.
[3]ROSHAN M,VIJAYA PH,LAVANYA GR,et al.A novel human CRYGD mutation in a juvenile autosomal dominant cataract[J]. Mol Vis,2010,16:887-896.
[4]ZHAI Y,LI JY,ZHU YN,et al.A nonsense mutation of γ D-crystallin associated with congenital nuclear and posterior polar cataract in a chinesefamily[J].Int J Med Sci,2014,11(2):158-163.DOI:10.7150/ijms.7567.
[5]DEVI RR,YAO W,VIJAYALAKSHMI P,et al.Crystallin gene mutations in Indian families with inherited pediatric cataract[J].Mol Vis,2008,14:1157-1170.
[6]ZHANG LY,YAM GH,FAN DS,et al.A novel deletion variant of gamma D-crystallin responsible for congenital nuclear cataract[J]. Mol Vis,2007,13:2096-2104.
[7]WISTOW G,BERNSTEIN SL,WYATT MK,et al.Expressed sequence tag analysis of adult human lens for the NEI bank project:over 2000 non-redundant transcripts,novel genes and splice variants[J].Mol Vis,2002,8:171-184.
[8]HOLM L,KÄÄRIÄINEN S,ROSENSTRÖM P,et al.Searching protein structure databases with DaliLitev.3[J].Bioinformatics,2008,24(23):2780-2781.DOI:10.1093/bioinformatics/btn507.
[9]LANG GK.Ophthalmology[M].New York:Thieme New York,2000:183-215.
[10]VENDRA VP,AGARWAL G,CHANDANI S,et al.Structural integrity of the Greek keymotif in beta gamma-crystallins is vital for central eye lens transparency[J].PLoS One,2013,8(8):e70336. DOI:10.1371/journal.pone.0070336.
[11]TALLA V,SRINIVASAN N,BALASUBRAMANIAN D.Visualization of in situ intracellular aggregation of two cataract-associated human gamma-crystallin mutants:lose a tail,lose transparency[J].Invest Ophthalmol Vis Sci,2008,49(8):3483-3490.DOI:10.1167/iovs.07-1114.
(编辑 武玉欣)
Pathogenic Genes and Protein Function Changes in a Congenital Hereditary Cataract Pedigree
ZHUANG Xiaotong1,XIAO Wei2
(1.Department of Ophthalmology,The Fourth People’s Hospital of Shenyang,Shenyang 110031,China;2.Department of Ophthalmology,Shengjing Hospital,China Medical University,Shenyang 110004,China)
ObjectiveWe screened for mutations in an autosomal dominant congenital cataract pedigree by gene sequence analysis to provide a basis for genetic diagnosis of congenital cataract.MethodsA Chinese family with congenital nuclear cataract was recruited for mutational screening of candidate genes by direct sequencing.We analyzed the differences between theCRYGDgene mutant and wild-type in terms of protein conformation and structural domains using bioinformatics methods.ResultsWe detected a novel heterozygous variant c.451_452insGACT in exon 3 ofCRYGD.Bioinformatics analysis showed that the mutated CRYGD protein structural domain became shorter,the conformation became simpler,and protein inner repeatability was altered,affecting protein function.ConclusionWe found that the Tyr151X gene mutation ofCRYGDcan lead to congenital hereditary cataract.To date,this is the only detected frameshift mutation caused by an insertion inCRYGDgene mutations.
CRYGDgene;bioinformatics;gene mutation;congenital cataract
R774.1
A
0258-4646(2017)08-0673-04
10.12007/j.issn.0258-4646.2017.08.001
国家自然科学基金(30973276)
庄晓彤(1978-),女,副主任医师,博士.
肖伟,E-mail:xiaow@sj-hospital.org
2017-01-07
网络出版时间:

