卡铂短期诱导人卵巢癌类干细胞的分离及初步鉴定
王宁,倪莎,周欣
(中国医科大学附属盛京医院妇产科,沈阳 110004)
卡铂短期诱导人卵巢癌类干细胞的分离及初步鉴定
王宁,倪莎,周欣
(中国医科大学附属盛京医院妇产科,沈阳 110004)
目的分离卡铂耐药型人卵巢癌类干细胞,为研发和筛选针对卡铂耐药的卵巢癌二线治疗药物提供细胞模型。方法从卵巢癌组织或腹水中分离培养卵巢癌细胞,直接或采用卡铂短期诱导后无血清悬浮培养,分离纯化获得卵巢癌类干细胞球,采用免疫荧光法或流式细胞术检测干细胞标志物的表达。结果卵巢癌原代细胞直接或采用卡铂短期诱导后无血清悬浮培养能够形成类干细胞球,并高表达干细胞标记物CD133,ALDH1,ABCG2和CD24。卡铂短期诱导分离的卵巢癌干细胞球中CD24+细胞含量明显增加。结论原代培养卵巢癌细胞经卡铂短期诱导后无血清悬浮培养,能进一步富集纯化卵巢癌类干细胞,可作为卵巢癌耐药研究的理想细胞模型。
卵巢癌;无血清悬浮培养;卵巢癌类干细胞球;卡铂
卵巢癌是最常见的也是致死率最高的妇科恶性肿瘤,其5年生存率约为20%~30%[1]。化疗耐药是造成卵巢癌患者复发和死亡的主要原因之一。研发和筛选针对铂类耐药的卵巢癌患者的药物对改善患者的预后具有重要意义。
目前的研究[2]认为肿瘤干细胞是肿瘤耐药和复发的根源,深入研究肿瘤干细胞的特性有助于进一步明确肿瘤耐药和复发的机制,同时,这类肿瘤干细胞也可以作为药物筛选的理想靶标。目前,已由卵巢癌组织和细胞系中成功分离出卵巢癌类干细胞[3-4]。铂类药物诱导可以由卵巢癌细胞系中分离纯化铂类耐药的卵巢癌类干细胞[5],是用于筛选二线化疗药的理想的细胞模型。由于原代培养的肿瘤细胞更接近并反映人体内的生物学特性,因而更适用于药敏检测实验[6]。本研究选用人卵巢癌组织和腹水,经原代培养并直接或采用卡铂短期诱导后无血清悬浮培养,分离纯化卵巢癌类干细胞球,并进行鉴定,为研发和筛选针对卡铂耐药的卵巢癌二线治疗药物提供细胞模型。
1 材料与方法
1.1 材料
新鲜的卵巢癌组织或腹水标本取自2015年12月至2016年12月中国医科大学附属盛京医院妇科病房收治的上皮性卵巢癌患者。本研究经盛京医院伦理委员会批准(编号:2016PS005K)。
CD24抗体(eBioscience公司,美国),兔抗人CD133抗体、羊抗兔荧光二抗、羊抗鼠荧光二抗(Proteintech公司,美国),兔抗人ALDH1抗体、鼠抗人ABCG2抗体(Abcam公司,英国)。
1.2 方法
1.2.1 由卵巢癌组织及腹水标本中原代培养卵巢癌细胞:培养方法参照文献[7-8],略加改进。
1.2.2 无血清悬浮培养分离纯化卵巢癌类干细胞[9]:选择生长状态良好的原代培养卵巢癌细胞,0.25%胰酶消化,制成单细胞悬液,离心收集细胞沉淀,加入无血清培养基,接种在超低吸附培养瓶中,置于37℃5%CO2培养箱培养。
1.2.3 卡铂短期诱导分离纯化卵巢癌类干细胞:选择生长状态良好的原代培养卵巢癌细胞,胰酶消化,制成单细胞悬液,接种于12孔板。待细胞长满培养孔80%时,加入终浓度为9.43 μg/mL的卡铂处理72 h,胰酶消化,制成单细胞悬液,加入无血清培养基,置于超低吸附培养瓶中悬浮培养。药物浓度及作用时间参照文献[5-8],略加改动。
1.2.4 细胞免疫荧光检测:制备细胞爬片和甩干贴片,分别加入100 μL一抗孵育24 h,加入二抗孵育1 h,DAPI染色,荧光抗淬灭剂封片,荧光显微镜观察,照相。
1.2.5 流式细胞仪检测:取生长状态良好的原代培养卵巢癌贴壁细胞和卵巢癌类干细胞球、经铂类诱导的卵巢癌类干细胞球,制成单细胞悬液,进行流式细胞仪检测。未经卡铂诱导和经卡铂诱导的卵巢癌类干细胞检测实验重复3次。
1.3 统计学分析
2 结果
2.1 由卵巢癌组织和腹水中分离卵巢癌类干细胞球
贴壁培养的卵巢癌原代细胞形态扁平,呈多角形,细胞间衔接紧密,培养1周可传代(图1)。无血清悬浮培养3 d后可以观察到细胞球悬浮生长,随着培养时间延长,细胞球数量增多,球体增大,细胞球形态趋于卵圆形,周边细胞透亮,折光性强,约7~9 d后可观察到典型的干细胞球形态(图2、3)。共收集卵巢癌组织标本20例,2例培养成功,成功率10%;腹水标本2例,均培养成功,成功率100%。
2.2 卡铂短期诱导后分离卵巢癌类干细胞球
经卡铂诱导72 h,无血清悬浮培养5 d后即可观察到典型的类干细胞球。部分类干细胞球形态更为规整,更接近圆形(图4)。
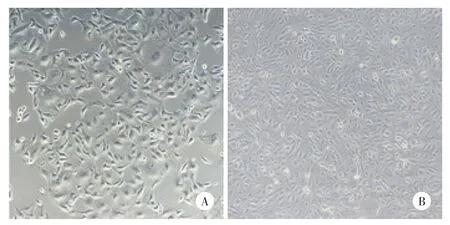
图1 贴壁培养的卵巢癌原代细胞 ×100Fig.1 Adherent culture of primary ovarian cancer cells ×100
2.3 卵巢癌类干细胞球高表达干细胞标志物
卵巢癌类干细胞球中CD133、ALDH1和ABCG2的表达明显高于卵巢癌贴壁细胞(图5~7)。
2.4 流式细胞术检测结果
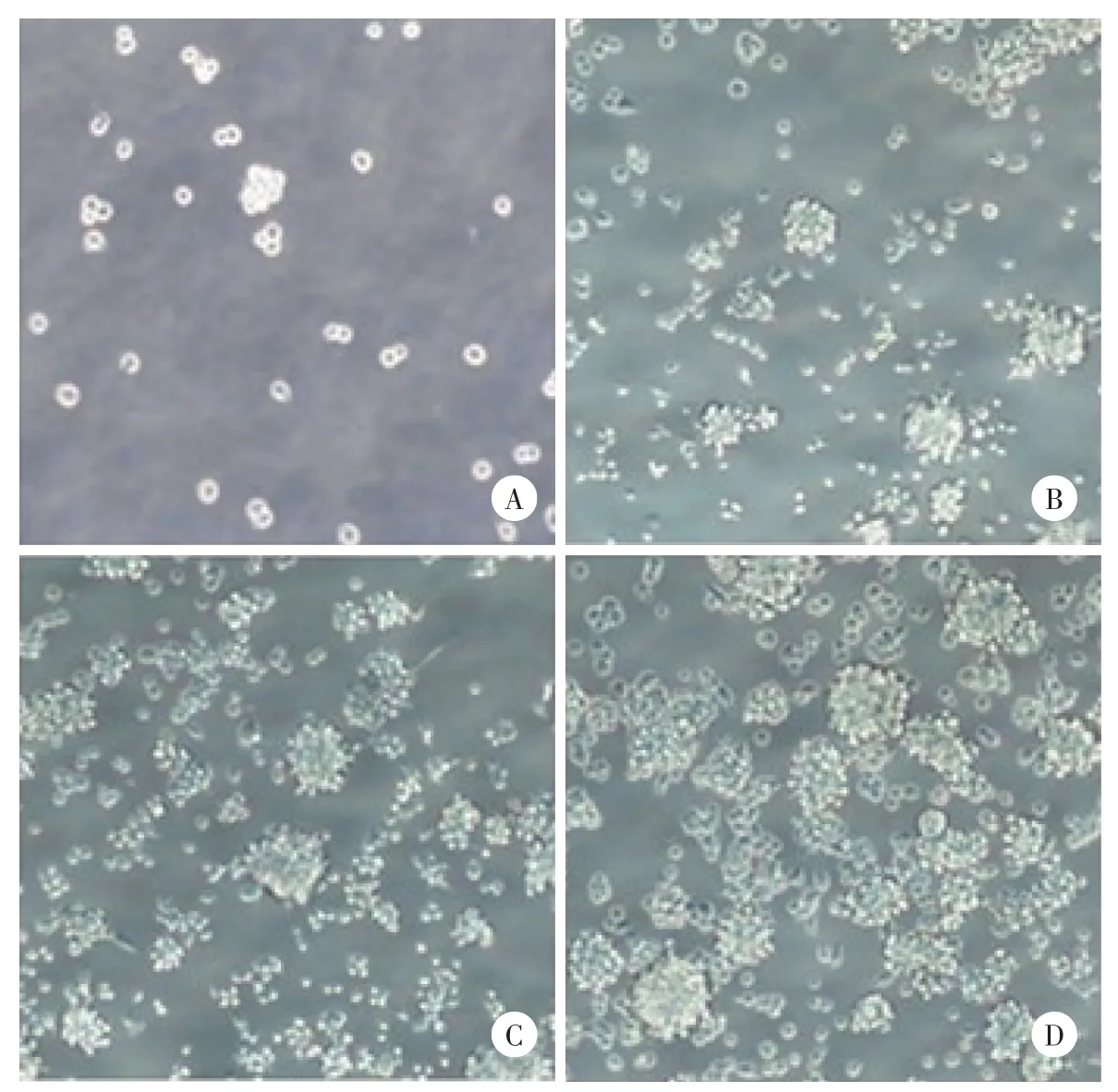
图2 无血清悬浮培养的卵巢癌类干细胞球 ×200Fig.2 Ovarian cancer stem⁃like cell spheres in serum⁃free suspension culture ×200
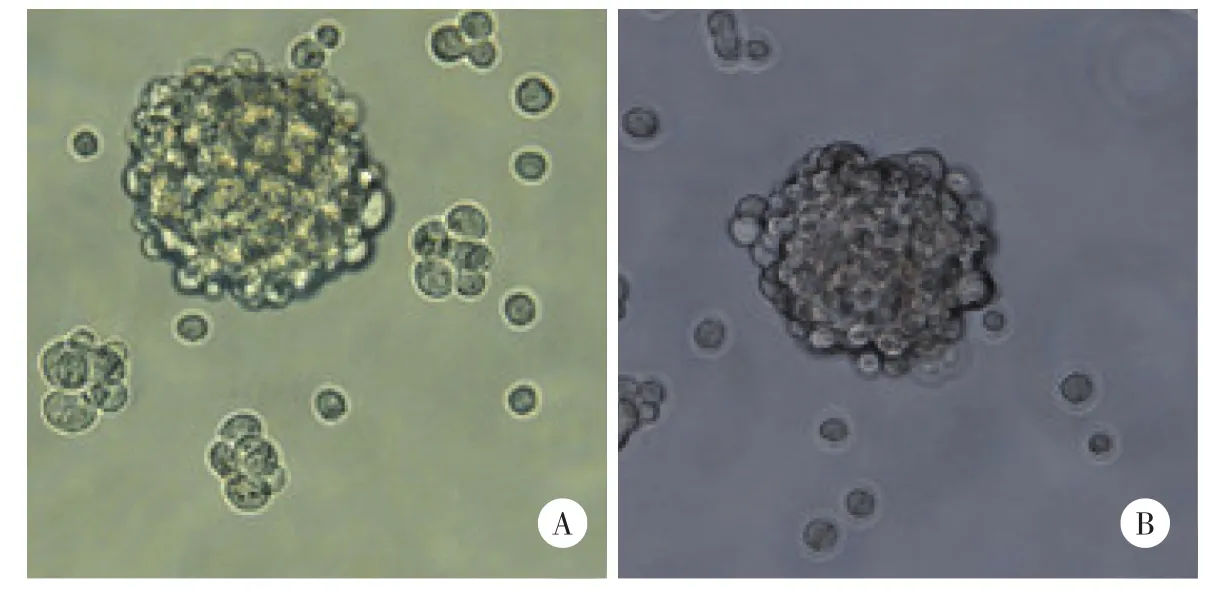
图3 典型的卵巢癌类干细胞球 ×400Fig.3 Typical ovarian cancer stem⁃like cell spheres×400
卵巢癌贴壁细胞、无卡铂诱导的卵巢癌干细胞球和经卡铂诱导的卵巢癌干细胞球中CD24阳性细胞所占比例为0.62%、8.11%和24%(图8)。无卡铂和经卡铂诱导后卵巢癌干细胞球中CD24阳性细胞比例为(7.06±3.23)%和(25.26±3.10)%,差异有统计学意义(P<0.05,图9)。
3 讨论
肿瘤干细胞具有自我更新及多向分化的潜能,是肿瘤的起始、增殖、侵袭、转移、耐药及复发的根源,消除肿瘤干细胞是治愈恶性肿瘤的关键[10]。分离并稳定培养肿瘤干细胞是目前制约肿瘤干细胞研究的瓶颈。
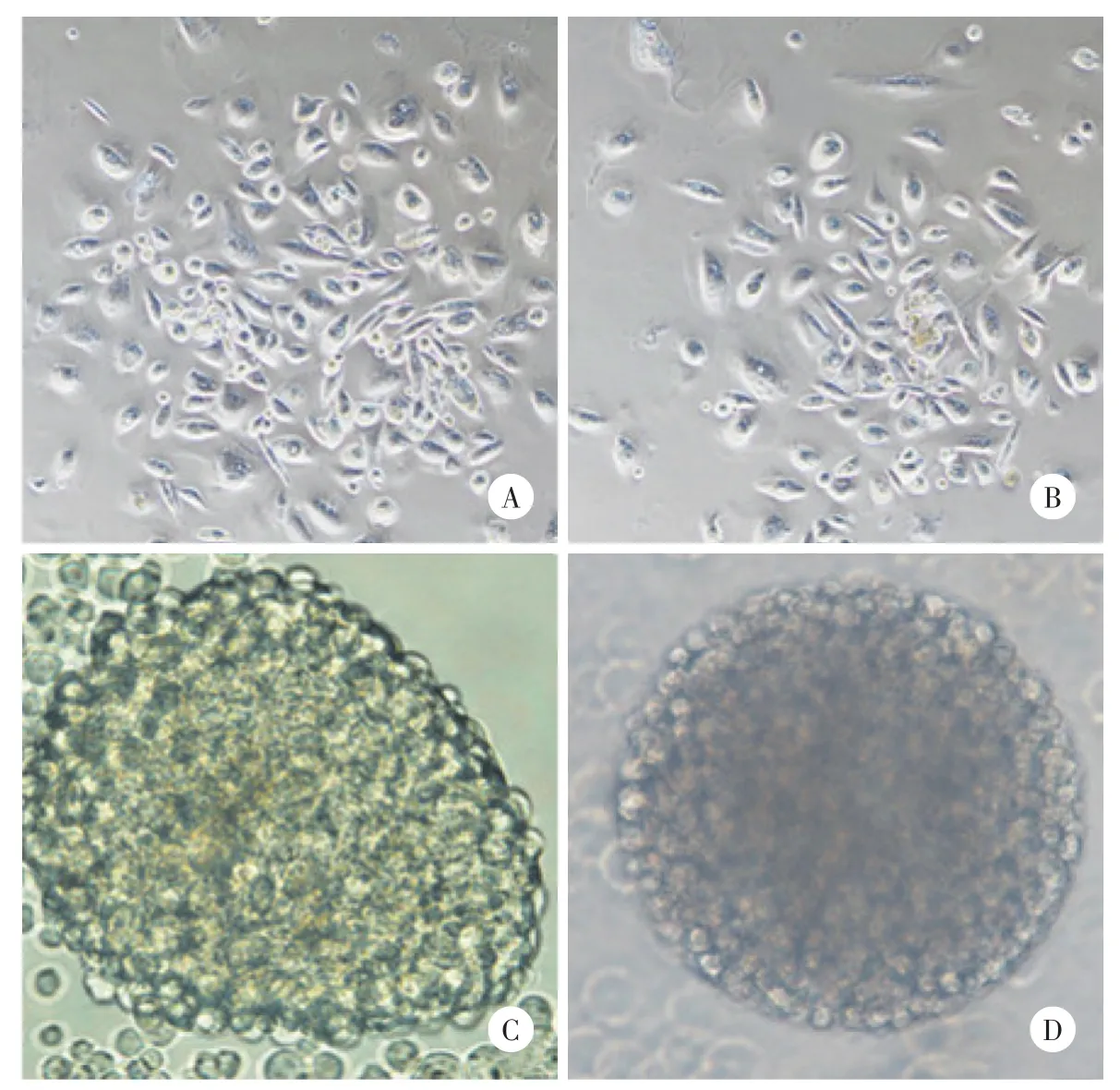
图4 无卡铂诱导及经卡铂诱导后无血清悬浮培养的卵巢癌类干细胞球比较Fig.4 Comparison of ovarian cancer stem⁃like cell spheres in serum⁃free suspension culture with or without carboplatin induction
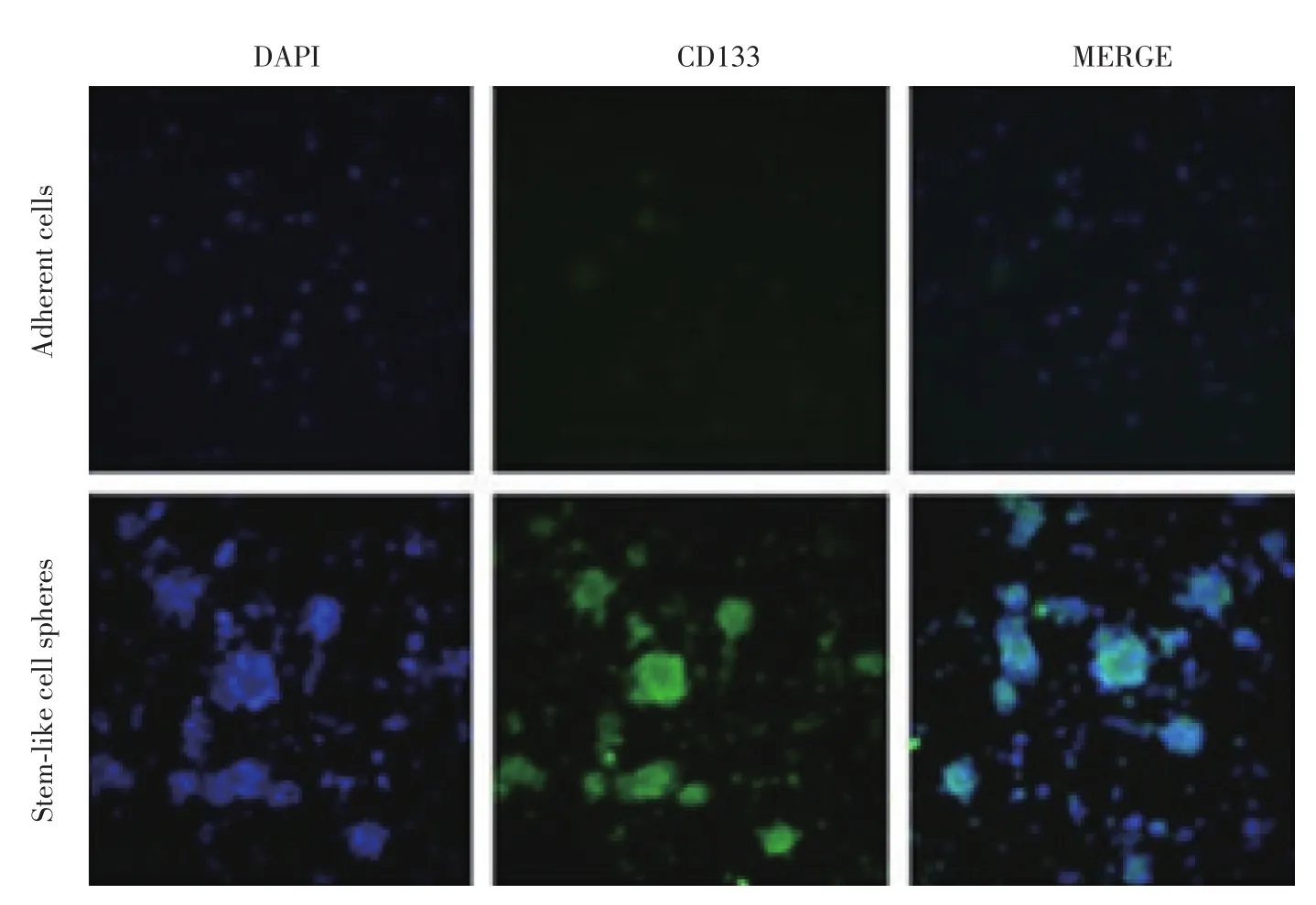
图5 细胞免疫荧光检测原代培养的卵巢癌贴壁细胞、卵巢癌类干细胞球中CD133的表达情况 ×200Fig.5 Immunofluorescence assay for expression of CD133 in human primary adherent ovarian cancer cells and ovarian cancer stem⁃like cell spheres ×200
目前分离培养肿瘤干细胞的方法主要包括利用干细胞标志物进行分选、侧群细胞分离和无血清悬浮培养等。其中,无血清悬浮培养法利用肿瘤干细胞可以悬浮生长形成细胞球的特性分离肿瘤干细胞,兼具分离和鉴定2种作用,且无血清培养基有利于保持细胞的未分化状态长期培养,因此得到广泛应用[11]。但是,通过无血清悬浮培养所得到的肿瘤干细胞球中,肿瘤干细胞所占比例较低,只有约4%~20%[12]。有文献[13]报道用顺铂短期诱导卵巢癌细胞系SKOV3,可以进一步富集纯化卵巢癌干细胞,提高类干细胞球中干细胞的比例。本研究采用卡铂诱导联合无血清悬浮培养法,由原代培养的卵巢癌细胞中成功分离卵巢癌类干细胞球。
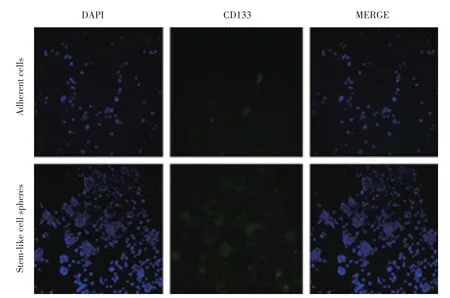
图6 细胞免疫荧光检测原代培养的卵巢癌贴壁细胞、卵巢癌类干细胞球中ALDH1的表达情况 ×200Fig.6 Immunofluorescence assay for expression of ALDH1 in human primary adherent ovarian cancer cells and ovarian cancer stem⁃like cell shpheres ×200
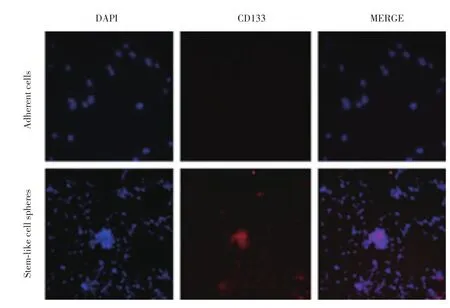
图7 细胞免疫荧光检测原代培养的卵巢癌贴壁细胞、卵巢癌类干细胞球中ABCG2的表达情况 ×200Fig.7 Immunofluorescence assay for expression of ABCG2 in human primary adherent ovarian cancer cells and ovarian cancer stem⁃like cell spheres×200
本研究共收集卵巢癌组织标本20例,其中2例成功分离得到卵巢癌类干细胞球;2例腹水标本,全部成功分离得到卵巢癌类干细胞球。提示由卵巢癌腹腔转移的腹水中更容易获得卵巢癌类干细胞球,分析其可能的原因包括:(1)腹水中的癌细胞由原发灶脱离后,具有较强的活动性和较弱的黏附性,体外培养时能够较好地适应悬浮培养的环境而存活下来;(2)卵巢癌出现腹腔转移通常标志着肿瘤的进展转移,提示肿瘤具有更明显的恶性生物学行为,腹腔转移的癌细胞也具有更强的侵袭转移能力,其中肿瘤干细胞比例可能更高,形成类干细胞球的能力也更强;(3)腹水中的卵巢癌细胞能分泌更多的促进增殖和转移的细胞因子,可能也有助于它们在悬浮状态下存活和成球[14-15]。
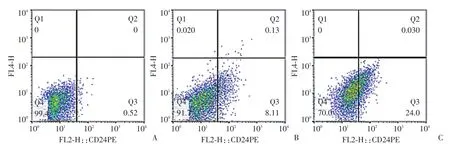
图8 流式细胞术检测卵巢癌贴壁细胞(A)、无卡铂诱导的卵巢癌干细胞球(B)和经卡铂诱导的卵巢癌干细胞球(C)中CD24的表达Fig.8 Flow cytometry for expression of CD24 in adherent ovarian cancer cells(A),carboplatin⁃free ovarian cancer stem⁃like cell spheres(B),and carboplatin⁃induced ovarian cancer stem⁃like cell spheres(C)
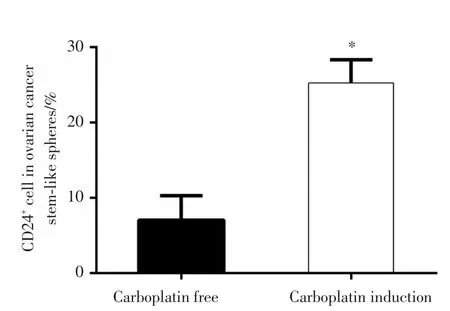
图9 流式细胞术检测无卡铂诱导及经卡铂诱导后的卵巢癌类干细胞球中CD24的表达Fig.9 Expression of CD24 in human ovarian cancer stem⁃like cell spheres without or with carboplatin induction by flow cytometry
干细胞标志物检测是鉴定肿瘤干细胞的主要方法之一。卵巢癌干细胞的标志物主要包括CD133、ABCG2、ALDH1、CD24等。本研究采用细胞免疫荧光方法检测了卵巢癌类干细胞球中CD133、ALDH1和ABCG2的表达,发现卵巢癌类干细胞球中这些标志物的表达明显高于原代培养的贴壁细胞,证明其具有干细胞的特征。采用流式细胞术检测卵巢癌类干细胞球中CD24+细胞的比例,结果发现类干细胞球中CD24+细胞的比例明显高于贴壁细胞,进一步证实了其干细胞特征。
肿瘤干细胞球中干细胞所占比例偏低一直困扰着肿瘤干细胞的后续研究,如何进一步纯化、富集肿瘤干细胞是研究者们关心的问题。有文献[16]报道顺铂诱导可以由卵巢癌细胞系中富集纯化卵巢癌干细胞,本研究尝试采用卡铂短期诱导的方法由腹水来源的卵巢癌原代培养细胞富集纯化卵巢癌干细胞,结果发现,培养5 d即可观察到较为典型的卵巢癌类干细胞球,部分球体形态趋于圆形,提示卡铂诱导可以促进卵巢癌类干细胞球的形成。流式细胞检测发现经卡铂诱导后的卵巢癌类干细胞球中CD24+细胞数量明显增加,证实卡铂诱导确实可以明显富集卵巢癌干细胞。究其原因,悬浮培养可能作为一种选择压力作用于卵巢癌细胞,使无法在悬浮状态下存活的卵巢癌细胞死亡,而卵巢癌干细胞能够耐受悬浮培养状态存活并成球;卡铂也可能作为一种选择压力作用于卵巢癌细胞,杀死普通卵巢癌细胞,而耐药的卵巢癌干细胞存活下来[16-17],从而进一步纯化和富集了卵巢癌干细胞。
本研究采用卡铂短期诱导和无血清悬浮培养的方法由原代培养的卵巢癌细胞中得到卵巢癌类干细胞球,并进行了初步鉴定,证实其具有肿瘤干细胞的特性。该模型的构建有助于深入研究卵巢癌干细胞的特性,加深对卵巢癌干细胞的认识。同时,卡铂短期诱导模拟了化疗耐药的过程(即一线化疗药物使卵巢癌患者产生耐药),该模型可用于深入研究卵巢癌化疗耐药及复发机制,也可作为检测药物疗效的理想靶细胞,用于为治疗铂类耐药的卵巢癌患者研制和筛选有效的二线化疗药物。
[1]BHATT P,VHORA I,PATIL S,et al.Role of antibodies in diagnosis and treatment of ovarian cancer:basic approach and clinical status[J].J Control Release,2016,226(1):148-167.DOI:10.1016/j. jconrel.2016.02.008.
[2]LV J,SHIM JS.Existing drugs and their application in drug discov-ery targeting cancer stem cells[J].Arch Pharm Res,2015,38(9):1617-1626.DOI:10.1007/s12272-015-0628-1.
[3]ZHANG S,BALCH C,CHAN MW,et al.Identification and characterization of ovarian cancer-initiating cells from primary human tumors[J].Cancer Res,2008,68(11):4311-4320.DOI:10.1158/ 0008-5472.CAN-08-0364.
[4]SZOTEKP P,PIERETTI-VANMARCKE R,MASIAKOS PT,et al. Ovarian cancer side population defines cells with stem cell-like characteristics and mullerian inhibiting substance responsiveness[J].Proc Natl Acad Sci USA,2006,103(30):11154-11159.DOI:10.1073/pnas.0603672103.
[5]COLE JM,JOSEPH S,SUDHAHAR CG,et al.Enrichment for chemoresistant ovarian cancer stem cells from human cell lines[J].J Vis Exp,2014(91):51891.DOI:10.3791/51891.
[6]SEIDEL S,GARVALOV BK,ACKER T.Isolation and culture of primary glioblastoma cells from human tumor specimens[J].Stem Cell Protocols,2015,1235(1235):263-275.DOI:10.1007/978-1-4939-1785-3_19.
[7]林盛,龙海霞,向橦,等.人卵巢癌组织肿瘤干细胞的分离和鉴定[J].中华肿瘤杂志,2011,33(12):896-899.DOI:10.3760/cma.j. issn.0253-3766.2011.12.004.
[8]司徒镇强,吴军正.细胞培养[M].西安:世界图书出版公司,2007:49-165.
[9]HOUSE CD,HERNANDEZ L,ANNUNZIATA CM.In vitro enrichment of ovarian cancer tumor-initiating cells[J].J Vis Exp,2015(96):52446.DOI:10.3791/52446.
[10]AHMED N,ABUBAKER K,FINDLAY J K.Ovarian cancer stem cells:molecular concepts and relevance as therapeutic targets[J]. Mol Aspect Med,2013,39:110-125.DOI:10.1016/j.mam.2013. 06.002.
[11]董慧君,鲁菲,张哲,等.无血清培养基分离肿瘤干细胞的研究进展[J].中国生物制品学杂志,2016,29(7):774-777.DOI:10.13200/j.cnki.cjb.001387.
[12]CHEN X,ZHANG J,ZHANG Z,et al.Cancer stem cells,epithelialmesenchymal transition,and drug resistance in high-grade ovarian serous carcinoma[J].Hum Pathol,2013,44(11):2373-2384. DOI:10.1016/j.humpath.2013.05.001.
[13]MA L,LAI D,LIU T,et al.Cancer stem-like cells can be isolated with drug selection in human ovarian cancer cell line SKOV3[J]. Acta Bioch Et Bioph Sin,2010,42(9):593-602.DOI:10.1093/abbs/gmq067.
[14]MATTE I,LANE D,LAPLANTE C,et al.Profiling of cytokines in human epithelial ovarian cancer ascites[J].Am J Cancer Res,2012,2(5):566-580.
[15]BJØRGE L,HAKULINEN J,VINTERMYR OK,et al.Ascitic complement system in ovarian cancer[J].Br J Cancer,2005,92(5):895-905.DOI:10.1038/sj.bjc.6602334.
[16]WIECHERT A,SAYGIN C,THIAGARAJAN PS,et al.Cisplatin induces stemness in ovarian cancer[J].Oncotarget,2016,7(21):30511-30522.DOI:10.18632/oncotarget.8852.
[17]LI HZ,YI TB,WU ZY.Suspension culture combined with anticancer regimens for screening breast cancer stem cells[J].Med Hypotheses,2007,68(5):988-990.DOI:10.1016/j.mehy.2006.09. 059.
(编辑 王又冬)
Isolation and Identification of Human Ovarian Cancer Stem⁃like Cells Induced by Short⁃term Treatment with Carboplatin
WANG Ning,NI Sha,ZHOU Xin
(Department of Obstetrics and Gynecology,Shengjing Hospital,China Medical University,Shenyang 110004,China)
ObjectiveTo isolate carboplatin-resistant human ovarian cancer stem-like cells and provide a cellular model for the development and screening of second-line drugs for carboplatin-resistant ovarian cancer.MethodsPrimary ovarian cancer cells were isolated and cultured from ovarian cancer tissues and ascites,and ovarian cancer stem-like cell spheres were isolated from serum-free suspension culture directly or after carboplatin induction.The expression of stem cell markers was evaluated by immunofluorescent assay or flow cytometry.ResultsThe ovarian cancer stem-like cell spheres were isolated successfully from both ovarian cancer tissues and ascites and expressed high levels of stem cell markers CD133,ALDH1,ABCG2,and CD24.The abundance of CD24+cells in the ovarian cancer stem cells was significantly increased upon short-term induction with carboplatin.ConclusionOvarian cancer stem-like cells can be enriched and purified by short-term induction with carboplatin. This cell model can be used in research on chemoresistant ovarian cancer in the future.
ovarian cancer;serum-free suspension culture;ovarian cancer stem-like cell sphere;carboplatin
737.31
B
0258-4646(2017)08-0713-07
10.12007/j.issn.0258-4646.2017.08.010
辽宁省教育厅重点实验室项目(LS201602);沈阳市科技创新专项资金—人口与健康科技攻关专项(F15-139-9-34)
王宁(1990-),女,硕士研究生.
周欣,E-mail:zhouxin001@medmail.com.cn
2017-05-08
网络出版时间:

