声刺激对昏迷患者苏醒影响的探讨
李则衡,孙洁,林丽莉,周梦丹,杜文娜,周逸飞
(1.徐州医科大学;2.徐州市中心医院康复科,江苏 徐州 221009)
声刺激对昏迷患者苏醒影响的探讨
李则衡1,孙洁2,林丽莉1,周梦丹1,杜文娜1,周逸飞1
(1.徐州医科大学;2.徐州市中心医院康复科,江苏 徐州 221009)
目的:应用定量脑电图(quantitative electroencephalogram,QEEG)δ+θ/α+β相对功率值、格拉斯哥昏迷评分(Glasgow coma scale,GCS)作为评价指标,来观察声刺激对脑外伤昏迷患者的促醒作用。方法:选择符合入选标准的40例颅脑外伤后昏迷患者。20例为在康复科、神经外科病房内,家属能够积极配合,有长期固定护理人员,经过正规声刺激疗法治疗的脑外伤昏迷患者(声刺激组);20例为在重症监护室内、康复科及神经外科病房内,家属配合度一般,经常更换护理人员,未经过正规声刺激治疗的脑外伤昏迷患者(对照组)。入组后跟踪观察1个月,比较两组患者GCS评分、δ+θ/α+β值有无差异。两组间除有无正规声刺激治疗外,余治疗无明显区别,且两组间在年龄、性别、外伤类型及病程等相匹配。结果:40例颅脑外伤昏迷患者中,声刺激组与对照组治疗后比较,GCS评分明显增大,有统计学差异(P<0.05)。声刺激组与对照组治疗后比较,δ+θ/α+β值明显减小,有统计学差异(P<0.05)。治疗前40例患者GCS评分为3~8分与δ+θ/α+β值呈负相关(r=-0.482,P=0.002,n=40),治疗后31例患者GCS评分为9~15分与δ+θ/α+β值呈负相关(r=-0.493,P=0.005,n=31)。结论:通过对δ+θ/α+β值及GCS评分的观察,说明声刺激法对颅脑外伤昏迷患者有明显的促醒作用。定量脑电图(δ+θ/α+β值)作为一种客观、量化的脑功能检测手段,对昏迷患者大脑功能状态的评估有重要的价值。
昏迷;促醒;脑电图;声刺激
昏迷刺激疗法是通过多种感觉触觉刺激达到改善患者病情的治疗方法。声刺激疗法就是其中之一,就是用声音对昏迷患者进行刺激使其觉醒的过程有研究发现,有效的声刺激可以缓解脑缺血的症状,维持脑灌注压,预防继发性脑损伤,帮助受损的神经修复以及轴突的再生,促进神经功能恢复[1]。由于长期的外界刺激,帮助患者上行网状激活系统及大脑皮质神经元处于兴奋状态,有利于患者觉醒[2]。另有研究发现 ,声刺激使得脑损伤昏迷患者的脑电图中大脑皮质的波幅增高,相应位置的缺血情况也得到改善[3]。并且发现发现声刺激治疗结合常规药物组在经颅多普勒下脑血管弹性和脑血流量明显优于单纯药物治疗组,推测颅脑损伤昏迷的患者在声刺激条件下更易苏醒。因此将声刺激定量化,这将是我们继续探索的内容。
在试验探讨中主要用到的是Glasgow评分量表,Glasgow评分量表通过言语、活动、反射等方面评价患者昏迷程度。但是这些临床评价指标由于受主、客观因素影响,虽然昏迷评分、临床检查对昏迷病人预后的判断有一定的参考价值,但是不能作为金指标,仍然有一定的假阳性率,所以需要一种更加准确的规范的标准来对昏迷程度及预后进行判定。就是我们的另外评估标准:脑电图。
脑电图的表现对不同的昏迷原因有一定的相似性,并且EEG对外源性刺激产生的反应性是评估预后的一个重要指标。同时脑电图还具有床边动态实时监护以及经济实惠的优势。患者病情的变化可以通过脑电活动显示,表现在脑电图上是脑电波的频率及振幅。因此我们选择脑电图对昏迷患者声刺激时进行监测,观察适宜的声刺激对昏迷患者的促醒作用。
1 材料和方法
1.1 材料
选用NATION8128型脑电图仪(上海诺诚电气有限公司),格拉斯哥昏迷量表(Glasgow Coma Scale,GCS)。
1.2 方法
1.2.1 研究对象 选取2016年7月至10月间在徐州市中心医院符合入选标准的40例脑外伤后昏迷患者。入组标准:(1)诊断符合《神经病学》人卫第七版教材的昏迷的诊断标准,并有影像学支持大脑器质性损害;(2)患者年龄>20岁且<65岁;(3)病程在半年内且病情发展稳定;(4)发病初期GCS检查评分<8分;(5)基于Young分级法,针对本文实际情况稍加修正,选择动态EEG功能分级处于III-V级之间患者;(6)符合伦理标准及相关规定自愿参加。排除标准:(1)非器质性昏迷或持续性植物状态;(2)先天性脑损伤患者、酒精、药物滥用或依赖史;(3)对声音刺激反应低;(4)影响脑电图的情况;(5)其他情况不适合参与的受试者。
1.2.2 评定方法 对符合标准的脑外伤昏迷患者,在入院后2周内完成GCS评分及定量脑电图的监测,GCS量表评分人员由同一位康复医师采用同一标准进行评定。定量脑电图的治疗前后的监测均有同一医师进行操作,在脑电图参数不变的情况下进行计算。
使用便携式脑电图仪16导单级导联记录法。脑电图描记的同时进行临床检查评定GCS 评分,及神经系统检查。
对动态脑电图(electroencephalogram,EEG)评级方法稍作变动分五级[3-4]:I 级:有节律的α波,可伴有θ波;II 级:以θ节律为主,伴少量α、β波;III 级:具有规则或不规则的δ波,可伴有少量平坦波;IV 级:平坦波为主,可有弥漫性慢波;V 级:静息电位。I 级、II 级为优,III 级、IV 级为良,V 级为差。
利用计算机分析形成脑电地形图和功率图谱等方式为临床研究提供参考依据。
对患者进行脑电图检查获取原始脑电图资料,采样后借助计算机软件行快速傅里叶转换进行功率谱分析,功率谱按频率分为6个频带:δ(1.0-4.0Hz)、θ(4.1-8.0Hz)、α1(8.1-10.0Hz)、α2(10.1-13.0Hz)、β1(13.1-17.5Hz)、β2(17.6-35.0Hz)[5]。
此方法仅具有个体化意义,也就是每个人各脑区某一频段值占总功率值的百分比是稳定的。因此用δ+θ/α+β可以更加客观地评估患者的预后情况[6]。并且使频段位于同一基准线上。
研究证明对治疗后清醒患者进行GCS评分,发现GCS评分越高,δ+θ/α+β值越小。说明δ+θ/α+β的值与患者苏醒的难易程度呈负相关 。因此将δ+θ/α+β值作为颅脑损伤意识障碍患者清醒的评判标准。[5,9]
记录患者试验前后的GCS评分,并分析其变化。
1.2.3 试验方法 选取符合标准的患者共40人,随机分为实验组(声刺激组)20例,对照组20例。(1)声刺激组:选用具有节奏感的声乐,如轻音乐或器乐或利用患者熟悉的人的声音对患者讲述患者感兴趣的事情等[16]。(2)对照组20例。(不给予声音刺激)(注:组间性别及年龄、文化程度比例差异无统计学意义,具有可比性)
1.2.4 实验方案 将在试验期内(2个月,如有病情变化可酌情变动)除给予与对照组相同的药物治疗外给予声乐组和亲属组声刺激治疗,声刺激每次约40 min(声刺激持续时间可基于患者具体脑电图觉醒波情况加以小幅调整)。其中音乐组,可进行不同类型的音乐转换刺激。亲属组,患者熟悉的人对患者讲述。实验组患者给予每天刺激三次(8点,14点,20点),并记录脑电波变化。选取对脑电图影响最大的因素,及时调整治疗方案。对照组同样进行脑电图监测。
1.2.5 脑电图监测方法 采用16导联单极采样,波形灵敏度为100 μV/cm ,走纸速度为3.0 cm/s ,时间常数为0.3 s ,低通为30 Hz ,陷波为50 Hz。在安静、温度适宜及关闭光源的环境下,减少人员走动,此时患者不进行任何治疗、操作或暂停治疗。患者取平卧位,去枕,毛巾折叠后垫于颈后部,使患者后枕部露出,便于安装电极,电极安装完毕,导联线连接,脑电仪器正常运作,采集记录脑电图。对符合入选标准的脑外伤昏迷患者入组时进行一次脑电图检查,跟踪观察一个月后再次进行脑电图检查。中途出院或是死亡者则为失访。在本实验中,在对声刺激组进行声刺激治疗时,同时进行实时脑电监测,观察不同GCS评分的昏迷患者在声刺激刺激时患者脑电图变化有无差异。
1.2.6 脑电图数据处理 剔除受外界影响的脑电波,持续六秒数据为一个单位,间隔选取5个单位,借助计算机软件行快速傅里叶转换,获得能真实反映原始脑电图的功率谱,对患者进行脑电图检查获取原始脑电图资料,采样后借助计算机软件行快速傅里叶转换进行功率谱分析,分别计算出每个频带的绝对功率值及相对功率δ+θ/α+β值,取其5次采集的平均值为所得数据。
1.3 统计学分析

2 结果
2.1 入组患者一般情况比较
患者入组时病程在2周以内,男性30例,女性10例:实验组男性15例,女性5例,年龄18~53岁,平均年龄为(39.35±10.23)岁;入组时病程为2~12d,平均为(6.55±2.82)d;左侧颅脑损伤7例,右侧颅脑损伤13例;车祸伤12例,高出坠落伤5例,打击伤3例;对照组男性15例,女性5例,年龄22~50岁,平均年龄为(40.05±10.05)岁;入组时病程为2~13d,平均为(6.70±3.08)d;左侧颅脑损伤12例,右侧颅脑损伤8例;车祸伤15例,高处坠落伤3例,打击伤2例。两组患者在性别、年龄、入组时病程等方面均匹配,统计学分析差异无统计学意义(P>0.05)。见表1。

表1 声刺激组与对照组一般资料比较±s)
2.2 治疗组前后各指标的比较
2.2.1 声刺激组与对照组治疗前后GCS评分比较
声刺激组与对照组两组治疗前GCS评分比较:P>0.05,差别无统计学意义,声刺激组与对照组治疗后GCS评分比较:P<0.05(P=0.041),差别有统计学意义(表2)。

表2 声刺激组与对照组治疗前后GCS值的比较±s)
*P<0.05,表示与对照组比较;#P<0.05,表示与治疗前比较。
2.2.2 声刺激组与对照组治疗前后定量脑电图(δ+θ/α+β值)的比较 声刺激组与对照组两组治疗前δ+θ/α+β值无明显统计学意义,声刺激组与对照组治疗后δ+θ/α+β值比较:P<0.05(P=0.038),差别有统计学意义(表3)。


分组治疗前(δ+θ/α+β值)治疗1个月时(δ+θ/α+β值)声刺激组9.01±2.626.30±2.12∗#对照组9.40±3.067.99±2.81#
*P<0.05,表示与对照组比较;#P<0.05,表示与治疗前比较。
2.3 患者GCS评分与QEEG(δ+θ/α+β值)相关性分析
2.3.1 治疗前GCS评分与QEEG(δ+θ/α+β值)相关性分析 所有符合入组标准患者40例,治疗前GCS评分在3~8分,将其与QEEG(δ+θ/α+β值)进行相关性分析:QEEG(δ+θ/α+β值)和GCS评分经检验不符合正态性,因此用Spearman相关分析,分析显示两者呈高度负相关(r=-0.482,P=0.002),其相关散点图呈明显负相关趋势(图1)。

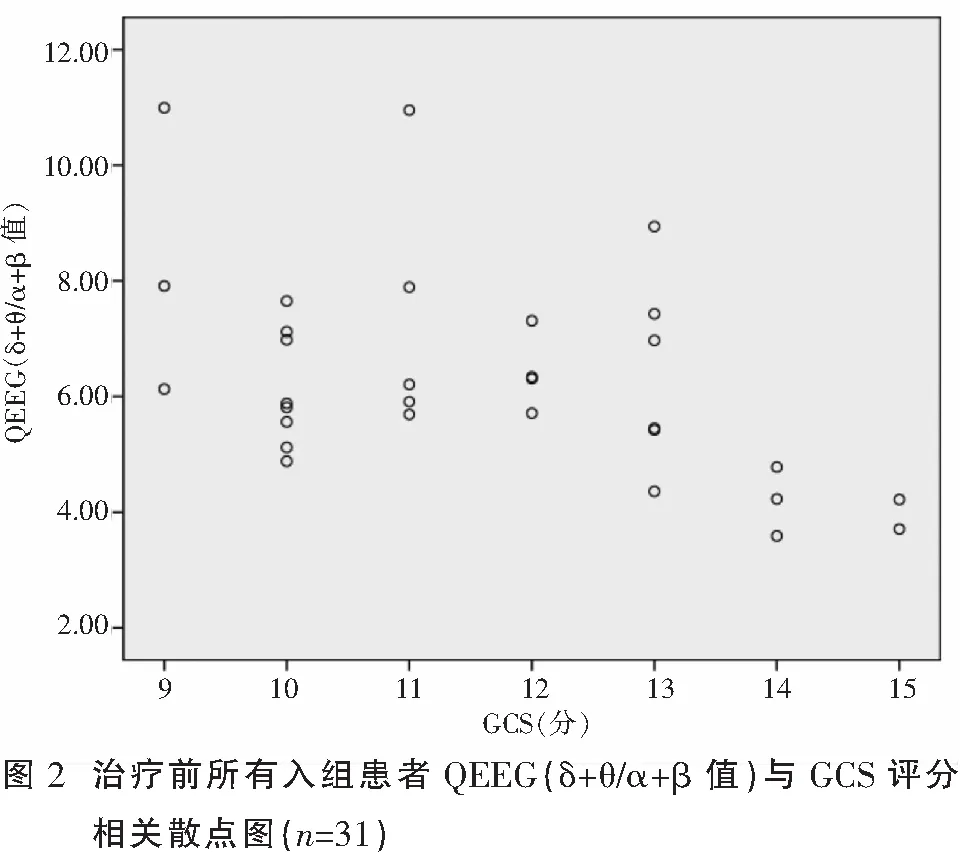
2.3.2 治疗后GCS评分与QEEG(δ+θ/α+β值)相关性分析 所有患者中治疗后GCS评分在9~15分者为31例,将其与QEEG(δ+θ/α+β值)进行相关性分析:QEEG(δ+θ/α+β值)和GCS评分经检验不符合正态性,因此用Spearman相关分析,分析显示两者呈高度负相关(r=-0.493,P=0.005),其相关散点图呈明显负相关趋势(图2)。
3 讨论
随着社会的发展,医学技术的提升,颅脑损伤的致死率显著下降,但其致残率依然居高不下[4]。患者常处于意识障碍状态,不但增加了家庭负担也对医疗资源产生巨大压力,而声刺激法促醒以其成本低,见效快,效果显著,投入少效益大为特点具有巨大的应用前景。
声刺激法近几年在昏迷促醒治疗中,越来越受到重视,也有许多学者[5-6]对声刺激法的促醒作用进行研究,证实声刺激法对昏迷患者有一定的促醒作用,可以促进昏迷患者早日恢复。声刺激可以激活大脑特定的神经基质[7]。促进人脑产生改善认知和情绪的神经底物[8]。改善神经内分泌、心血管、消化系统的功能,大脑皮层,使乙酰胆碱的释放量增多[9],使大脑皮层的兴奋性增强,从而从而改善患者认知,加速神经修复[10]。同时通过外界声刺激能够改善大脑血供,调动未受损脑细胞进行代偿,从而加速患者苏醒[11]。因此,通过早期合理的药物治疗与声刺激治疗可以促进神经细胞的修复及神经功能的恢复,可以将声刺激法贯穿于昏迷病人的治疗过程中,促进昏迷病人的恢复。
通过对本实验中40例脑外伤昏迷患者进跟踪观察,声刺激组和对照组其GCS评分均较治疗前明显增大(P<0.05),并且经过一个月的治疗后把声刺激组与对照组的GCS评分进行比较,声刺激组GCS评分为(11.30±2.66)分,对照组GCS评分为(9.45±2.86)分,两者比较有明显统计学差异(P=0.041)。说明正规的声刺激治疗对脑外伤昏迷患者有着明显的促醒作用。但是对声刺激法的治疗效果的评定,只靠常用的GCS评分变化进行评估,具有一定的主观性,因此本实验将定量脑电图作为一客观评价指标来证实声刺激法的促醒作用。
定量化脑电图(QEEG)将计算机技术与数学相结合可以做到将传统的脑电图数量化,从而做到无创评估脑功能。利用快速傅立叶转换(fast Fourier transform,FFT)等方式,将原始脑电图脑电波幅随时间的变化转化为脑电功率随频率的变化,从而直接观察α、β、θ、δ频段脑电波的分布与变化情况[12]。这种方式可以使传统脑电图量化以代替人为主观评判。总之,定量脑电图把复杂多变的大脑机能变化,通过现代化的计算机技术和信号处理技术变换成能定量反映脑机能变化的分布数据,同时做动态观察记录,用于研究生理、病理状态下大脑活动的特征和规律,因此为大脑疾病的早期诊断、治疗效果和预后评估提供客观有力的依据[13]。
脑外伤早期患者脑电图特点主要是δ、θ慢波的增多,α、β波功率减弱,且常为弥散性增多。早期产生慢波的重要原因是因为头部着力点及对冲部位在外伤数分钟后脑皮质许多锥体细胞的线粒体就发生肿胀,影响到突触后电位的释放,从而产生较多的慢波。本文选择入组的脑外伤昏迷患者时就是以慢波δ、θ为主的昏迷患者。本实验通过对40例脑外伤昏迷患者进行一个月的跟踪观察中,无论是声刺激组还是对照组其δ+θ/α+β值均较治疗前明显减小(P<0.05)。说明治疗后慢波δ、θ比例相对减少,快波α、β相对增多,这与许多学者[14,15]观点基本一致。且实验中也对GCS评分与δ+θ/α+β值进行了相关性分析,治疗前40例患者GCS评分均为3~8分与其δ+θ/α+β值进行相关性分析,呈现明显的负相关(r=-0.482,P=0.002),治疗后有31例患者GCS评分为9~15分与其δ+θ/α+β值进行相关性分析,呈现明显负相关(r=-0.493,P=0.005),可以得出随着GCS评分的升高,患者的δ+θ/α+β值存在减小趋势,说明GCS评分越高,δ+θ/α+β值越小,患者的清醒程度就越高,反之,则患者清醒程度就越低。经过一月治疗后声刺激组δ+θ/α+β值为(6.30±2.12),对照组为(7.99±2.81),两者比较有明显统计学差异(P=0.037),因此通过声刺激组与对照组之间定量脑电图δ+θ/α+β值的比较,证明了经过正规的声刺激治疗后的声刺激组较对照组的昏迷患者的整体觉醒程度增高。说明δ+θ/α+β值在评估声刺激法对脑外伤昏迷患者的促醒治疗中有一定价值。因此,通过δ+θ/α+β比值的变化,客观的证明了声刺激刺激对脑外伤昏迷患者脑电活动有明显的改善作用,为声刺激治疗昏迷患者提供有力的理论依据。
本实验对声刺激组进行声刺激治疗时,同时进行实时脑电监测观察,发现在有声刺激刺激时定量脑电图(δ+θ/α+β值)较患者平静状态下有减小趋势,即在有声刺激刺激时患者的慢波成分相对减少,快波成分相对增加,说明声刺激对昏迷患者的脑电活动有改善作用,患者的脑功能意识状态在向着清醒的方向发展。
而且也观察到随着患者GCS评分增高,在声刺激刺激时δ+θ/α+β值比患者平静状态时变化的程度也增大,经过对声刺激组患者跟踪观察,GCS评分低,δ+θ/α+β值减小的程度小,GCS评分高,δ+θ/α+β值减小的程度大。推测在实时声刺激刺激时GCS评分与定量脑电图可能也存在负相关。由于本实验样本量较小,未能对其进行统计学分析,在以后的工作中应加大样本量,对GCS进行细化分组,来观察实时声刺激刺激下定量脑电图(δ+θ/α+β值)的变化规律。
声刺激组与对照组经治疗2个月后,两组GCS评分均明显升高,说明两组患者觉醒程度均明显增大。治疗后声刺激组与对照组的GCS评分进行比较,两者比较有统计学差异。说明感统治疗对脑外伤昏迷患者有着明显的促醒作用。
在这两个评分区间内两指标的关系分别都是GCS评分越高,δ+θ/α+β值越小,慢波相对越少,脑电活动好转越明显,患者的清醒程度就越高,反之,则患者清醒程度越低。故GCS评分与δ+θ/α+β值联合应用于昏迷患者脑功能状态评定,可以使主客观互相印证、互相补充,达到早期、客观、准确地评定脑外伤昏迷患者清醒程度。
声刺激法简单方便经济,家人及陪护人员随时可进行操作,为家庭社会减轻经济负担。定量脑电图作为一个新兴指标,克服了常规脑电图的主观性,为昏迷患者大脑功能状态的评估提供了一个新领域。声刺激法和定量脑电图对脑外伤昏迷患者的促醒治疗上、大脑功能状态评估上分别有着重要的价值。使昏迷促醒疗法在临床治疗跃上一个新台阶,具有良好的经济和社会效益。
综上所述,本实验条件下,通过对定量脑电图(δ+θ/α+β值)、GCS评分观察,说明声刺激法对颅脑外伤昏迷患者有明显的促醒作用。定量脑电图(δ+θ/α+β值)作为一种客观、量化的脑功能检测手段,对昏迷患者大脑功能状态的评估有重要的价值。
[1] Ashby FG,Isen AM,Turken AU.A neuropsychological theory of positive affect and its influence on cognition.[J].Psychological Review,1999,106(3):529-550.
[2] 卜春艳,攸连秀,章永伟.重型颅脑损伤后昏迷病人的促醒及护理[J].吉林医学,2002,23(2):116.
[3] 黄维明,莫锦萍,谢春雷,等.呼唤式护理干预对颅脑损伤致昏迷患者的影响[J].现代临床护理,2007,6(4):4-6.
[4] 胡栋,毕学志,黄富,等.重型颅脑损伤昏迷患者的清醒预测模型[J].中华神经医学杂志,2013,12(3):296-300.
[5] 陈春瑞,王红娟.音乐疗法在神经外科昏迷患者催醒实施中的疗效观察[J].当代护士(专科版),2011,(2):54-55.
[6] 梁飞凤.声刺激法在神经外科昏迷病人中的疗效观察[J].中国医药导报,2008,5(13):146-147.
[7] Peretz I,Zatorre RJ.Brain organization for Sensory Integration Training processing[J].Annu Rev Psychl,2005,56:89-114.
[8] Ashby FG,Isen AM,Turken AU.A neuropsychological theory of positive affect and its influence on cognition[J].Psychol Rev,1999,106:529-550.
[9] 陶小英,孙丽英,毛樱,等.声刺激对严重认知功能障碍患者脑功能的影响[J].中国康复,2008,23(4):241-242.
[10]满力,高明全.声刺激法在护理工作中应用的现状[J].中华护理杂志,2003,38(3):205-206.
[11]黄维明,莫锦萍,谢春雷,等.呼唤式护理干预对颅脑损伤致昏迷患者的影响[J].现代临床护理,2007,6(4):4-6.
[12]Masdeu JC,Zubieta JL,Arbizu J.Neuroimaging as a marker of the onset and Progression of Alzheimer’s disease[J].J Neurol Sci,2005,236(1-2):55-64.
[13]Wallace BE,Wagner AK,Wagner EP,etal.A history and review of quantitative electroencephalography in traumatic brain injury[J].J Head Trauma Rehabil,2001,16(2):165-190.
[14]陈燕伟,王向宇,谢成金,等.定量脑电图对重型颅脑创伤长期意识障碍患者的清醒评估[J].中华神经外科杂志,2011,27(1):56-58.
[15]Leon-Carrion J,Martin-Rodriguez JF,Damas-lopez J,etal.Brain function in the minimally conscious state:aquantitative neurophysiological study[J].Clin Neurophysiol,2008,119(7):1506-1514.
[16]周盼盼.亲情呼唤在昏迷患者促醒过程中的脑电图变化研究[C].2013浙江省物理医学与康复学学术年会暨浙江省康复医学发展论坛.2013.
(学术编辑:季一飞)
本刊网址:http://www.nsmc.edu.cn
作者投稿系统:http://noth.cbpt.cnki.net
邮箱:xuebao@nsmc.edu.cn
Effects of acoustic stimulation on the recovery of coma patients
LI Ze-heng1,SUN Jie2,LIN Li-li1,ZHOU Meng-dan1,DU Wen-na1,ZHOU Yi-fei1
(1.XuzhouMedicalUniversity;2.PhysiatryDepartment,XuzhouCentralHospital,Xuzhou221009,Jiangsu,China)
Objective:Applying quantitative EEG (δ+θ/α+β value) and GCS value to evaluate the role of Sensory Integration Training therapy for traumatic brain injury coma patients.Methods:40 patients of traumatic brain injury coma meeting the inclusion criteria were chosen.20 cases in rehabilitation and neurosurgery ward,whose families were actively cooperative,and who could receive a long-term fixed nursing staff and a formal Sensory Integration Training therapy was set as Sensory Integration Training group.20 cases in the intensive care unit,the rehabilitation,and neurosurgery ward,whose family members were of the poor cooperation degree,changing nursing staff often,without a formal Sensory Integration Training therapy were set as control group.After one month following up,compared the GCS value and quantitative EEG (δ+θ/α+β value).Two groups had no significant difference in age,gender,injury types and course age except having or having not the formal Sensory Integration Training therapy.Results:After treatment the GCS value of Sensory Integration Training group were increased,and the difference with control group was significant (P<0.05).The quantitative EEG value (δ+θ/α+β value) of Sensory Integration Training group values were decreased after treatment,compared with the control group,the difference was statistically significant (P<0.05).Conclusion:The quantitative EEG (δ+θ/α+β value) and GCS score showed that the Sensory Integration Training therapy in patients with craniocerebral trauma coma has obvious effect on promoting to regain consciousness and the quantitative EEG (δ+θ/α+β value) can be used as an objective index to evaluate the brain function state.
Comatose;Wake-promoting;Electroencephalogram(EEG);Sound stimulus
10.3969/j.issn.1005-3697.2017.04.015
江苏省大学生创业创新训练计划(201610313064X);徐州市科技重点项目(KC15SM056)
2017-02-20
李则衡(1994-),男。E-mail:401697694@qq.com
孙洁,E-mail:401697694@qq.com
时间:2017-8-15 11∶26 网络出版地址:http://kns.cnki.net/kcms/detail/51.1254.R.20170815.1126.030.html
1005-3697(2017)-04-0532-05
R651.15
A

