FDA的发展历史和监管历程**
唐健元
FDA的发展历史和监管历程**
唐健元*
(国家食品药品监督管理总局药品审评中心中药民族药临床部北京100038)
拥有百年历程的美国食品及药品管理局(Food and Drug Administration,FDA)是全球食品药品监管最具权威的机构,其发展和监管历史中最重要的部分是不断面临执法挑战,但FDA始终不断完善立法,积极探索适合本国国情的监管模式。本文介绍了美国食品及药品管理局FDA的机构发展历史、监管历程、现行组织框架,以及美国药品评价与研究中心(Center for Drug Evaluation and Research,CDER)和生物制品评价与研究中心(Center for Biologics Evaluation and Research,CBER)的历史沿革、组织框架、人员结构等。重点讨论了FDA所经历的挫折教训和成功经验,并通过梳理历史事件,解读了FDA的法规体系。FDA的发展历史和监管历程对中国药品监管事业诠释“维护和促进公众健康”的使命具有重要的参考意义。
美国食品及药品管理局监管历史法律法规美国药品评价与研究中心生物制品评价与研究中心
拥有百年历程的美国食品及药品管理局(Food and Drug Administration,FDA),目前已是全球食品药品监管最具权威的机构,其监管科学并非一朝一夕之功,而是有着无数次的惨痛教训,从不断面临执法挑战,到不断反思和总结,再到不断完善立法,始终积极探索适合本国国情的监管模式。
FDA发展历程的前五十年基本上是美国食品药品最为黑暗的年代,伪劣产品、虚假广告、药品滥用和误服等乱象丛生,食品安全和药害事件频发,虽然当时的FDA不断出台新的食品、药品法律法规,但基本都是处于被动监管的局面而不停的进行“亡羊补牢”的工作。1962年的“沙利度胺事件”成为美国药品科学监管的一个分水岭,奠定了FDA在药品监管方面的权威性。本文拟从FDA机构历史、法规体系、组织框架、监管队等几个方面进行分析,以供药品监管人员思考和借鉴。
1 机构历史[1]
1849年,美国国会根据农业问题的机构调整报告,在“专利局”内增设“农业处”,该处创建的“化学实验室”是最早的监管部门的雏形。1962年,美国成立农业部,并在“化学实验室”的基础上设立“化学处”。1901年,化学处更名为“化学局”。1927年,“化学局”分“食品药品及杀虫剂管理局”(Food Drug,and Insecticide Administration,FDIA)和“化学物质与土壤局”。1930年,FDIA更名为“食品药品监督管理局”(Food and Drug Administration,FDA)。1940年,FDA调整至“联邦安全局”(Federal Security Agency,FSA)。1953年,FDA并入“健康、教育及福利部”(Department of Health,Education,and Welfare,HEW)。1979年,FDA重新划为“健康及人类服务部”(Department of Health and Humans Service,HHS)。
2 FDA监管历程
FDA走过了一个多世纪漫长艰辛的立法过程,其监管体系由超过200多部法律构成。
在FDA成立之前,美国的食品、药品方面伪劣产品、虚假广告、药品滥用和误用等乱象丛生,主要依靠部分有良知的科学家和医药学专家的自发组织来开展药品监管。1820年,11名内科医生在华盛顿召开会议并制定《美国药典》(United States Pharmacopeia,USP)。1847年,一部分科学家、医生成立“美国医学会(American Medical Association,AMA)”,以期通过社会自发的力量监管食品、药品安全。1848年,美国国会通过《药品进口法案》(Drug Importation Act)。1852年,一部分化学家“美国药学会(American Pharmacopeia Association,APhA)”,APhA化学家和AMA医生自发组织开展药品抽样检查,鉴别期伪劣。1888年,一些化学家编撰了《国家处方集》(National Formulary,NF),后来逐渐成为《美国药典》的补充。
为解决伪劣产品、虚假广告、药品滥用和误服等乱象丛生问题,打击产品掺假和伪劣药品标签,1906年,美国国会通过《食品药品纯净法案》(Pure Food and Drug Act)颁布,这是美国第一部食品药品监管法案。该法案的颁布经历了曲折的过程。当时农业部化学处的负责人——哈维·华盛顿·威利博士一直致力于推动食品安全立法,但生效甚微。直到美国著名的“扒粪专家”撰写了纪实小说——《屠场》,揭示出当时食品生产加工黑幕。由于这部作品引起了第26届美国总统西奥多·罗斯福的关注,通过阅读《屠场》意识到美国食品安全问题的严重性而做出立法的决定,法案才得以成功颁布。值得注意的是,《食品药品纯净法案》最大的亮点是“禁止贴有虚假标签和掺假的食品、药品和饮料跨州买卖”,这也赋予了FDA监管食品、药品安全的科学使命。
1911年用于癌症治疗的约翰逊安全复方(Johnson' s Mild Combination Treatment for Cancer)被查获,但法院裁决本案时却指出药品有效性的声明不受《食品药品纯净法案》约束,最终政府败诉。1912年,美国颁布《谢尔利修正案》克服了“美国政府诉讼翰逊”裁决中的问题,禁止医药产品虚假宣传欺诈消费者。1932-1933年放射性冒牌“健康”产品镭钍水致人死亡,一种名为睫毛诱惑(Lash Lure)的睫毛膏可致盲等药品安全性事件频发。1933年,FDA建议需要全面修订1906年过时的《食品药品法案》,立法工作持续了5年。1937年,美国发生了“磺酰胺酏剂事件”(Elixir of Sulfanilamide),该药品为用于儿童患者的新型磺胺口服液,为方便儿童服用,制药公司在口服液中添加了一种名为“二甘醇”的新型矫味剂。上市后不久出现107人服药后死亡,调查发现引发这一惨剧的元凶正是矫味剂“二甘醇”。“磺酰胺酏剂事件”促使国会1938年通过《食品、药品和化妆品法案》(Food,Drug and Cosmetic Act),该法案扩大了监管范围,并且要求:①药品标签必须清楚标明如何安全使用;②坚决禁止药品宣传虚假疗效;③设定有毒物质的安全限度;④可对生产企业进行检查;⑤在没受惩罚和指控之前可以申请法院禁令。由此,这部法案开创了药品监管的新体制,标志着FDA开始关注药品上市安全性问题。
1955年,PDA组建“公民咨询委员会(Citizen Advisory Committee)”,负责对FDA的执法资源进行评估,提出了具体药品以及NDA方面的建议:①加快审查;②需增加3倍人手和4倍的财政预算。
1962年,新型妊娠止呕药——沙利度胺已在40多个国家普遍使用。但是,FDA医学审评官弗朗西斯×凯尔西博士对沙利度胺安全性提出质疑,要求制药公司补充新的安全性证据。1963年,欧洲医生发现一万多名婴儿有类似的出生缺陷,而追溯用药历史发现,这些婴儿的母亲都有使用沙利度胺;美国仅有100多例严重不良反应,这就是著名的“沙利度胺事件”。由此,弗朗西斯×凯尔西博士成为美国英雄,在FDA他的事迹至今广为称赞。另外,此事件也促成了《基福弗-哈里斯药品修正案》的颁布,该法案首次以法律形式要求所有新药的上市申请都必须包含药物有效性证据,由此药品上市前准入必须做安全性、有效性评价,必须经过充分且良好对照的临床试验验证,从此创建了现代药品审评审批程序,开启了现代药品监管方法。1965年至1988年美国食品药品监管历程及立法情况见图1。
1992年,《处方药使用者付费法案》(PDUFA)开始实施PDUFA,至今每5年更新一次,现行的是第五版《处方药使用者付费法案》。该法案对药品和生物制品生产企业的NDA申请和补充申请收取审评费用。该费用用于招募更多评审员,加快审批效率。目前,FDA是全球新药审批用时最短的监管机构。1998-2013年重要的法案和政策颁布情况见图2。
综上所述,在20世纪,美国药品监管历史上有三个重要里程碑事件:一是1906年美国国会出台《食品、药品纯净法案》(<Pure Food and Drug Act>,该法案的出台标志着FDA的正式成立;二是1937年的“磺胺酏剂事件”促使国会通过《食品、药品和化妆品法案》(The Food,Drug and Cosmetic Act,FD&C Act),该法案标志着FDA开始关注药品上市安全性问题;三是1962年的“沙利度胺事件”促使国会加紧通过《食品、药品和化妆品法案》修正案,即《基福弗-哈里斯药品修正案》(Kefauver-Harris Drug Amendments),标志着FDA开始关注药品上市的有效性问题。
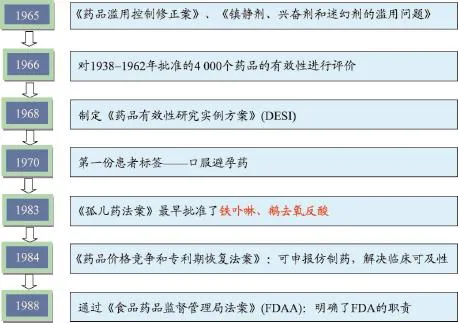
图1 1965年至1988年美国食品药品监管历程及立法情况

图2 美国在1998-2013年期间重要法案和政策颁布情况
由图3可知,FDA下设的12个司局分别是:妇女卫生司,少数族裔卫生司,首席科学家办公室,执行秘书处办公室,首席法律顾问办公室,局长顾问办公室,对外事务司,食品及兽药监管司,全球监管运营及政策司,医疗产品及烟草监管司(OMPT),运营司,政策、规划、立法及分析司。另外,FDA还设有7个中心,分别是食品安全及应用营养中心、兽药中心、国家毒理研究中心、生物制品评价及研究中心、药草产品中心、药品评价及研究中心、器械及放射卫生中心。除此之外,FDA最大的机构是监管事务处(Office of Regulatory Affairs,ORA)主要负责国内、全球的检查工作,其下设5个区域办事处,包括中央区、东北区、太平洋区、东南区、西南区。
4 美国药品评价与研究中心CDER和生物制品评价与研究中心CBER
4.1 CDER发展历史
1902年,美国“化学局”(Bureau of Chemistry)组建药品实验室,在1923年成立了“药品控制办公室”(Office of Drug Control),并于1957年改组为“医药局”(Bureau of Medicine);在1969年新组建了“药品局”(Bureau of Drugs)。1983年,药品局与“生物制品局”(Bureau of Biologies)合为“国家药品及生物制品中心”(NCDB),该中心在1987年分出CDER。
4.1.1 组织构架(图4)
4.1.2 工作人员(图5)[3-5]
4.1.3 新药批准数量(图6)[6]
4.2 CBER发展历史

图3 FDA 现行的组织框架
1902年,《卫生制品管制法案》颁布后“卫生实验室”负责各种血清产品的进行许可。1930年,“卫生实验室”改名为“国家卫生研究院”(National Institute of Health,NIH)。1948年,又改名为“国立卫生研究院”(NIH)并被授权负责监管生物制品。1972年,FDA接手生物制品的监管权。1983年,成立国家药品及生物制品中心(NCDB),在1987年改名为CBER(图7)。

图4 CDER组织构架

图5 CDER工作人员总数发展趋势
5 思考与展望
到目前为止,FDA共有16 000余名工作人员,监管范围包括食品、药品、化妆品、医疗器械、烟草、兽药监管范围,FDA与我国CFDA有很多差别,但是FDA的发展历史和监管历程对中国药品监管的发展和管理有很重要的参考价值和诸多学习借鉴之处。
保障产品安全在FDA的各种法律法规文件里面都有体现,这从FDA的三个重要里程碑事件均是由于安全性事件的发生才触动整个社会和立法机构加快了法制建设可见一斑,因此,在FDA的将理念中,安全始终摆在第一位。但是,自上世纪80年代之后,科学技术的突飞猛进促进了生物医药的快速发展,当时的FDA反成为药品可及性的瓶颈和障碍,与此同时,FDA又被曝出一些腐败丑闻,面临着工业界、学术界和社会公众的质疑。因此,美国国会陆续出台了一些法案促使FDA进行机构改革并调整监管策略。从FDA法规框架体系中,我们不难看出所有的监管法律都关注和强调产品的安全性,但随着科学技术的进步、产业的发展和监管政治的需要,后续出台的法律法规文件开始重视和关注“如何促进公众健康”。
通过对FDA发展历史和监管历程的梳理和解读,笔者深刻体会到“保护和促进公众健康”不是口号而是承诺,是对生命的尊重和敬畏。此外,法规建设对一个监管机构或执法部门来说异常重要,我们的法制建设还在路上,只有先从法律法规层面做好顶层设计,监管机构才能施展得开手脚,只有保证人才队伍的质量,才能将政策落实。希冀与各位同仁共勉,一起推动中国医药事业的发展。
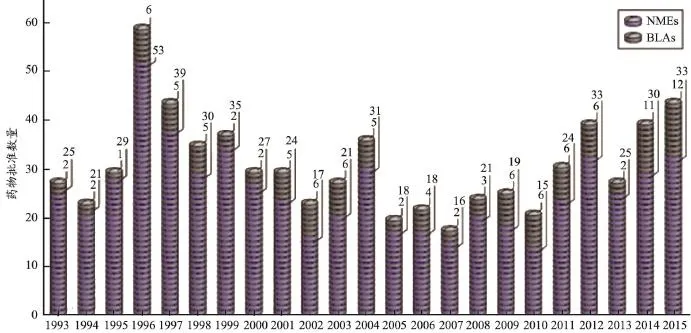
图6 CDER各年度新药审批情况

图7 CBER组织框架图
1http://www.fda.gov/AboutFDA/WhatWeDo/History/FOrgsHistory/default. htm
2http://www.fda.gov/AboutFDA/CentersOffices/OrganizationCharts/ucm393155. htmFDA.
3Food and Drug Administration FY 2014 Congressional Budget Request.
4FDA.Food and Drug AdministrationFY 2015Congressional Budget Request.
5FDA.Food and Drug AdministrationFY 2016 Congressional Budget Request.
6http://yao.dxy.cn/article/484869
Developmental and Regulatory History of Food and DrugAdministration
Tang Jianyuan
(Office of Clinical Evaluation of TCMs and Ethno-medicines,Center for Drug Evaluation,China Food and Drug Administration,Beijing 100038,China)
TThe USA Food and Drug Administration(FDA)has an over 100-year history and is the most authority drug administration.During its past records,the most important thing for FDA is facing law enforcement challenges.However, FDA insists on improving legislation and finding the perfect mode of regulation.This paper introduced the history evolution,regulatory course,present office structure of FDA,Center for Drug Evaluation and Research(CDER),and Center for Biologics Evaluation and Research(CBER).The frustration and experience for FDA is well discussed.The legislation system is interpreted through historical events.To learn the developmental and regulatory history of USA food and drug administration is important to our drug administration for practicing the mission of protecting and promoting public health.
Food and Drug Administration,regulatory,history,legislation and regulations,Center for Drug Evaluation and Research,Center for Biologics Evaluation and Research
10.11842/wst.2017.06.006
R288
A
(责任编辑:张娜娜,责任译审:王晶)
2017-04-01
修回日期:2017-05-30
*通讯作者:唐建元,国家食品药品监督管理总局药品审评中心中药民族药临床部部长。
**本文根据唐健元在国家食品药品监督管理局药品审评中心“思与行”系列讲坛上的专题报告整理。

