OSAHS患者血清KL-6、SP-A、SP-D水平变化及意义
赵丹,赵远琴,石庆柳,刘维佳,叶贤伟,张湘燕
(1贵州大学医学院·贵州省人民医院·贵州省呼吸疾病研究所,贵阳550000;2贵州医科大学)
OSAHS患者血清KL-6、SP-A、SP-D水平变化及意义
赵丹1,赵远琴2,石庆柳2,刘维佳1,叶贤伟1,张湘燕1
(1贵州大学医学院·贵州省人民医院·贵州省呼吸疾病研究所,贵阳550000;2贵州医科大学)
目的 探讨阻塞性睡眠呼吸暂停低通气综合征(OSAHS)患者血清Ⅱ型肺泡细胞表面抗原6(KL-6)、肺泡表面活性蛋白A(SP-A)、肺泡表面活性蛋白D(SP-D)水平的变化及意义。方法 根据多导睡眠监测的睡眠呼吸暂停低通气指数(AHI)将67例受试者随机分为轻、中、重度OSAHS组,并设立正常对照组。采用ELISA法检测各组血清KL-6、SP-A和SP-D水平,并进行比较;分析上述指标与AHI、最长呼吸暂停低通气时间(LA/HT)、最低血氧饱和度(LSaO2)、血氧饱和度小于90%的时间(T<90%)之间的相关性。结果 与正常对照组比较,轻、中、重度OSAHS组AHI、LA/HT均升高,血清KL-6、SP-A水平升高(P均<0.05);中、重度OSAHS组血清SP-D水平升高(P均<0.05);重度OSAHS组夜间LSaO2降低,T<90%延长(P均<0.05)。与轻、中度OSAHS组比较,重度OSAHS组AHI、LA/HT、T<90%均升高,LSaO2降低,血清SP-A、SP-D水平升高(P均<0.05)。患者血清SP-A、SP-D水平与AHI、LA/HT呈正相关,SP-D水平与T<90%呈正相关(P均<0.05)。结论 OSAHS患者血清KL-6、SP-A、SP-D水平升高,血清SP-A、SP-D水平与OSAHS病情严重程度有关。
阻塞性睡眠呼吸暂停低通气综合征;Ⅱ型肺泡细胞表面抗原6;肺泡表面活性蛋白A;肺泡表面活性蛋白D
阻塞性睡眠呼吸暂停低通气综合征(OSAHS)是一种临床常见病,由于睡眠过程中反复发生的间歇低氧,可累及机体多个系统损害。越来越多的研究表明OSAHS患者存在亚临床肺损伤[1]。间歇性低氧大鼠模型肺泡壁间隔增宽,间质水肿、充血,少量炎性细胞浸润,部分肺泡结构破坏、融合,提示间歇性低氧可引起肺组织损伤[2]。Ⅱ型肺泡细胞表面抗原6(KL-6)、肺泡表面活性蛋白A(SP-A)、肺泡表面活性蛋白D(SP-D)主要由肺泡Ⅱ型上皮细胞分泌,在肺间质纤维化[3]、肺泡蛋白沉积症[4]、肺部慢性感染[5]、机化性肺炎[6]等疾病中表达均升高,能有效反映肺损伤程度[7]。血清KL-6、SP-A、SP-D水平在OSAHS患者中的水平变化及其与病情严重程度相关性的研究较少,本研究对此进行了相关探讨,为临床预防和治疗OSAHS继发性肺部疾病提供依据。
1 资料与方法
1.1 临床资料 2016年8~12月贵州省人民医院门诊及住院就诊的OSAHS患者67例,均符合阻塞性睡眠呼吸暂停低通气综合征诊治指南—2011年修订版[8]中的标准。患者男41例、女26例,年龄16~76(50.95±12.22)岁,体质量指数(26.97±3.71)kg/m2,颈围(39.57±3.53)cm,胸围(98.47±8.48)cm,腰围(98.31±10.47)cm,日间爱波沃斯嗜睡评分(ESS)(7.47±3.99)分。按多导睡眠监测(PSG)的睡眠呼吸暂停低通气指数(AHI)分为轻度OSAHS组(AHI 5~<15次/h)20例、中度OSAHS组(AHI 15~<30次/h)17例、重度OSAHS组(AHI≥30次/h)30例。并将14例行PSG的健康人群作为正常对照组(AHI <5次/h),男8例、女6例,年龄20~72(47.98±13.14)岁,体质量指数(23.75±3.24)kg/m2,颈围(33.08±3.30)cm,胸围(94.15±8.22)cm,腰围(88.81±11.34)cm,ESS(7.86±3.46)分。排除其他疾病,如慢性阻塞性肺疾病、哮喘、肺间质纤维化、恶性肿瘤、结缔组织病、结核病、严重心力衰竭、代谢性疾病及肝、肾功能不全者,近期采用手术、激素、营养支持治疗者。各组年龄、性别有可比性。
1.2 PSG 在正式进行PSG前,运用ESS评估患者白天嗜睡程度,该评估在安静环境里由受试者独立完成,并测量颈围、胸围、腰围,计算体质量。 PSG:采取美国飞利浦Alice 5 多导睡眠监测系统,监测脑电图、眼电图、下颌肌电图、心电图、口鼻气流、胸部呼吸运动、腹部呼吸运动、血氧饱和度、体位、鼾声、胫前肌电图等。监测时间自晚9点至次日晨6点共9 h。
1.3 血清KL-6、SP-A、SP-D水平的检测 采用ELISA法。所有研究对象在行PSG后的次日晨6时,空腹抽取外周静脉血4 mL,注入非抗凝管中,室温静置30 min后,4 ℃、3 000 r/min离心10 min,留取血清,用于检测KL-6、SP-A、SP-D水平。KL-6、SP-A、SP-D试剂盒均由美国 R&D公司提供。
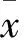
2 结果
2.1 各组PSG指标比较 与正常对照组比较,轻、中、重度OSAHS组AHI、最长呼吸暂停/低通气时间(LA/HT)均升高,重度OSAHS组夜间最低血氧饱和度(LSaO2)降低,血氧饱和度小于90%的时间(T<90%)延长(P均<0.05)。与轻度OSAHS组比较,中度OSAHS组AHI升高,重度OSAHS组AHI、LA/HT、T<90%均升高,LSaO2降低(P均<0.05)。与中度OSAHS组比较,重度OSAHS组AHI、LA/HT、T<90%均升高,LSaO2降低(P均<0.05)。详见表1。
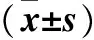
表1 各组PSG指标比较
注:与正常对照组比较,aP<0.05;与轻度OSAHS组比较,bP<0.05;与中度OSAHS组比较,cP<0.05。
2.2 各组血清KL-6、SP-A、SP-D水平比较 详见表2。
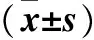
表2 各组血清KL-6、SP-A、SP-D水平比较
注:与正常对照组比较,aP<0.05;与轻度OSAHS组比较,bP<0.05;与中度OSAHS组比较,cP<0.05。
2.3 各组血清KL-6、SP-A、SP-D水平与PSG指标之间的关系 患者血清SP-A、SP-D水平与AHI呈正相关(rs分别为0.339、0.278,P均<0.05),与LA/HT呈正相关(rs分别为0.209、0.147,P分别为0.001、0.041),SP-D水平与T<90%呈正相关(rs=0.217,P<0.05)。KL-6与各指标均无相关性(P均>0.05)。
3 讨论
OSAHS是睡眠时反复发生的上呼吸道塌陷阻塞,导致慢性间断缺氧及睡眠片段化,患者常表现为打鼾、自觉窒息而觉醒、白天睡眠增多、注意力难以集中等。慢性间断缺氧致氧化应激和炎症反应增强,损伤肺泡屏障致肺泡部位内皮细胞损伤、上皮细胞渗透性增高,最终导致肺部损害。人的肺泡上皮主要由肺泡Ⅰ型及Ⅱ型上皮细胞构成。肺泡Ⅱ型上皮细胞较多,被认为是合成和分泌肺泡表面活性物质(PS)及其相关蛋白的主要细胞,同时具有增殖分化、肺水转运、参与固有免疫等多种功能,对维持肺泡结构和功能及局部环境稳态具有重要作用[8,9]。
KL-6是一种高分子黏液素样蛋白,主要在Ⅱ型肺泡上皮细胞顶端及支气管上皮细胞表达[10]。在生理情况下,外周血循环中KL-6水平很低。本研究发现,OSAHS患者血清KL-6水平高于正常对照组。其机制可能是OSAHS患者夜间间断缺氧及再氧合损伤肺泡屏障致肺泡部位内皮细胞损伤,使KL-6分泌增多,同时肺泡上皮及内皮功能失调,引起局部血管内皮通透性升高,导致KL-6渗透入血增多,使外周血循环中KL-6水平升高[11]。因此,KL-6可作为反映OSAHS患者肺泡上皮细胞受损的指标。在氧化损伤的肺组织中KL-6表达升高,其对肺泡具有保护作用。
PS是复杂的脂类蛋白质混合物,其中蛋白质约10%。蛋白质主要为肺泡表面活性物质相关蛋白(SP),分布于支气管表面和肺泡气液界面的单分子层, 能起到降低肺泡表面张力、维持肺内稳态、参与局部防御、调节肺部免疫和炎性反应的作用,具有肺特异性,可用来评价肺气血屏障的完整性[12]。SP-A和SP-D是水平较丰富的PS,主要由肺泡Ⅱ型上皮细胞及下呼吸道的Clara细胞分泌,在其他的组织及腺体上皮细胞也少量分泌[13],属凝集素家族。SP-A和SP-D在肺部起天然免疫防御作用,通过调理吞噬结合过敏原、与多种免疫分子相互作用来调节急慢性炎症反应。健康人因肺泡-毛细血管屏障完好无损,可以阻止SP-A和SP-D进入血液循环,血清中只能检测到少量SP-A和SP-D。本研究发现,OSAHS患者血清SP-A、SP-D水平高于正常对照组。机制可能为慢性间歇性低氧,导致氧化应激产生大量致炎因子,包括TNF-α、IL-1、IL-6、IL-8等,这些炎症介质刺激Ⅱ型肺泡上皮细胞分裂增殖,SP-A、SP-D合成增多,其合成速率大于消耗速率,使肺组织SP-A、SP-D水平维持在高水平,以增强肺局部免疫能力[14];同时某些致炎因子又可直接损伤血管内皮,使血管通透性升高,从而使肺组织SP-A和SP-D渗出到血液中,血清SP-A、SP-D水平增加。
患者血清SP-A、SP-D水平与AHI、LA/HT有明显的相关性,呼吸暂停次数越多、呼吸暂停时间越长、血氧饱和度越低,血清SP-A、SP-D水平越高,可能与肺损伤时支气管肺泡中的SP分泌增加,以减轻气道壁萎陷及防止液桥形成等来降低气道阻力和维持小气道稳定有关。SP-A、SP-D在肺组织的表达远高于其他组织,并且其水平和肺损伤程度密切相关,肺部损伤越重血清中SP-A、SP-D水平就越高,检测患者血循环中SP-A、SP-D水平可以判断肺损伤程度,预测疾病转归情况[15]。本研究中OSAHS患者病情严重程度与KL-6无相关性,可能与样本量小有关,期待大样本多中心研究加以证实。
综上,OSAHS患者血清KL-6、SP-A、 SP-D水平升高,SP-A、 SP-D水平与患者病情严重程度相关,同时KL-6、SP-A、SP-D可能参与OSAHS所致肺损伤过程,此为临床预防和治疗OSAHS继发性肺部疾病提供了依据。
[1] Aihara K, Oga T, Chihara Y, et al. Comparison of biomarkers of subelinical lung injury in obstructive sleep apnea[J]. Respir Med,2011,105(6):939-945.
[2] 张嘉宾,张盼盼,寇育乐,等.慢性间歇低氧大鼠肺泡上皮细胞CCAAT/增强子结合蛋白同源蛋白(CHOP)表达增强[J].细胞与分子免疫学杂志,2016,32(1):79-83.
[3] Doishita S, Inokuma S, Asashima H, et al. Serum KL-6 level as an indicator of active or inactive interstitial pneumonitis associated with connective tissue diseases[J]. Intern Med, 2011,50(23):2889-2892.
[4] Francesco B, Xiaoping L, Shinichiro O, et al. MUC1 gene olymorphisms are associated with serum KL-6 levels and pulmonary dysfunction in pulmonary alveolar proteinosis[J].Orphanet J Rare Dis, 2016,11:48.
[5] Ochi F, Fukuda M, Ohmori H, et al. KL-6 as a biomarker of respriatory complications in severely disabled children[J]. Pediatr Int, 2015,57(3):439-442.
[6] Yamaguchi K, Tsushima K, Kurita N, et al. Clinical characteristics classified by the serum KL-6 level in patients with organizing pneumonia[J]. Sarcoidosis Vasc Diffuse Lung Dis, 2013,30(1):43-51.
[7] Ishikawa N, Hattori N, Yokoyama A, et al. Utility of KL-6/MUC1 in the clinical management of interstitial lung disease[J]. Respir Investig, 2012,50(1):3-13.
[8] 中华医学会呼吸病学分会睡眠呼吸障碍学组.阻塞性睡眠呼吸暂停低通气综合征诊治指南(2011年修订版)[J].中华结核和呼吸杂志,2012,35(1):9.
[9] 杨青,王桂芳.肺泡Ⅱ型上皮细胞功能的研究进展[J].复旦学报(医学版),2012,39(6):658-662.
[10] Stahel RA, Gilks WR, Lehmann HP, et al. Third international workshop on lung tumor and differentiation antigens: overview of the results of the central data analysis[J]. Int J Cancer Suppl, 1994,8(6):26.
[11] Lederer DJ, Jelic S, Basner RC, et al. Circulating KL-6, a biomarker of lung injury, in obstructive sleep apnoea[J]. Eur Respir, 2009,33(4):793-796.
[12] Guilot L, Balloy V, McCormack FX, et al. Cutting edge: the immunostimulatory activity of the lung surfactant protein——a involves Toll-like receptor 4 [J]. J Immunol, 2002,168(12):5989-5992.
[13] Nishikiori H, Chiba H, Ariki S, et al. Distinct compartmentalization of SP-A and SP-D in the vasculature and lungs of patients with idiopathic pulmonary fibrosis[J]. BMC Pulm Med, 2014,14(12):196.
[14] 舒林华,魏克伦,尚云晓,等.急性肺损伤幼鼠肺泡Ⅱ 型上皮细胞和SP-A 变化相关性的研究[J].中国当代儿科杂志,2008,10(4):504-508.
[15] 宋庆珍,高惠英,罗静,等.类风湿性关节炎合并间质性肺疾病患者血清表面活性蛋白A和D水平及临床意义[J].中华风湿病学杂志,2012,7(16):463-467.
贵州省科技合作计划资助项目(黔科合LH字[2015]7127号);贵州省人民医院青年基金资助项目(GZSYQN[2016]16号);贵州省科技支撑计划社会发展攻关项目(黔科合SY字[2009]3052)。
赵丹(E-mail:zhaodan800@foxmail.com)
10.3969/j.issn.1002-266X.2017.29.017
R473.5
B
1002-266X(2017)29-0052-03
2017-01-07)

