IL-1、ICAM-1在超声联合造影剂致大鼠脑损伤组织中的变化及其影响因素
徐秀梅,王蓓,翟虹,王彪,赵献萍
(新疆医科大学附属中医医院,乌鲁木齐830000 )
IL-1、ICAM-1在超声联合造影剂致大鼠脑损伤组织中的变化及其影响因素
徐秀梅,王蓓,翟虹,王彪,赵献萍
(新疆医科大学附属中医医院,乌鲁木齐830000 )
目的 探讨超声联合造影剂致大鼠脑损伤组织中IL-1、ICAM-1水平的变化及其与超声照射剂量的关系。方法 SD大鼠25只,随机分为对照组5只,实验组20只,实验组根据超声机械指数和照射时间随机分为4个亚组:MI1.5照射5 min组(A1组)、MI1.5照射10 min组(A2组)、MI1.9照射5 min组(B1组)、MI1.9照射10 min组(B2组),各5只。对照组注射造影剂Sonovue;实验组在对照组基础上使用超声照射大鼠脑部颞窗,伊文思蓝作为追踪剂,使用光镜观察各组脑组织形态学变化,免疫组化法检测IL-1、细胞间黏附分子1(ICAM-1)在脑组织中的表达。结果 实验组肉眼观察可见蓝色染色,光镜下可见细胞水肿、红细胞渗出、个别细胞坏死。实验组脑损伤组织IL-1、ICAM-1阳性细胞数高于对照组(P均<0.05),实验组间比较,B1、B2组较A1、A2组损伤脑组织IL-1、ICAM-1阳性细胞数增多(P均<0.05)。结论 超声联合造影剂致大鼠脑损伤组织中IL-1、ICAM-1表达升高,其水平与超声照射剂量有关。
脑损伤;超声;造影剂;血脑屏障;白细胞介素1;细胞间黏附分子1;大鼠
超声联合造影剂能够成功开放血脑屏障[1]。文献和本研究前期实验证明,超声联合造影剂在开放血脑屏障时可引起一定程度的脑损伤[2],但这种脑组织损伤的病理学基础不明。文献研究显示,脑组织创伤后,炎症反应是脑损伤病理生理过程中的重要环节。脑损伤后炎性细胞成分的积聚,均会诱发炎症前细胞因子、化学因子以及内皮细胞、白细胞黏附因子的表达上调。2014年1月~2016年3月,本研究通过高强度超声联合造影剂开放大鼠血脑屏障的同时,观察IL-1、细胞间黏附分子1(ICAM-1)在损伤脑组织中的表达变化,并探讨其影响因素,为将来超声联合微泡开放血脑屏障预防脑组织损伤提供新的思路。
1 材料与方法
1.1 动物、试剂及仪器 健康SD大鼠25只(新疆医科大学动物实验中心提供),雌雄不限,体质量(200±50)g。伊文思蓝溶液(百灵威科技有限公司生产);Sonovue造影剂(注射用六氟化硫微泡,BRACCO 公司生产);IL-1试剂盒、ICAM-1试剂盒(武汉博士德公司);彩色多普勒超声诊断仪(使用美国西门子医疗设备公司的Sequoia-512型),S15-8探头,频率12 MHz,MI设为1.9,采用连续成像方式,成像深度4 cm,TGC除进场完全抑制外,中远场居中,聚焦于远场。
1.2 分组及处理 将大鼠随机分为对照组5只,实验组20只,实验组根据超声机械指数和照射时间随机分为4个亚组:MI1.5照射5 min组(A1组)、MI1.5照射10 min组(A2组)、MI1.9照射5 min组(B1组)、MI 1.9照射10 min组(B2组),每小组5只。大鼠以3%的戊巴比妥钠30 mg/kg尾静脉注射进行麻醉,动物麻醉后左侧卧位固定于实验台上,剪除右眼与右耳连线至颅顶的体毛作为超声照射声窗。对照组注射造影剂0.2 mL,并注射生理盐水1 mL,不用超声照射。实验组分别根据超声机械指数和照射时间注射造影剂0.2 mL,并注射生理盐水1 mL,使用超声波照射兔脑部颞窗。各组均随后加0.5%的伊文思蓝溶液(3 mL/kg)。实验后颈动脉插管灌注,断头取脑取材。所取脑组织分别用4%的多聚甲醛固定,进行常规HE染色切片、免疫组化检查。
1.3 观察指标 血脑屏障开放情况:肉眼观察脑组织伊文思蓝染色情况(伊文思蓝在活体动物中可以与循环蛋白结合而形成伊文思蓝蛋白复合物而着色,但是完整的内皮可以阻止这种结合的发生,因此可以用是否染色来判断血脑屏障开放情况[3])。脑组织损伤情况:取脑组织冠状切片,常规石蜡包埋,HE染色,光镜下观察脑组织有无组织出血、坏死等表现。
1.4 脑损伤组织IL-1、ICAM-1蛋白的表达 采用免疫组化法。取脑损伤组织常规石蜡包埋,石蜡切片脱蜡至水。3% H2O2室温孵育 5~10 min,以消除内源性过氧化物酶的活性。蒸馏水冲洗,PBS浸泡 5 min×2次。5%~10% 正常山羊血清(PBS稀释)封闭,室温孵育10 min,倾去血清,滴加IL-1、ICAM-1一抗工作液,37 ℃ 孵育1~2 h或 4 ℃过夜。PBS冲洗,5 min×3次。滴加适量生物素标记二抗工作液,37 ℃孵育10~30 min。PBS冲洗,5 min×3次。滴加适量的辣根酶或碱性磷酸酶标记的链霉卵白素工作液,37 ℃ 孵育10~30 min。PBS冲洗,5 min ×3次。显色剂显色3~15 min(DAB或NBT/BCIP)。自来水充分冲洗,复染,脱水,透明,封片。免疫组化结果以染色为棕黄色为阳性表达,根据阳性细胞的分布情况,每张切片拍摄5个阳性视野,每例标本的切片随机选取5个400倍视野,计算阳性细胞数。
2 结果
2.1 血脑屏障开放情况 对照组肉眼观未见蓝色染色,实验各组肉眼观察可见蓝色染色 。
2.2 脑组织形态学变化 对照组光镜下未见脑组织水肿和形态学变化。实验组肉眼观察可见蓝色染色,光镜下可见细胞水肿,红细胞渗出,个别细胞坏死。
2.3 各组脑损伤组织IL-1、ICAM-1阳性细胞数比较 光镜下见IL-1、ICAM-1的阳性表达产物呈棕色,对照组IL-1、ICAM-1不表达。实验组IL-1、ICAM-1阳性细胞数增多,与对照组比较,差异有统计学意义(P均<0.05);实验组间比较,B1、B2组较A1、A2组IL-1、ICAM-1阳性细胞数增加(P均<0.05),A1、A2组及B1、B2组之间比较,P均>0.05。见表1。
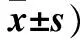
表1 各组脑损伤组织ICAM-1、IL-1阳性细胞数比较(个/400倍视野,
注:与对照组比较,*P<0.05,与B1、B2组比较,★P<0.05。
3 讨论
本课题组前期研究表明,超声联合造影剂能够有效开放血脑屏障,但可造成一定程度的脑组织损伤。本研究结果显示,照射区大鼠脑组织出现水肿,红细胞渗出,并有少量细胞出现坏死。超声联合造影剂开放血脑屏障的机制,大多数学者认为是超声波与造影剂之间相互作用的结果,其中主要生物学效应是空化效应、热效应及机械效应[4]。这几种效应均可引起组织内摩擦,使蛋白质变性、细胞和组织变形,破坏靶区的细胞及其支持结构,改变细胞功能,在形态学上主要表现为血管壁损伤、红细胞漏出、脑组织水肿等特征[5]。
脑组织损伤形态学的改变均与炎症反应有密切关系。以往大量文献研究显示,脑组织创伤后,炎症反应是脑损伤病理生理过程中的重要组成环节。脑损伤后炎性细胞成分的积聚,均会诱发炎症前细胞因子、化学因子以及内皮细胞、白细胞黏附因子的表达上调[6~8]。本研究结果显示,超声联合造影剂开放血脑屏障时,与对照组比较,实验组脑损伤组织中IL-1、ICAM-1表达量增加,说明IL-1、ICAM-1参与了脑组织损伤。
IL-1是体内最重要的促炎细胞因子[9]。在炎症反应和免疫反应中发挥着重要调节作用。实验证明,脑损伤可导致IL-1合成增加。在微血管受到损伤时,参与炎症反应的黏附分子及其信号转导通路在炎症反应和炎症蔓延中发挥着重要作用[10]。ICAM-1是血细胞和血管内皮细胞膜受损后释放的一系列糖蛋白分子,在炎性反应、免疫应答、凝血与血小板形成以及维持正常内皮细胞结构方面有重要作用,其在创伤性脑损伤后的病理生理过程中也起着重要作用。脑损伤后ICAM-1表达,在促进炎性细胞黏附并穿越血脑屏障时,将可能对血脑屏障细胞的形态结构改变起调节甚至破坏作用,从而引起血脑屏障通透性增加,导致脑水肿形成[11,12]。
本研究结果显示,超声联合造影剂开放血脑屏障时,随着超声强度的增加,IL-1、ICAM-1阳性表达量增加,而随着照射时间的增加,IL-1、ICAM-1阳性表达量增加不明显,说明随着超声强度的加大,脑组织损伤程度加大,炎症程度加重,超声强度是影响脑组织损伤的一个重要因素,而超声照射时间的长短对脑组织损伤程度影响不大,分析其原因可能是超声造影剂的代谢时间所致,一般情况下,超声造影剂的有效排出机体时间大约为5 min,在机体注射造影剂后,造影剂的浓度明显下降,超声照射对脑组织的影响明显降低[13]。
综上所述,超声联合造影剂开放大鼠血脑屏障能够造成脑组织损伤,且脑组织损伤与炎症因子表达密切相关,证实了高频超声联合造影剂开放动物血脑屏障造成脑组织损伤的病理学基础可能是炎症反应。为将来临床应用超声波联合微泡造影剂开放人血脑屏障进行药物的传递和治疗及对脑组织损伤的预防提供一定的理论基础。
[1] 费威,程远,王志刚,等.两种开放血脑屏障方法的比较[J].中国超声医学杂志,2012,28(5):392-394.
[2] 崔海,徐亚丽,吴盛正,等.微泡超声空化声压幅度与大鼠血脑屏障通透性关系的研究[J].中华超声影像学杂志,2015,24(8):715-719.
[3] Baseri B, Choi JJ, Tung YS, et al. Multi-modality safety assessment of blood-brain barrier opening using focused ultrasound and definity microbubbles: a short-term study[J]. Ultrasound Med Biol, 2010,36(9):1445-1459.
[4] 尹燕,邹建中.聚焦超声联合微泡开放血脑屏障的研究进展[J].临床超声医学杂志,2015,17(3):185-187.
[5] 陈芸,蔡有利,王峰,等.低频聚焦超声联合微泡开放大鼠血脑屏障的时间参数对比研究[J].中国医学超声杂志,2011,27(9):769-772.
[6] 邓水香,曹同瓦,祝禾辰,等.降钙素原与单纯脑外伤患者病情严重程度和并发症以及预后的关系[J].中华急诊医学杂志,2012,21(9):1032-1036.
[7] 沈斌,杭春华.炎症因子在脑外伤继发性脑损害中的作用及研究进展[J].医学综述,2011,17(11):1621-1624.
[8] 马英鑫,陈贺愈,夏伟梁,等.炎性反应在缺血性脑损伤中的作用和机制[J].中国现代神经疾病杂志,2011,11(2):160-164.
[9] 王琪.颅脑损伤患者早期血清IL-1β 和 IL-6及TNF-α测定的临床意义[J].河北医药,2010,32(19):2709-2710.
[10] 李新玲,周永,黄怀宇,等.地塞米松对大鼠局灶性脑缺血再灌注模型TNF-α和IL-1的影响[J].放射免疫学杂志,2011,24(2):198-200.
[11] Yang S, Li R, Qu X, et al. Fosinoprilat alleviates lipopolysaccharide induced inflammation by inhibiting TLR4/NF-KB signaling in monocytes [J]. Cell Immunol, 2013,284(1-2):182-186.
[12] 张小芸,尹昌浩,郭艳芹.炎症反应与脑缺血-再灌注损伤的研究进展[J].牡丹江医学院学报,2013,34(6):81-83.
[13] Hynynen K, McDannold N, Nickolai A, et al . Local and reversible blood-brain barrier disruption by non-invasive focused ultrasound at frequencies suitable for trans-skull sonication[J].NeuroImage, 2005,24(1):12-20.
翟虹(E-mail: zhaishuanghai@sina.com)
10.3969/j.issn.1002-266X.2017.29.011
R725.54
A
1002-266X(2017)29-0036-03
2017-05-22)

