RegⅣ基因对胰腺癌细胞PANC-1增殖、侵袭、转移能力的影响
胡启立,李健,孟红波,周波,王锋,宋振顺
(1安徽医科大学上海临床学院,上海200072;2上海市第十人民医院)
·论著·
RegⅣ基因对胰腺癌细胞PANC-1增殖、侵袭、转移能力的影响
胡启立1,2,李健2,孟红波2,周波2,王锋2,宋振顺1,2
(1安徽医科大学上海临床学院,上海200072;2上海市第十人民医院)
目的 探讨RegⅣ基因对胰腺癌细胞PANC-1增殖、侵袭、转移能力的影响。方法 取对数生长期的PANC-1细胞,于孵育箱中培养至70%~80%融合,分别以Puro-P-RegⅣ-shRNA慢病毒载体(P-RegⅣ-shRNA组)以及Puro-shRNA慢病毒空载体(P-NC-shRNA组)感染细胞,并设立不感染组(PANC-1组)。48 h后,分别用qRT-PCR法和Western blotting法检测各组RegⅣ mRNA及蛋白的表达。通过CCK-8试验检测细胞增殖情况,利用划痕试验和Transwell小室侵袭试验分别检测细胞的转移和侵袭能力。将10只5周龄的雌性裸鼠随机分成P-RegⅣ-shRNA裸鼠组和P-NC-shRNA裸鼠组,每组5只。取对数生长期的P-RegⅣ-shRNA和P-NC-shRNA组细胞分别注射入上述两组中。自接种日起每天观察肿瘤结节生长情况,6周后处死裸鼠并取出瘤体称重并测量瘤体体积。结果 P-RegⅣ-shRNA组中RegⅣ mRNA和蛋白的表达水平较PANC-1组和P-NC-shRNA组均下降(P均<0.05)。P-RegⅣ-shRNA组细胞增殖活力较P-NC-shRNA组和PANC-1组下降(P均<0.05)。与PANC-1组、P-NC-shRNA组比较,P-RegⅣ-shRNA组48 h细胞迁移距离缩短,穿膜细胞数减少(P均<0.05)。PANC-1组、P-NC-shRNA组各观察指标比较,P均>0.05。与P-NC-shRNA裸鼠组比较,P-RegⅣ-shRNA裸鼠组肿瘤生长速度慢,肿瘤体积小(P均<0.01)。结论 下调RegⅣ基因可抑制胰腺癌细胞PANC-1增殖、转移、侵袭。
胰腺肿瘤;RegⅣ基因;再生基因家族;细胞增殖;细胞侵袭
我国胰腺癌的发病率正处于不断上升态势[1],早期转移是其一个重要特性[2],也是影响患者生存率的重要原因。再生基因家族(Reg家族)是一组分泌蛋白,在体内发挥促进细胞增殖、抗凋亡的作用[3]。RegⅣ是再生基因家族最近发现的成员,在包括胃癌、结肠癌、胰腺癌等多种消化道恶性肿瘤中特异性表达[4],过表达RegⅣ与肿瘤细胞的生长、黏附和抗凋亡有关。近期研究表明,RegⅣ基因在胰腺癌的早期发生和进展起着重要作用,提示RegⅣ基因可能是胰腺癌早期诊断和治疗的靶基因[5, 6]。为观察RegⅣ基因对胰腺癌PANC-1细胞增殖、侵袭和转移能力的影响,2015年9月~2016年12月,本试验通过慢病毒下调胰腺癌细胞PANC-1的RegⅣ基因表达[7],探讨其在胰腺癌增殖、侵袭和转移中的作用。
1 材料与方法
1.1 细胞、动物、试剂及仪器 胰腺癌细胞株PANC-1由上海市第十人民医院肝胆胰外科保存;5周龄体质量约18 g雌性裸鼠购自上海史莱克公司。Puro-P-RegⅣ-shRNA慢病毒载体由上海汉恒生物有限公司构建。DMEM培养基、胎牛血清(FBS)、青链霉素(PS)、胰蛋白酶均购自美国Gibco公司;Transwell小室(孔径为8 μm)购自美国Corning-Costar公司;人工细胞外基质胶购自美国BD公司。
1.2 细胞培养、转染及转染克隆的筛选 PANC-1细胞培养于10% FBS、1% PS的DMEM培养基,于37 ℃、5% CO2孵育箱培养,待细胞生长到90%时使用0.25%胰蛋白酶消化传代,取对数生长期的PANC-1细胞,将PANC-1细胞铺入6孔板中每孔接种1×105个细胞,于孵育箱中培养至70%~80%融合,分别以Puro-P-RegⅣ-shRNA慢病毒载体及Puro-shRNA慢病毒空载体感染细胞,分别命名为P-RegⅣ-shRNA、P-NC-shRNA组,并设立不感染组(PANC-1组)。感染6 h后换用无抗生素的含10% FBS的DMEM培养基培养,48 h后,荧光显微镜下观察,待80%以上细胞带有绿色荧光后即可进行筛选,将培养基换成含有嘌呤霉素(Puro,2 μg/mL)的选择培养基,1周后进行单克隆挑选,具体方法为:取100个细胞加入到10 mL完全培养基中冲悬,取96孔板,每孔加入细胞悬液100 μL,显微镜下观察,挑出只有单个细胞的孔并作出标记,2~3 d观察1次,7 d换液,至细胞长成集落后,采用胰酶消化,然后转移至24孔板中继续培养,直至细胞长到需要的数量,期间隔段时间向培养基中加入嘌呤霉素筛选1次。
1.3 PANC-1细胞RegⅣ mRNA表达的检测 采用qRT-PCR法。利用TRIzol试剂盒提取各组细胞总RNA。将提取得到的总RNA进行反转录获得cDNA后进行RT-PCR反应。RT-PCR引物:RegⅣ上游引物:5′-CGCTGAGATGAACCCCAAG-3′,下游引物:5′-TGAGAGGGAAGTGGGAAGAG-3′;β-actin上游引物:5′-CTGGAACGGTGAAGGTGCA-3′,下游引物:5′-AAGGGACTTCCTGTAACAATGCA-3′。反应条件为95 ℃预变性30 s、95 ℃变性5 s、60 ℃退火30 s、72 ℃延伸30 s,进行40个循环。目的基因表达量采用2-ΔΔCT法计算 。
1.4 PANC-1细胞RegⅣ蛋白表达的检测 采用Western blotting法。使用蛋白裂解液裂解各组细胞获得蛋白,并使用BCA法测定其蛋白浓度。使用蛋白上样缓冲液及裂解液将各组蛋白样品稀释成等体积等浓度,每孔加入蛋白样品20 μg,进行聚丙酰胺凝胶电泳、转膜,5%脱脂牛奶常温封闭1 h后加入一抗(1∶1 000)4 ℃孵育过夜,使用PBST洗膜3次,每次10 min,后加二抗(1∶2 000)室温孵育1 h,PBST洗膜3次,每次10 min,加ECL发光剂反应2 min,X线光片上曝光1 min,胶片洗涤干燥,用FluorChemQ多功能成像和定量分析系统将胶片成像。结果重复3次得到稳定结果。用 Image J 图像软件进行灰度分析,以空白对照组灰度值为参考,对目的蛋白相对表达量进行标准化。
1.5 PANC-1细胞增殖活力测定 采用CCK-8法。取对数生长期细胞,消化成单细胞悬液,稀释成1×104/mL,接种于96孔板中,每孔加细胞悬液100 μL,分别于24、48、72 h后换液,加入培养液100 μL,再每孔加入CCK-8试剂10 μL,37 ℃孵育1 h后酶标仪450 nm处测光密度(A),并减去空白处A得到实际A值,每组做3个复孔取平均值。增殖活力=(实验组A值-空白对照A值)/(初始A值-空白对照A值)。
1.6 PANC-1细胞转移能力检测 采用细胞划痕试验。在6孔板中分别加入各组细胞,每孔铺入5×105个细胞,每孔加完全培养液2 mL,并放入5% CO2、37 ℃孵育箱中培养,待细胞长至完全融合后,使用无菌的200 μL移液器tip头在培养板底部呈“+”划痕,用无血清培养基洗涤3次,去除划下来的细胞团并加入不含血清的纯DMEM培养基,倒置显微镜下拍照,记录初始间距,置入孵育箱中继续培养,48 h后再次在相同的位置拍照,每组取5个点进行测量,取平均值作为迁移的相对间距,并与初始间距进行比较。
1.7 PANC-1细胞侵袭能力检测 采用细胞侵袭试验。将各组细胞分别铺到6孔板中,待细胞长至70%~80%融合时,胰蛋白酶消化后用不含血清的纯DMEM培养基冲悬至1×105/mL。用50 mg/L Matrigel 1∶8稀释液包被Transwell小室底部膜的上室面,置于37 ℃环境下30 min使Matrigel聚合成凝胶,小室使用前用纯培养基水化1 h。将上述准备的细胞悬液加到Transwell小室的上室,每孔加细胞悬液200 μL,注意使细胞均匀分布在上室内,下室内加入含有10% FBS的DMEM培养基800 μL,置于37 ℃、5% CO2孵育箱中培养48 h后取出,用棉签头去除Matrigel基质胶和未穿过的细胞,4%多聚甲醛固定15 min,结晶紫染色3 min,用刀片将膜切下,贴到载玻片上,显微镜下进行拍照并观察,随机取5个视野的细胞进行计数并计算平均值。
1.8 裸鼠成瘤试验 取对数生长期的P-RegⅣ-shRNA和P-NC-shRNA组细胞,使用胰蛋白酶消化离心稀释到细胞密度为1×107/mL。将10只5周龄的雌性裸鼠随机分成P-RegⅣ-shRNA裸鼠组和P-NC-shRNA裸鼠组,每组5只,1%戊巴比妥钠0.1 mL腹腔注射麻醉。每组分别接种1种细胞,每只裸鼠下注射细胞悬液0.1 mL。接种细胞后放置于恒温( 26±2)℃、湿度 45%~50%、无菌净化屏障系统内饲养,自接种日起每天观察肿瘤结节生长情况,6周后处死裸鼠并取出瘤体称重,测量瘤体体积。肿瘤体积按V=长×宽2×0.5公式计算。
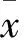
2 结果
2.1 各组RegⅣ mRNA及蛋白表达比较 PANC-1组、P-NC-shRNA组、P-RegⅣ-shRNA组中RegⅣ mRNA的相对表达量分别为1.02±0.07、1.06±0.07、0.22±0.03;RegⅣ蛋白的相对表达量分别为2.57±0.10、2.53±0.12、0.50±0.06。P-RegⅣ-shRNA组中RegⅣ mRNA和蛋白相对表达量较PANC-1组和P-NC-shRNA组均下降(P均<0.05)。前两组间比较,P均>0.05。
2.2 各组不同时间细胞增殖活力比较 PANC-1组24、48、72 h后细胞增殖活力分别为0.60±0.07、1.25±0.06、2.63±0.09,P-NC-shRNA组分别为0.58±0.07、1.17±0.04、2.43±0.05,P-RegⅣ-shRNA组分别为0.41±0.05、0.75±0.06、1.49±0.05。P-RegⅣ-shRNA组细胞增殖活力较P-NC-shRNA组和PANC-1组下降(P均<0.05)。前两组间比较,P均>0.05。
2.3 各组细胞转移和侵袭能力比较 PANC-1组、P-NC-shRNA组、P-RegⅣ-shRNA组 48 h 迁移距离分别为(0.37±0.14)、(0.31±0.18)、( 0.03±0.02)mm,穿膜细胞数分别为(32.2±1.7)、(28.0±3.5)、(18.7±5.1)个/HP。与PANC-1组、P-NC-shRNA组比较,P-RegⅣ-shRNA组各指标均降低(P均<0.05)。前两组间比较,P均>0.05。
2.4 RegⅣ对裸鼠体内胰腺癌PANC-1细胞生长的影响 裸鼠皮下接种1×106个细胞后100%可以长出肿瘤,P-NC-shRNA裸鼠组、P-RegⅣ-shRNA裸鼠组接种细胞后长出肉眼可见肿瘤的时间分别为(5.2±0.8)d、(8.6±0.9)d,中间无一例死亡。P-RegⅣ-shRNA裸鼠组和P-NC-shRNA裸鼠组的肿瘤体积分别为(1.304±0.148)、(2.645±0.583)cm3。P-RegⅣ-shRNA裸鼠组肿瘤生长速度慢于P-NC-shRNA组,肿瘤体积小于P-NC-shRNA组(P均<0.01)。
3 讨论
肿瘤的发生发展是多种因素共同作用的结果[8],胰腺癌的早期转移是影响胰腺癌患者预后的重要原因。90%胰腺癌患者确诊时已处于疾病的中晚期[9],因此针对胰腺癌侵袭转移机制的研究对于提高胰腺癌诊断价值和治疗效果非常重要。
RegⅣ基因在消化道恶性肿瘤中的发病及发展中,特别是在促进肿瘤细胞增殖、抗凋亡中发挥重要作用。研究表明,其在包括胰腺癌的多种肿瘤组织中表达增加[3, 4, 10]。Hedgehog信号通路是生物体内的一条重要的信号传导通路。Hedgehog信号通路在包括胰腺癌的多种肿瘤中异常激活,在胰腺癌细胞株和组织中Hedgehog信号通路均被异常激活[11~14]。GLI1是Hedgehog信号通路中转录因子。我们的前期研究发现,RegⅣ是GLI1的下游靶基因[15]。本试验通过体内及体外试验来探讨RegⅣ基因对胰腺细胞增殖、转移和侵袭能力的影响。本研究中,我们通过将带有shRNA-RegⅣ干扰序列的慢病毒转染到胰腺癌细胞PANC-1中,从mRNA和蛋白水平证实RegⅣ表达下调。细胞增殖试验提示,下调RegⅣ基因的细胞生长速度较转染空病毒的细胞明显减慢。进而我们进行了裸鼠皮下成瘤试验,在给裸鼠皮下分别接种P-RegⅣ-shRNA细胞和P-NC-shRNA细胞相同的时间后,P-RegⅣ-shRNA裸鼠组的肿瘤体积较P-NC-shRNA裸鼠组减小。体内和体外试验表明,下调RegⅣ基因可以抑制胰腺癌细胞增殖。
我们还通过细胞划痕试验和Transwell侵袭试验来探讨下调RegⅣ基因后PANC-1细胞的转移和侵袭能力变化。在划痕试验及Transwell侵袭试验中,我们利用不含血清的纯DMEM培养基培养细胞,细胞缺乏增殖所需的必需生长因子及营养物质,增殖受到抑制,消除增殖对试验结果的影响。结果显示,下调RegⅣ基因后PANC-1细胞的转移和侵袭能力均较P-NC-shRNA组下降,表明RegⅣ基因可以加强胰腺癌细胞的转移和侵袭能力,该结果与RegⅣ基因在其他癌症中的研究[4, 10, 16]结果一致。Wang等[16]发现,RegⅣ通过GPR37促进胃癌的腹膜转移。Bishnupuri等[17]研究发现,RegⅣ基因在结直肠癌中可以促进有丝分裂。Zhu等[18]研究发现,在结直肠癌中RegⅣ与MMP-7相互作用共同影响患者预后。但RegⅣ基因在胰腺癌中如何发挥作用的机制还不清楚,具体研究还有待进一步开展。
综上所述,本研究结果表明RegⅣ基因在胰腺癌细胞的增殖、侵袭和转移中发挥促进作用,其有可能是胰腺癌潜在的治疗靶点。
[1] 项金峰,施思,梁丁孔,等. 2015年胰腺癌研究及诊疗前沿进展[J].中国癌症杂志,2016,26(4):281-289.
[2] Ma Y, Wu Q, Li X, et al. Pancreatic cancer: from bench to bedside[J]. Ann Transl Med, 2016,4(23):458.
[3] Zhang YW, Ding LS, Lai MD. Reg gene family and human diseases[J]. World J Gastroenterol, 2003,9(12):2635-2641.
[4] Zhu X, Han Y, Yuan C, et al. Overexpression of Reg4, alone or combined with MMP-7 overexpression, is predictive of poor prognosis in colorectal cancer[J]. Oncol Rep, 2015,33(1):320-328.
[5] Legoffic A, Calvo E, Cano C, et al. The reg4 gene, amplified in the early stages of pancreatic cancer development, is a promising therapeutic target[J]. PLoS One, 2009,4(10):e7495.
[6] Takayama R, Nakagawa H, Sawaki A, et al. Serum tumor antigen REG4 as a diagnostic biomarker in pancreatic ductal adenocarcinoma[J]. J Gastroenterol, 2010,45(1):52-59.
[7] 李健, 胡启立, 徐凌,等. 慢病毒shRNA靶向干扰RegⅣ基因胰腺癌细胞株的构建[J]. 复旦学报(医学版),2016,43(2):147-153.
[8] Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014,64(1):9-29.
[9] Kamisawa T, Wood LD, Itoi T, et al. Pancreatic cancer[J]. The Lancet, 2016,388(10039):73-85.
[10] Chen S, Gou WF, Zhao S, et al. The role of the REG4 gene and its encoding product in ovarian epithelial carcinoma[J]. BMC Cancer, 2015,15:471-482.
[11] Hebrok M. Hedgehog signaling in pancreas development[J]. Mech Dev, 2003,120(1):45-57.
[12] Watkins DN, Berman DM, Burkholder SG, et al. Hedgehog signalling within airway epithelial progenitors and in small-cell lung cancer[J]. Nature, 2003,422(6929):313-317.
[13] Merchant JL,Saqui-Salces M. Inhibition of Hedgehog signaling in the gastrointestinal tract: targeting the cancer microenvironment[J]. Cancer Treat Rev, 2014,40(1):12-21.
[14] Thayer SP, di Magliano MP, Heiser PW, et al. Hedgehog is an early and late mediator of pancreatic cancer tumorigenesis[J]. Nature, 2003,425(6960):851-856.
[15] Wang F, Xu L, Guo C, et al. Identification of RegIV as a novel GLI1 target gene in human pancreatic cancer[J]. PLoS One,2011,6(4):e18434.
[16] Wang H, Hu L, Zang M, et al. REG4 promotes peritoneal metastasis of gastric cancer through GPR37[J]. Oncotarget,2016,7(19):27874-27888.
[17] Bishnupuri KS, Sainathan SK, Bishnupuri K, et al. Reg4-induced mitogenesis involves Akt-GSK3beta-beta-Catenin-TCF-4 signaling in human colorectal cancer[J]. Mol Carcinog, 2014,53(1):169-180.
[18] Zhu X, Han Y, Yuan C, et al. Overexpression of Reg4, alone or combined with MMP-7 overexpression, is predictive of poor prognosis in colorectal cancer[J]. Oncol Rep, 2015,33(1):320-328.
Effects of RegIV on proliferation, invasion, and migration of pancreatic cancer cells PANC-1
HUQil1,LIJian,MENGHongbo,ZHOUBo,WANGFeng,SONGZhenshun
(1ShanghaiClinicalFacultyofAnhuiMedicalUniversity,Shanghai200072,China)
Objective To explore the effects of RegIV gene on the proliferation, invasion, and migration of pancreatic cancer cells PANC-1. Methods PANC-1 cells in logarithmic growth phase were cultured in the incubator until they reached 70%-80% confluence. PANC-1 cells were transfected with Puro-P-RegIV-shRNA lentiviral vector (P-RegⅣ-shRNA group) and Puro-shRNA lentiviral empty vector (P-NC-shRNA group), respectively. Cells without transfection or with null-transfection were served as controls (PANC-1 group). At 48 h after transfection, quantitative real-time reverse transcription-polymerase chain reaction (qRT-PCR) and Western blotting were used to detect the expression of RegIV mRNA and protein. The CCK-8 test was used to detect the proliferation. Scratch test and Transwell chamber test were used to detect the migration and invasion of the cells, respectively. Ten 5-week-old female nude mice were randomly divided into the P-RegⅣ-shRNA nude mouse group and P-NC-shRNA nude mouse group with 5 in each group, which were then injected with P-RegⅣ-shRNA and P-NC-shRNA cells in logarithmic growth phase in the above two groups. The growth of tumor nodules was observed every day from the day of inoculation. After 6 weeks, the nude mice were sacrificed and the tumor volume was measured. Results The expression levels of RegIV mRNA and protein in the P-RegⅣ-shRNA group were significantly lower than those of the PANC-1 group and P-NC-shRNA group (bothP<0.05). Cells in the P-RegⅣ-shRNA group had a lower proliferative capacity than cells in the P-NC-shRNA group and PANC-1 group (P<0.05). Moreover, compared with the PANC-1 group and P-NC-shRNA group, Puro-P-RegIV-shRNA group showed shorter transmembrane distance and decreased number of transmembrane cells, indicating decreased migration ability (allP<0.05). No significant differences were found in the above parameters between the PANC-1 group and P-NC-shRNA group (allP>0.05). Besides, tumor growth rate and the tumor volume in nude mice were decreased significantly in the P-RegⅣ-shRNA nude mouse group as compared with those of the P-NC-shRNA nude mouse group (P<0.01).Conclusion Down-regulation of RegIV could inhibit the proliferation, invasion, and migration of PANC-1 cells.
pancreatic neoplasms; RegIV gene; regenerating gene family; cell proliferation; cell invasion
国家自然科学基金资助项目(81670582)。
胡启立(1991-),男,在读硕士,主要研究方向为胰腺癌的基础研究。E-mail:1061167453@qq.com
宋振顺(1961-),男,教授,主要研究方向为干细胞移植。E-mail:zhenshunsong@aliyun.com
10.3969/j.issn.1002-266X.2017.29.001
R737.9
A
1002-266X(2017)29-0001-04
2017-04-07)

