急性脑出血患者血浆、脑脊液β-内啡肽、GnRH水平变化对脑损伤程度及预后的影响
孙永,姚凯华,李志锋,刘永玲
(青海红十字医院,西宁810000)
急性脑出血患者血浆、脑脊液β-内啡肽、GnRH水平变化对脑损伤程度及预后的影响
孙永,姚凯华,李志锋,刘永玲
(青海红十字医院,西宁810000)
目的 探讨急性脑出血(ICH)患者血浆和脑脊液中β-内啡肽、促性腺激素释放激素(GnRH)水平变化及其对脑损伤程度和预后的影响。方法 89例ICH患者为病例组,按照斯堪的纳维亚卒中量表(SSS)评分将其分为轻型ICH组(SSS评分 0~15分,n=41)、中型ICH组(SSS评分 16~30分,n=28)、重型ICH组(SSS评分31~45分,n=20例),按照格拉斯哥预后量表(GOS)评分将其分为预后良好组(GOS评分4~5分,n=63)、预后不良组(GOS评分1~3分,n=26)。采用放射免疫法对患者入院后1、3、7、14、30 d血浆和脑脊液中β-内啡肽、GnRH水平进行检测。并于同期选取30例无神经系统疾病且行腰穿麻醉术的患者为对照组。结果 随着入院时间延长,轻型、中型、重型ICH患者血浆、脑脊液中β-内啡肽、GnRH水平均呈逐渐下降趋势(P均<0.05)。病例组入院后1、3、7、14 d血浆、脑脊液β-内啡肽、GnRH水平均高于对照组(P均<0.05),轻型、中型、重型ICH组间两两比较,P均<0.05。入院30 d时,中型、重型ICH组血浆、脑脊液β-内啡肽、GnRH水平高于轻型ICH组、对照组,重型ICH组血浆、脑脊液β-内啡肽、GnRH水平高于中型ICH组(P均<0.05)。预后良好组入院1、3、7、14、30 d血浆、脑脊液β-内啡肽、GnRH水平均低于预后不良组(P均<0.05)。结论 ICH患者血浆和脑脊液中β-内啡肽、GnRH水平升高,其水平升高可致脑损伤程度加重,预后变差。
急性脑出血;β-内啡肽;促性腺激素释放激素;脑损伤;预后
急性脑出血(ICH)是临床常见的神经系统疾病,具有发病急、病情严重、致残率和病死率高、预后差的特点[1]。头颅CT是早期诊断脑出血的重要手段,但是其不能全面有效判断脑损伤严重程度和评估预后[2],进而无法制定个体化的治疗方案。因此,寻找有效的特异性标志物早期辅助判断脑损伤严重程度以及评估预后具有重要的临床价值。β-内啡肽是主要分布在下丘脑和垂体的阿片肽,广泛参与中枢神经系统活动,与垂体功能密切相关。促性腺激素释放激素(GnRH)是一种10肽激素,由下丘脑内侧基底神经元所分泌,不仅维持性腺的生理功能,而且参与垂体功能[3,4]。本研究动态监测血浆和脑脊液中β-内啡肽和GnRH水平,旨在探讨两者在ICH后脑损伤程度的判定以及预后评估中的作用,从而为临床早期制定个体化的治疗方案提供指导。
1 资料与方法
1.1 临床资料 收集2014年1月~2016年12月青海红十字医院神经内科收治的89例ICH患者为病例组,均符合1995年全国第四届脑血管病学术会议有关脑出血的诊断标准[5]。纳入标准:①经头颅CT检查证实为ICH;②发病至入院<24 h,且入院时未发生脑疝的患者。排除标准:①合并有重度高血压者,即收缩压≥180 mmHg或舒张压≥110 mmHg;②心脏功能不全者;③肝、肾功能障碍者;④因脑外伤或脑瘤卒中等所致的继发性脑出血;⑤多灶性脑出血;⑥混合型脑卒中;⑦其他神经系统器质性疾病或恶性肿瘤等;⑧系统疾病;⑨孕产妇以及哺乳期妇女。其中患者男57例、女32例,年龄39~77(53.8±11.6)岁;脑损伤原因:脑内肿瘤37例、脑挫裂伤28例、脑血管病24例;出血部位均为基底节或者皮层下;出血量30~50 mL;病程1~9(2.33±0.68)h。按照斯堪的纳维亚卒中量表(SSS)评分标准[6],病例组患者中轻型ICH患者(SSS评分 0~15分)(轻型ICH组)41例,中型ICH患者(SSS评分 16~30分)(中型ICH组)28例,重型ICH患者(SSS评分31~45分)(重型ICH组)20例。按照格拉斯哥预后量表(GOS)评分[7]将病例组患者分为预后良好(GOS评分4~5分,包括恢复良好和轻度残疾)组63例,预后不良(GOS评分1~3分,包括重度残疾、植物状态、死亡)组26例。于同期随机选取30例行腰穿麻醉术的患者为对照组,排除标准:①神经系统疾病;②其他可能影响本研究结果的疾病。其中男19例、女11例,年龄43~79(51.5±13.0)岁。两组性别构成比、年龄具有可比性。
1.2 治疗方法 ICH患者入院后均接受常规治疗联合高压氧治疗,常规治疗包括降颅内压、脱水、控制血压和血糖水平、抗感染、改善脑循环、维持水电解质和酸碱平衡,同时提高营养支持;与此同时,给予患者高压氧治疗,将高压氧舱内的空气加压至0.22 MPa,然后稳压,吸入纯氧的时间持续60 min,停10 min后完成治疗,减压20 min出舱,1次/d,1个疗程10 d,连续治疗3个疗程,在治疗过程中密切观察患者生命体征、面色、意识等,如出现异常情况采取针对性抢救措施。治疗后电话和门诊随访,并采用GOS评分评价患者的预后[7]:恢复良好计为5分,即尽管有轻度的缺陷但是恢复至正常的生活;轻度残疾计为4分,即残疾但是可以独立的生活,且可以在保护下工作;重度残疾计为3分,即残疾,日常的生活都需要照料;植物状态计为2分,即仅仅有最小的反应;死亡计为1分。预后良好:GOS评分≥4分,预后不良:GOS评分<4分。
1.3 血浆、脑脊液β-内啡肽、GnRH水平的检测 于病例组患者入院后1、3、7、14、30 d的清晨,收集空腹肘静脉血5 mL,同时采集脑脊液3 mL,并将血液标本和脑脊液标本装于EP管中,置于80 ℃的温水浴锅中,持续5 min;对照组患者于入院时收集肘静脉血5 mL,并在腰穿麻醉术过程中收集脑脊液3 mL。血液标本以3 000 r/min离心30 min,弃去上清液后将剩余血浆标本置于-40 ℃环境下保存,留待检测。采用放射免疫法对两组血浆、脑脊液中β-内啡肽、GnRH水平进行检测,其中β-内啡肽试剂盒由上海斯信生物科技有限公司提供,GnRH试剂盒由上海杏宜生物科技有限公司提供,严格按照试剂盒上的说明进行相关操作。
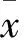
2 结果
2.1 不同脑损伤程度ICH患者不同时间血浆中β-内啡肽、GnRH水平比较 轻型组入院后1、3、7、14 、30 d血浆β-内啡肽水平分别为(290.92±43.37)、(265.45±44.63)、(218.75±39.98)、(189.22±42.38)、(165.28±43.37)ng/L,血浆GnRH水平分别为(463.38±45.14)、(418.52±39.16)、(373.24±42.21)、(321.28±38.82)、(297.37±40.52)ng/L;中型ICH组血浆β-内啡肽水平分别为(377.65±51.06)、(326.33±50.02)、(279.58±46.62)、(227.93±41.56)、(189.20±37.62)ng/L,血浆GnRH水平分别为(723.51±39.92)、(632.38±44.39)、(549.60±46.34)、(479.86±41.29)、(385.06±45.60)ng/L;重型ICH组血浆β-内啡肽水平分别为(482.24±38.79)、(419.92±42.28)、(366.34±45.19)、(328.97±47.23)、(249.51±45.58)ng/L,血浆GnRH水平分别为(988.76±51.33)、(856.24±45.11)、(761.85±40.07)、(655.89±45.55)、(549.34±43.27)ng/L;对照组血浆β-内啡肽水平为(157.11±49.60)ng/L,血浆GnRH水平为(289.73±38.65)ng/L。入院后1、3、7、14 d病例组血浆β-内啡肽、GnRH水平均高于对照组,轻型、中型、重型ICH组间两两比较,P均<0.05;入院30 d,中型、重型ICH组血浆β-内啡肽、GnRH水平高于轻型ICH组、对照组,且重型ICH组高于中型ICH组(P均<0.05)。随着入院时间的延长,轻型、中型、重型ICH患者血浆β-内啡肽、GnRH水平均呈逐渐下降趋势(P均<0.05)。
2.2 不同脑损伤程度ICH患者不同时间脑脊液中β-内啡肽、GnRH水平比较 轻型组入院后1、3、7、14 、30 d脑脊液β-内啡肽水平分别为(138.37±10.75)、(115.50±11.24)、(98.75±9.62)、(87.34±9.78)、(80.68±10.26)ng/L,脑脊液GnRH水平分别为(245.70±11.35)、(192.79±12.23)、(168.34±11.52)、(145.33±11.09)、(134.72±12.23)ng/L;中型ICH组脑脊液β-内啡肽水平分别为(217.56±9.68)、(179.28±10.75)、(131.43±8.89)、(119.98±11.56)、(109.57±8.95)ng/L,脑脊液GnRH水平分别为(378.23±13.21)、(322.81±12.99)、(276.82±12.90)、(221.26±12.24)、(178.59±10.05)ng/L;重型ICH组脑脊液β-内啡肽水平分别为(272.43±11.12)、(234.65±10.33)、(208.15±9.56)、(178.36±8.93)、(131.09±10.11)ng/L,脑脊液GnRH水平分别为(492.34±11.08)、(406.83±13.57)、(349.27±11.76)、(289.35±14.13)、(234.61±11.78)ng/L;对照组脑脊液β-内啡肽水平为(77.68±9.65)ng/L,脑脊液GnRH水平为(130.24±12.35)ng/L。入院后1、3、7、14 d病例组脑脊液β-内啡肽、GnRH水平均高于对照组,轻型、中型、重型ICH组间两两比较,P均<0.05;入院30 d时,中型、重型ICH组脑脊液β-内啡肽、GnRH水平高于轻型ICH组、对照组,且重型ICH组高于中型ICH组(P均<0.05)。随着入院时间延长,轻型、中型、重型ICH患者脑脊液β-内啡肽、GnRH水平均呈逐渐下降趋势(P均<0.05)。
2.3 不同预后患者不同时间血浆及脑脊液中β-内啡肽、GnRH水平比较 预后良好组入院后1、3、7、14、30 d血浆β-内啡肽、GnRH水平均低于预后不良组(P均<0.05)。见表1。
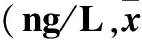
表1 预后良好组与预后不良组不同时间血浆及脑脊液β-内啡肽、GnRH水平比较±s)
注:与预后不良组同时间比较,*P<0.05。
3 讨论
下丘脑是连接神经系统与内分泌系统的重要枢纽,生理功能极为复杂,神经内分泌细胞受到刺激后可促进垂体分泌细胞分泌不同类型且能够调控靶腺激素代谢的促激素释放因子,因此,垂体分泌的活性物质经神经通路以及体液通路介导了机体内环境的生理过程[8,9]。β-内啡肽是前阿黑皮素的31肽酶裂解片段,主要由下丘脑基底内侧弓状核内神经元所分泌,与阿片受体的亲和力较强,可使大脑中小动脉血流量减少、凝血因子活性增加、血液浓缩以及血栓素含量增加,并且参与垂体功能[10,11]。GnRH是一种10肽神经激素,由下丘脑内侧基底神经元合成和分泌,通过调控性腺轴各级水平活动而维持性腺的正常生理功能,与垂体功能密切相关[12]。动物实验表明,β-内啡肽、GnRH存在于血液和脑脊液中,不仅参与机体正常的生理功能,还介导了损伤应激反应,使神经元发生水肿、脑组织血流灌注下降,抑制中枢神经系统功能,加重意识障碍。
ICH严重威胁患者健康,早期制定个体化治疗方案对缓解患者病情、改善预后有重要意义。患者脑出血后血肿周围组织发生水肿以及血肿的占位性效应导致颅内压急剧升高、脑组织结构破坏,使下丘脑功能受到直接或间接影响。由于β-内啡肽、GnRH与垂体功能密切相关,下丘脑功能受到影响是否会干扰血液、脑脊液中β-内啡肽、GnRH水平,目前相关的研究相对较少。本研究动态监测血浆和脑脊液中β-内啡肽和GnRH水平,旨在探讨其在脑出血后脑损伤程度判定以及预后评估中的作用。
本研究结果显示,随着入院时间逐渐延长,不同严重程度脑损伤的ICH患者血浆、脑脊液中β-内啡肽、GnRH水平均呈逐渐下降趋势,可能与ICH患者入院后经过治疗,脑损伤得到一定程度控制有关。此外,ICH患者入院后1、3、7、14 d,β-内啡肽、GnRH水平均高于对照组,可能是因为脑出血时,ICH周围脑组织的血液循环发生障碍以及血肿出现占位性效应,明显损伤脑组织,进而刺激垂体释放大量的β-内啡肽、GnRH进入到血液和脑脊液中,导致患者血浆和脑脊液中β-内啡肽、GnRH水平升高。此外,本研究结果表明,入院后1、3、7、14、30 d,中型、重型ICH患者血液、脑脊液中β-内啡肽、GnRH水平高于轻型ICH患者,并且重型ICH患者血浆、脑脊液中β-内啡肽、GnRH水平高于中型ICH患者,说明血浆、脑脊液中β-内啡肽、GnRH水平与脑损伤严重程度有关,血浆、脑脊液中β-内啡肽、GnRH水平越高,脑损伤越严重,这对临床指导医生制定个体化治疗方案有重要意义。大多数脑出血患者预后较差,早期评估临床预后,并采取有效措施进行干预,可以明显改善预后。本研究结果发现,预后良好组入院后1、3、7、14、30 d,血浆、脑脊液中β-内啡肽、GnRH水平均低于预后不良组,提示血浆、脑脊液中β-内啡肽、GnRH水平可有效评估ICH患者预后,脑出血后血浆、脑脊液β-内啡肽、GnRH水平越高,脑损伤越严重,预后越差。
综上所述,β-内啡肽、GnRH参与了脑出血的发生、发展过程,动态监测血浆、脑脊液中β-内啡肽、GnRH水平有助于早期评估患者脑损伤严重程度以及预后,从而为临床医生制定个体化治疗方案提供指导。
[1] Shrestha GS. Intensive blood-Pressure lowering in cerebral hemorrhage[J]. N Engl J Med, 2016,375(23):e48.
[2] 王小蓉,杜晓渝,陈娅,等.S-100B检测对急性脑出血患者临床预后的评估价值研究[J].中国医药导报,2013,10(15):58-59,62.
[3] Mukhomedzyanov AV, Maslov LN, Tsibulnikov SY, et al. Endomorphins and β-Endorphin do not affect heart tolerance to the pathogenic effect of reperfusion[J]. Bull Exp Biol Med, 2016,162(1):23-26.
[4] Brown JL, Roberson M. Novel insights into gonadotropin-releasing hormone action in the pituitary gonadotrope[J]. Semin Reprod Med, 2017,35(2):130-138.
[5] 中华神经科学会,中华神经外科学会.各类脑血管疾病诊断要点[J].中华神经科杂志,1996,29(6):379.
[6] Askim T, Bernhardt J, Churilov L, et al. The scandinavian stroke scale is equally as good as the national institutes of health stroke scale in identifying 3-month outcome[J]. J Rehabil Med, 2016,48(10):909-912.
[7] Ward Fuller G, Hernandez M, Pallot D, et al. Health state preference weights for the Glasgow outcome scale following traumatic brain injury: a systematic review and mapping study[J]. Value Health, 2017,20(1):141-151.
[8] 肖杰文,李学伟,朱砺,等.促性腺激素释放激素受体的结构及其生物学功能[J].生理科学进展,2008,39(2):175-178.
[9] 王广,罗超,彭形状,等.脑出血与蛛网膜下腔出血后β-内啡肽和促性腺激素释放激素水平变化研究[J].中国全科医学,2017,20(6):673-677.
[10] Ciechanowska M, Lapot M, Mateusiak K, et al. The central effect of β-Endorphin and naloxone on the biosynthesis of GnRH and GnRH receptor (GnRHR) in the hypothalamic-pituitary unit of follicular-phase ewes[J]. Reprod Domest Anim, 2016,51(4):555-561.
[11] 李娟,唐朝亮,康芳,等.帕瑞昔布钠用于颅脑手术患者的镇痛效果及对血浆β-内啡肽的影响[J].临床麻醉学杂志,2012,28(6):537-539.
[12] Bedaiwy MA, Allaire C, Alfaraj S. Long-term medical management of endometriosis with dienogest and with a gonadotropin-releasing hormone agonist and add-back hormone therapy[J]. Fertil Steril, 2017,107(3):537-548.
Changes in levels of β-endorphin and GnRH in blood and cerebrospinal fluid of patients with acute intracerebral hemorrhage and its influence on the degree and prognosis of brain injury
SUNYong,YAOKaihua,LIZhifeng,LIUYongling
(QinghaiRedCrossHospital,Xining810000,China)
Objective To investigate the changes in levels of β-endorphin and gonadotropin releasing hormone (GnRH) in the blood and cerebrospinal fluid of patients with acute intracerebral hemorrhage (ICH) and its influence on the degree and prognosis of brain injury.Methods Eighty-nine patients with acute ICH were selected as the case group. According to the Scandinavian Stroke Scale (SSS) score, the patients in the case group were divided into the mild ICH group (SSS: 0-15,n=41), moderate ICH group (SSS: 16-30,n=28), and severe ICH group (SSS: 31-45,n=20). According to the Glasgow prognosis scale (GOS), the patients in the case group were divided into the good prognosis group (GOS: 4-5,n=63) and poor prognosis group (GOS: 1-3,n=26). The β-endorphin and GnRH levels in the blood and cerebrospinal fluid on day 1, 3, 7, 14, and 30 after admission were detected by the radioimmunoassay. Thirty patients without neurological diseases undergoing lumbar anesthesia were selected as the control group. Results The β-endorphin and GnRH levels in the blood and cerebrospinal fluid in the mild ICH group, moderate ICH group, and severe ICH group showed a decreasing trend with the gradual extension of admission time (P<0.05). The β-endorphin and GnRH levels in the blood and cerebrospinal fluid of the case group on day 1, 3, 7, and 14 after admission were higher than those of the control group, and the difference was statistically significant between groups of mild ICH group, moderate ICH group, and severe ICH group (bothP<0.05). On day 30 after admission, the β-endorphin and GnRH levels in the blood and cerebrospinal fluid of the moderate ICH group and severe ICH group were higher than those of the mild ICH group and control group, and those of the severe ICH group were higher than those of the moderate ICH group (bothP<0.05). The β-endorphin and GnRH levels in the blood and cerebrospinal fluid of the good prognosis group on day 1, 3, 7, 14, and 30 after admission were lower than those of the poor prognosis group, and the difference was statistically significant (bothP<0.05).Conclusion The β-endorphin and GnRH levels in the blood and cerebrospinal fluid of ICH patients increase, which can cause the severer brain injury and poorer prognosis.
brain injury; β-endorphin; gonadotropin releasing hormone; brain injury; prognosis
青海省卫生计生指导性基金资助项目(2015KRB02964)。
孙永(1975-),男, 副主任医师,主要研究方向为颅内创伤、高血压脑出血的基础及临床诊治。E-mail: sunyong245@163.com
10.3969/j.issn.1002-266X.2017.29.008
R743.3
A
1002-266X(2017)29-0026-04
2017-04-11)

