卵巢癌细胞自噬后4种miRNAs表达变化及miR-144对mTOR的靶向调控作用
盛红娜,王艳丽,吴璠,赵采云,李晶
(天津医科大学第二医院,天津300211)
·基础研究·
卵巢癌细胞自噬后4种miRNAs表达变化及miR-144对mTOR的靶向调控作用
盛红娜,王艳丽,吴璠,赵采云,李晶
(天津医科大学第二医院,天津300211)
目的 观察雷帕霉素诱导卵巢癌SKOV3细胞自噬后miR-18a、miR-19a、miR-21及miR-144表达的变化,并以miR-144为研究对象,验证其对自噬相关基因丝氨酸/苏氨酸蛋白激酶(mTOR)的靶向调控作用。方法 分别用50 ng/mL雷帕霉素(雷帕霉素组)及10 nmol/L 3-甲基腺嘌呤(3-MA组)作用于SKOV3细胞2、12 h,收集细胞,并设立不进行任何处理的细胞作为对照组,提取总RNA;应用实时荧光定量PCR(qRT-PCR)检测4种miRNAs的表达水平。培养SKOV3细胞,设立正常细胞组、miR-144 mimic组和miR-144 inhibitor组,分别将合成的miR-144 mimic及miR-144 inhibitor转染到SKOV3细胞内,正常细胞组不处理。应用qRT-PCR方法检测各组的miR-144及mTOR mRNA表达量,应用Western blotting法检测各组细胞中mTOR蛋白表达量。应用双荧光素酶报告系统验证miR-144与mTOR的相互作用关系。结果 对照组细胞miR-18a、miR-19a、miR-21及miR-144的表达量分别为1.003±0.021、1.001±0.039、1.014±0.016、1.028±0.037;雷帕霉素组4种miRNAs的表达量分别为6.310±0.025、1.200±0.058、52.310±0.005、63.490±0.024,其miR-18a、miR-21及miR-144高于对照组(P均<0.05);3-MA组SKOV-3细胞的4种miRNAs的表达量分别为0.540±0.019、0.890±0.062、0.820±0.012和0.660±0.003,其miR-18a及miR-144低于对照组(P均<0.05)。与正常细胞组比较,miR-144 mimic组miR-144 mRNA表达量高(P<0.05),mTOR mRNA和蛋白的表达量降低(P均<0.05);miR-144 inhibitor组miR-144表达量下降(P<0.05),mTOR mRNA和蛋白的表达量升高(P均<0.05)。miR-144 mimic分别与mTOR-WT及mTOR-Mut共转染,前者的荧光表达量低于后者(P均<0.05)。结论 SKOV3细胞发生自噬后,miR-18a、miR-21及miR-144表达升高, miR-144可靶向抑制mTOR的表达。
卵巢肿瘤;微小RNA-144;丝氨酸/苏氨酸蛋白激酶;细胞自噬
卵巢癌是目前最为常见的女性生殖系统三大恶性肿瘤,高于70%的患者确诊时已属晚期,是目前病死率最高的妇科肿瘤[1]。该病易转移、易复发,且对化疗易产生耐药,其疗效及远期预后较差,5年生存率仅为30%左右[2]。微小RNA(miRNA)是一类内源性的非编码小分子RNA,其主要在基因转录后水平对靶基因进行调控,影响众多重要的生物学过程。目前已证实miRNA与多种肿瘤的发病密切相关。自噬是一种高度保守的,可使溶酶体降解的生物学代谢过程,该过程主要通过吞噬自身细胞质蛋白或细胞器,并与溶酶体融合形成自噬溶酶体,进而降解其所包裹的内容物,使得某些肿瘤细胞凋亡或对抗自身环境来逃避凋亡[3]。自噬的发生离不开自噬相关蛋白的调控,主要蛋白包括:ATG5、ATG12、丝氨酸/苏氨酸蛋白激酶(mTOR)及Beclin1等。当机体细胞癌变后,多种自噬相关蛋白发生变化,直接或间接地影响肿瘤的发病过程。近年来,关于miRNAs对卵巢癌细胞自噬调控的研究逐渐增多,已被证实的对卵巢癌细胞自噬具有调控作用的miRNAs包括miR-30d、miR-29b及miR-152[4~6]。2016年1~10月,基于miRNA、自噬以及卵巢癌三者之间的相互作用关系,本课题应用雷帕霉素诱导自噬,同时应用3-甲基腺嘌吟(3-MA)抑制自噬,最终筛选出miR-144可能对卵巢癌的细胞自噬起着调控作用,通过一系列生物信息学试验,验证miR-144与潜在靶基因mTOR的相互作用关系,为进一步研究miR-144对卵巢癌细胞自噬的调控作用奠定理论依据,为卵巢癌的基因诊断及基因治疗提供实验基础。
1 材料与方法
1.1 材料 卵巢癌细胞株 SKOV3 购于中国科学院上海细胞库;质粒提取试剂盒及胶回收试剂盒购自天根生化技术有限公司;限制性内切酶购自大连宝生物技术有限公司;Western blotting所用一抗购自Abgent公司;双荧光素酶检测试剂盒及反转录试剂盒购自Promega公司;胎牛血清及DMEM高糖培养基购自美国Hyclone公司;雷帕霉素购自上海前尘生物科技公司;3-MA购自Sigma公司;miR-18a、miR-19a、miR-21、miR-144、mTOR及mTOR/mut引物由上海华大基因公司合成; miR-144 mimic/inhibitor引物序列由上海吉玛公司合成。
1.2 细胞培养及处理 应用10%胎牛血清的DMEM培养基,37 ℃、5%CO2及100%饱和湿度的培养箱培养SKOV3细胞。将培养好的细胞接种于12孔板培养瓶中,待细胞生长汇合至75%~85%时,分别进行以下处理:雷帕霉素50 ng/mL(雷帕霉素组)反应2 h、3-MA 10 nmol/L(3-MA组)反应12 h,对照组细胞不经过任何处理。
1.3 各组miRNAs表达量的检测 提取各组细胞中的RNA,应用茎环引物进行逆转录,茎环引物分别为:miR-18a:5′CTCAACTGGTGTCGTGGAGTCGG-CAATTCAGTTGAGCTATCTGCACTAGATG3′;miR-19a:5′CTCAACTGGTGTCGTGGAGTCGGCAATTCAGT-TGAGTCAGTTTTGCATA3′;miR-21:5′CTCAACTGGTGTCGTGGACTCGGCAATTCAGTTGAGTCAACATC3′;miR-144:5′CTCAACTGGTGTCGTGGACTCGGCAATTCAGTTGAGAGTACATC3′;应用qRT-PCR方法检测各组细胞内miRNAs的表达量,qRT-PCR特异性引物序列分别为:miR-18a:5′ACACTCCAGCTGGGTAAGGTGCATCTAGTGCAGA3′;miR-19a:5′ACACTCCAGCTGGGTGTGCAAATCTATGCAAAAC3′;miR-21:5′ACACTCCAGCTGGGTAGCTTATCAGACTGATG3′;miR-144:5′ACACTCCAGCTGGGTACAGTATACATGATGTACT3′)。以U6为对比内参,以2-ΔΔCt法计算目的基因表达量。
1.4 SKOV3细胞中miR-144、mTOR mRNA及mTOR蛋白表达的检测 培养SKOV3细胞,设立正常细胞组、miR-144 mimic和miR-144 inhibitor组:分别将合成的miR-144 mimic及miR-144 inhibitor转染到SKOV3细胞内,正常细胞组不处理。提取各组细胞的总RNA,逆转录后应用qRT-PCR方法检测各组miR-144及mTOR mRNA表达水平。试验重复3次。分别提取各组细胞的蛋白质,BCA法测定蛋白浓度,等量上样,应用Western blotting法检测各组细胞中mTOR的蛋白水平。
1.5 pMIR-Report载体构建与鉴定 应用TargetScan、miRanda等生物信息学软件进行miR-144的靶基因预测。选定mTOR作为预测靶基因,构建pMIR-Report-mTOR-3′UTR(mTOR-WT)及其突变(mTOR-Mut)的重组质粒,酶切及测序验证结果。
1.6 miR-144与靶基因mTOR 3′UTR的靶向作用验证 采用双荧光素酶报告基因检测系统。将NC/mTOR-WT、NC/mTOR-Mut及miR-144 mimic/mTOR-WT、miR-144 mimic/mTOR-Mut转染到HEK-293T细胞中,以海肾荧光素酶作为内参,转染48 h后,加入反应试剂,在荧光倒置显微镜下观察转染细胞的发光情况,于微孔板发光分析仪检测其活性,每组试验重复3次。
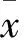
2 结果
2.1 三组SKOV3细胞4种miRNAs的表达水平比较 见表1。
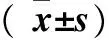
表1 各组SKOV3细胞miRNAs的表达水平比较
注:与对照组比较,*P<0.05。
2.2 三组miR-144 mRNA相对表达量比较 正常细胞组miR-144 mRNA表达量为1.01±0.022,miR-144 mimic组为6.9±0.012,miR-144 inhibitor组为0.24±0.003,三组间比较,P均<0.05。
2.3 三组mTOR mRNA及蛋白的相对表达量比较 正常细胞组的mTOR mRNA表达量为1.00±0.02, miR-144 mimic组为0.15±0.00,miR-144 inhibitor组为2.01±0.00。正常细胞组中mTOR蛋白表达水平为78.33±0.24, miR-144 mimic组为22.56±0.11,miR-144 inhibitor组为225.89±0.68。与正常细胞组比较,miR-144 mimic组mTOR mRNA及蛋白表达水平降低,miR-144 inhibitor组升高(P均<0.05)。
2.4 miR-144对靶基因mTOR 3′UTR的靶向作用 microRNA网络数据库显示,miR-144在mTOR mRNA的3′UTR上有碱基互补配对位点。NC/mTOR-WT的荧光表达量为54.10±0.23,NC/mTOR-Mut为57.2±0.31,二者相比,P>0.05;miR-144 mimic/mTOR-WT荧光表达量为9.88±0.07,miR-144 mimic/mTOR-Mut为56.10±0.19,两者比较,P<0.05。
3 讨论
mTOR是PI3k/Akt信号通路下游一个高度保守的调控分子,属于磷脂酰肌醇激酶相关激酶家族成员。其主要参与细胞的生长、细胞周期进程及蛋白质合成等生物学过程,可通过调控其下游的核糖体蛋白激酶活性,来影响自噬的发生。有研究者发现,当机体的癌症相关基因PTEN被敲除或持续性激活Akt基因后,mTOR可调控FOXP3的表达,抑制Treg的分化,干扰肿瘤发生[7];mTOR可促进起始蛋白翻译,诱导肿瘤增殖,通过作用于胰岛素样生长因子-1,使得E-钙黏附蛋白表达增多,从而促进卵巢癌细胞生长[8]。
miRNA是一类小分子RNA,其主要的生物学功能是通过与靶基因的3′UTR相互结合,导致基因表达受到影响。目前已有大量研究报道关于miRNAs与卵巢癌的相互作用关系,例如:在卵巢癌A2780细胞系及OV8细胞系中,miR-9的表达较正常组织相比明显异常,并证实miR-9通过影响E-钙黏蛋白的表达,干预卵巢癌上皮间质细胞的转化[9]。Zhao等[10]研究者发现,miR-203可通过抑制p53蛋白的表达,促进卵巢癌细胞的增殖与迁移;miR-203还可通过调控丙酮酸脱氢酶B,促进机体的糖酵解。Kleemann等[11]研究结果证实,miR-1912、miR-147b及miR-3073a在卵巢癌细胞系中表达异常,三种小分子可增强凋亡信号通路的活性,诱导促凋亡分子Bak1及Bax的表达;同时影响抑制凋亡的相关基因,如Bcl-2及Bcl-xL的表达。针对卵巢癌药物敏感性的研究中,发现miR-100通过抑制mTOR及PLK1基因的表达,抑制肿瘤细胞增殖、影响细胞周期,且可促进肿瘤细胞凋亡[12]。
本研究结果显示,经雷帕霉素处理后的SKOV3细胞中miR-144的表达明显上调,说明miR-144可能对SKOV3细胞的自噬过程存在潜在的调控作用。通过转染miR-144 mimic,使得细胞内miR-144呈过表达状态,此时细胞内mTOR mRNA及蛋白质的表达水平明显降低;而转染了miR-144 inhibitor后,miR-144的表达减少的同时,mTOR mRNA和蛋白质的表达水平有所升高;说明miR-144的表达水平明显影响了mTOR的表达。双荧光素酶报告基因检测结果显示,miR-144与mTOR-WT共转染后,荧光表达量明显降低,而将miR-144 mimic同mTOR-Mut相结合,荧光表达量无明显变化,此实验结果进一步说明, miR-144与mTOR具有靶向作用关系。因此,miR-144很可能通过靶向抑制mTOR的表达水平来影响卵巢癌细胞的自噬过程。该实验结果为诊断和预防卵巢癌的标志物研究提供了新的靶点,为治疗卵巢癌的药物研究开拓新的思路。
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics[J]. CA Cancer J Clin, 2016,66(1):7-30.
[2] Denny L, Quinn M. FIGO cancer report 2015[J]. Int J Gynaecol Ohstet, 2015,131(2):75-80.
[3] Shintani T, Klionsky DJ. Autophagy in health and disease: a doubledged sword[J]. Science, 2004,306(5688):990-995.
[4] Yang X, Zhong X, Tanyi JL, et al. miR-30d regulates multiple genes in the autophagy pathway and impairs autophagy process in human cancer cell[J]. Biochem Biophys Res Commun, 2013,431(3): 617-622.
[5] Dai F, Zhang Y, Chen Y. Involvement of miR-29b signaling in the sensitivity to chemotherapy in patients with ovarian carcinoma[J]. Hum Pathol, 2014,45(6):1285-1293.
[6] He J, Yu JJ, Xu Q, et al. Downregulation of ATG14 by EGR1-MIR152 sensitizes ovarian cancer cells to cisplatin-induced apoptosis by inhibiting cyto-protective autophagy[J]. Autophagy, 2015,11(2):373-384.
[7] Liu C, Chapman NM, Karmaus PW, et al. mTOR and metabolic regulation of conventional and regulatory T cells[J]. J Leukoc Biol, 2015,97(5):837-847.
[8] Lau MT, Leung PC. The PI3K/Akt/mTOR signaling pathway mediates insulin-like growth factor 1-induced E-cadherin down-regulation and cell proliferation in ovarian cancer cells[J]. Cancer Lett, 2012,326(2):191-198.
[9] Yanaihara N, Noguchi Y, Saito T, et al. MicroRNA gene expression signature driven by miR-9 overexpression in ovarian clear cell carcinoma[J]. PLoS One, 2016,11(9):1371-1380.
[10] Xiaohong Z, Lchun F, Na X, et al. MiR-203 promotes the growth and migration of ovarian cancer cells by enhancing glycolytic pathway[J]. Tumour Biol, 2016,9(21):1007-1015.
[11] Kleemann M, Bereuther J, Fischer S, et al. Investigation on tissue specific effects of pro-apoptotic micro RNAs revealed miR-147b as a potential biomarker in ovarian cancer prognosis[J]. Oncotarget, 2016,11(4):1-19.
[12] Guo P, Xiong X, Zhang S, et al. miR-100 resensitizes resistant epithelial ovarian cancer to cisplatin[J]. Oncol Rep, 2016,10(3):3552-3558.
10.3969/j.issn.1002-266X.2017.29.009
R711.75
A
1002-266X(2017)29-0030-03
2017-03-02)
——雷帕霉素

