大鼠CD90+Lin-骨髓细胞诱导分化为肝细胞过程中Klf4、Nanog基因的表达及启动子区甲基化观察
刘钦成,张梓朗,潘润华,刘宁,韩晓玉,郭凌宏,王春明,廖彩仙
(南方医科大学南方医院,广州 510515)
大鼠CD90+Lin-骨髓细胞诱导分化为肝细胞过程中Klf4、Nanog基因的表达及启动子区甲基化观察
刘钦成,张梓朗,潘润华,刘宁,韩晓玉,郭凌宏,王春明,廖彩仙
(南方医科大学南方医院,广州 510515)
目的 观察大鼠CD90+Lin-骨髓细胞诱导分化为肝细胞过程中Klf4、Nanog基因表达及启动子区CpG位点的甲基化变化。方法 大鼠CD90+Lin-骨髓细胞在体外用25 μg/L重组人肝细胞生长因子和0.1 nmol/L地塞米松诱导其分化,在诱导第0、7、14天分别提取细胞DNA和RNA。采用实时荧光定量PCR法检测Klf4、Nanog基因mRNA,甲基化特异性PCR法观察Klf4、Nanog基因启动子区CpG位点甲基化。结果 与诱导第0天比较,第7、14天Klf4 mRNA相对表达量降低(P均<0.05);与诱导第0天比较,第7、14天Nanog mRNA相对表达量均降低(P均<0.05)。与诱导第0天比较,诱导第7天Klf4启动子区第1、2个CpG位点甲基化频率升高(P均<0.05);与诱导第7天比较,诱导第14天Klf4启动子区第1个CpG位点甲基化频率升高,第2、3个CpG位点甲基化频率降低,P均<0.05。与诱导第0天比较,诱导第7天Nanog启动子区第1个CpG位点甲基化频率降低,第2个CpG位点甲基化频率升高,P均<0.05;与诱导第7天比较,诱导第14天Nanog启动子区第1个CpG位点甲基化频率升高,第2个CpG位点甲基化频率降低,P均<0.05。结论 大鼠CD90+Lin-骨髓细胞在体外诱导向肝细胞分化过程中,Klf4、Nanog基因表达随诱导时间增加呈现先下降后回升趋势,两者启动子区CpG位点甲基化程度随诱导时间增加出现不同程度变化;Klf4和Nanog基因启动子区CpG位点的甲基化变化不仅会影响Klf4、Nanog基因的表达,而且起到重要的调控作用。
骨髓间充质干细胞;CD90+Lin-骨髓细胞;Nanog基因;Klf4基因
CD90+Lin-骨髓细胞具有分化形成肝细胞的潜能已得到实验研究和临床试验证实[1,2],但其向肝细胞分化的表观遗传学调控机制尚不清楚。本课题组潘润华等[3]曾对大鼠骨髓间充质干细胞在体外诱导向肝细胞分化过程中OCT4基因表达及其启动子区甲基化变化进行观察,发现OCT4表达量和启动子区甲基化频率随分化进程不同而变化。而Oct4与Klf4、Nanog等是一组多潜能性基因,在维持干细胞的多能性方面均起着重要作用[4,5]。本研究观察了大鼠CD90+Lin-骨髓细胞诱导分化为肝细胞过程中Klf4、Nanog基因表达及其启动子区甲基化变化,以期从多角度认识骨髓间充质干细胞向肝细胞分化的表观遗传学调控机制。
1 材料与方法
1.1 主要试剂 高糖DMEM F12培养基(美国Hyclone公司);澳洲特级胎牛血清(以色列BioInd 公司);青霉素-链霉素(美国Gibco公司);0.25%胰酶-EDTA(美国Gibco公司);重组人肝细胞生长因子(美国Peprotech公司);EpiTect Bisulfite Kit(德国Qiagen公司);TaKaRa EpiTaq HS(Takara公司);Biospin细胞基因组DNA提取试剂盒(杭州博日科技公司);Gel Extraction胶回收试剂盒(Omega公司);Glodview(广州展晨生物科技公司);RNasin特异性核糖核酸酶抑制剂(Promega公司);DL 2 000 bp Marker(Takara公司);TRIzol RNA提取试剂(Takara公司);Diethy pyrocarbonate;DEPC(Sigma公司);RT-PCR试剂(DBI公司);逆转录试剂盒(DBI公司)。
1.2 大鼠CD90+Lin-骨髓细胞培养、诱导分化 ①细胞培养:参照课题中黎冠宏等[4]方法获得大鼠CD90+Lin-骨髓细胞,并将新鲜制备的细胞置于液氮中保存备用。②冻存细胞复苏与培养:冻存的大鼠 CD90+Lin-骨髓细胞复苏后,将其置于37 ℃含5%CO2孵箱中培养,培养液为高糖培养液(高糖DMEM F12培养基+10%胎牛血清+青霉素-链霉素),3 d换液1次,细胞生长到约80%时用0.25%胰酶-EDTA消化传代。③细胞诱导分化:诱导分化采用课题组中潘润华等[3]报道的方案。把细胞培养至第三代的良好细胞,置入培养液(高糖DMEM F12培养基+10%胎牛血清+青霉素-链霉素+25 μg/L重组人肝细胞生长因子+0.1 nmol/L地塞米松)中进行诱导分化,3 d换液1次,连续诱导14 d。在第0、7、14天用显微镜记录细胞形态,同时取未诱导的细胞作为对照。
1.3 大鼠CD90+Lin-骨髓细胞Klf4、Nanog基因mRNA检测方法 采用荧光定量PCR法。按照RNA提取试剂盒方法(TRIzol+氯仿+异丙醇提取法)从培养至第0、7、14天的大鼠CD90+Lin-骨髓细胞中提取总RNA。把1 μg的总RNA作为模板,逆转录反应体系依照荧光定量PCR试剂说明书所配制,合成cDNA的第一链。定量荧光PCR扩增反应体系:PCR Forward Primer(10 μM)0.5 μL、Bestar®SybrGreen qPCRmasterMix 10 μL、cDNA模板1 μL、PCR Reverse Primer 0.5 μL、ddH2O 8 μL,一共20 μL。使用美国安捷伦Mx3000P荧光定量PCR仪进行实验。反应条件:94 ℃预变性2 min,94 ℃变性20 s,58 ℃退火20 s,72 ℃延伸20 s,共40个循环反应。PCR结果则依照2-ΔΔCt相对定量法计算,ΔCt=目的基因Ct-内参基因Ct;ΔΔCt=实验组的目的基因ΔCt-参照组的目的基因ΔCt;相对样品初始模板量=2-ΔΔCt。GAPDH为内参基因,GAPDH上游引物:5′-CCTCGTCTCATAGACAAGATGGT-3′,下游引物:5′-GGGTAGAGTCATACTGGAACATG-3′,片段长度为169 bp;Klf4上游引物:5′-GGAGACCGAGGAGTTCAACGAT-3′,下游引物:5′-AGGATGAAGCTGACGCCGAG-3′,片段长度为113 bp;Nanog上游引物:5′-AACGCTGCTCCGCTCCATAA-3′,下游引物:5′-GGCTTCCAAATTCGCCTCCAAA-3′,片段长度为102 bp。
1.4 大鼠CD90+Lin-骨髓细胞Klf4、Nanog基因启动子区CpG位点甲基化观察方法 ①DNA提取及甲基化修饰:按照细胞基因组DNA提取试剂盒说明书,从诱导第0、7、14天大鼠CD90+Lin-骨髓细胞中提取基因组DNA。然后使用EpiTect Bisulfite Kit试剂盒,按照说明将试剂添加在200 μL的PCR管中建立亚硫酸氢纳反应体系,使用PCR仪进行热循环将样本DNA亚硫酸氢盐修饰化。热循环条件:95 ℃变性5 min,60 ℃孵化25 min,95 ℃变性5 min,60 ℃孵化85 min,95 ℃变性5 min,60 ℃孵化175 min,20 ℃保持冷却。修饰纯化后的DNA置于-80 ℃条件下保存。②引物选取及PCR扩增:选取Klf4、Nanog基因转录起始位点上游+1~-1 500 bp附近的启动子区,分别含3个和2个CpG位点。Klf4、Nanog的引物设计均由上海生工生物技术有限公司所合成,其甲基化引物信息如下:Nanog-MF1:5′-AGTTGGTAGTTGAGAGGATAATTAC-3′,5′-Nanog-MR1:TAAACATTCTAAATAATTCCTCTAT-3′;Nanog-MF2:5′-TGAATTAGTAGTTTTTATTTTATTC-3′,Nanog-MR2:5′TACTAAACTCCTCACTAACACTAAA-3′;Klf4-MF1:5′-ATTAATATAGGTTTTAGGATTTCGG-3′,Klf4-MR1:5′-AACAACGTATACGTATACACTCGTT-3′;Klf4-MF2:5′-ATTTCGGGATTTAAATAGGTGAAAC-3′,Klf4-MR2:5′-ACTAATTAATGCTCCAGCCCAAACA-3′;Klf4-MF3:5′-TTAAATAGGTGAAACGATAGAGGAC-3′,Klf4-MR3:5′-TCACGATTAAACCCCCTAACTAAAA-3′。在0.2 mL PCR反应管中配制目的基因PCR扩增体系25 μL:TaKaRa EpiTaq HS 0.25 μL、10×EpiTaq PCR Buffer(Mg2+free) 2.5 μL、dNTP Mix 3 μL、MgCl22.5 μL、上游引物1 μL、下游引物1 μL、甲基化修饰纯化后DNA 1 μL、ddH2O 18.25 μL。反应条件为:94 ℃预变性5 min,98 ℃变性10 s,51~61 ℃退火30 s(具体温度由引物决定),72 ℃延伸30 s,如此共循环30次。72 ℃延伸5 min,冷却至4 ℃保存。取5 μL PCR的产物来行1%琼脂糖凝胶电泳。

2 结果
2.1 大鼠 CD90+Lin-骨髓细胞的培养和诱导分化 复苏后的细胞分布均匀,形态均一,呈椭圆形。48 h后贴壁生长,呈长梭形,集落呈漩涡状。细胞形态在诱导分化过程中逐渐变圆,至第14天时,细胞呈饱满圆形。
2.2 大鼠 CD90+Lin-骨髓细胞Klf4、Nanog基因mRNA相对表达量比较 诱导第0、7、14天Klf4 mRNA相对表达量分别为1.00±0.04、0.31±0.01、0.94±0.01,Nanog mRNA相对表达量分别为0.94±0.08、0.46±0.04、0.57±0.04,第0天、第7天比较,第7天、第14天比较,P均<0.05。
2.3 大鼠CD90+Lin-骨髓细胞Klf4启动子区CpG位点甲基化频率比较 结果见表1。
2.4 大鼠CD90+Lin-骨髓细胞Nanog启动子区CpG位点甲基化频率比较 结果见表2。
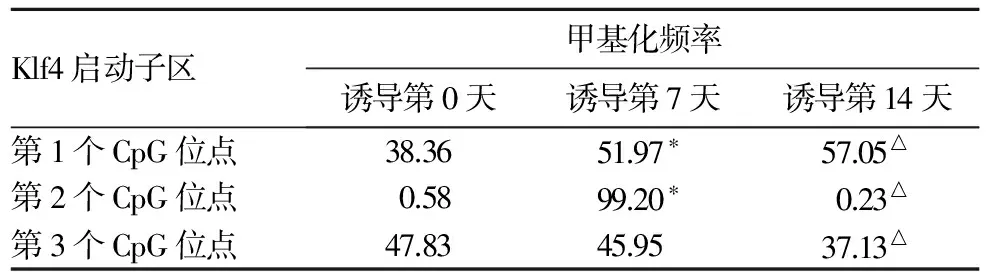
表1 大鼠CD90+Lin-骨髓细胞Klf4启动子区CpG位点甲基化频率比较(%)
注:与诱导第0天比较,*P<0.05;与诱导第7天比较,△P<0.05。
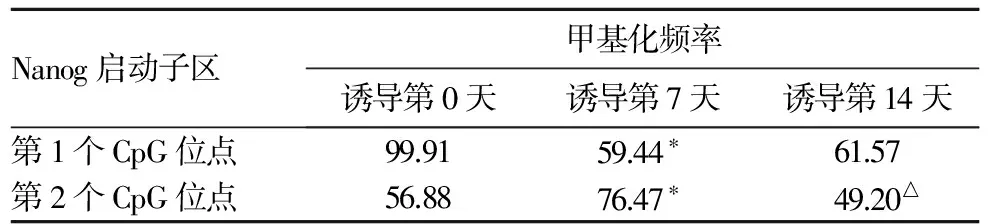
表2 大鼠CD90+Lin-骨髓细胞Nanog启动子区CpG位点甲基化频率比较(%)
注:与诱导第0天比较,*P<0.05;与诱导第7天比较,△P<0.05。
3 讨论
Klf4和Nanog在干细胞分化、增殖、维持自我更新和维持多能性等方面起重要作用,但两者的作用又不完全相同。Klf4参与调节Wnt[6]、Notch[7]、TGF-β[8]等多种重要信号通路,在干细胞分化中起重要作用。Takahashi等[9]运用Klf4协同Oct4、Sox2及c-Myc转录因子,成功将小鼠胚胎和成体成纤维细胞转化为诱导性多能干细胞。有研究[4]表明,Klf4可结合于Lefty1启动子并促进Lefty1基因表达,从而促进Oct4及Sox2干细胞性因子的表达。Klf4还可调控p21的表达,在细胞周期中阻止G1/S期的进程以至于达到调控细胞增殖[10,11]。Klf4处于STAT3通路的下游,该通路激活后可上调Klf4的表达,达到促进干细胞自我更新的目的[12]。Nanog在胚胎干细胞中,有着维持自我更新以及多能性的功能,同时也是干细胞自我更新、增殖并保持其分化潜能所必需的[13]。Yu等[14]用Nanog、Oct4、Sox2、Lin28共4种多能性因子成功使人体细胞诱导成为多能性干细胞,充分表明了Nanog在干细胞多能性调控网络中的地位。关于Nanog自我更新的机制,研究[15]表明其可通过调节下游靶向基因gata6、gata4来维持干细胞自我更新。
在多能性基因调控网络中,Klf4和Nanog又是有联系的。例如Klf4先与Oct4、Sox2结合,形成Oct4/Sox2/Klf4复合体,然后复合体再结合于Nanog基因启动子区并促进其转录[16]。在胚胎干细胞中,Klf4不仅可以联合PBX1直接作用于Nanog基因启动子区,调节其表达[17]。而且Klf4还可以通过直接抑制p53的表达,从而间接调控了Nanog基因表达[18]。但在成体干细胞的横向分化过程,Klf4和Nanog的调控作用和调控机理均未完全明了。
本研究显示,诱导第0、7、14天,Klf4、Nanog mRNA相对表达量先下降后回升。牛朝诗等[19]发现,在胶质瘤干细胞中Nanog基因启动子区呈低甲基化状态,Nanog表达量明显上调;而袁旦平等[20]发现,结肠癌组织的Klf4基因启动子区明显较正常癌旁组织甲基化程度高,结肠癌组织Klf4的表达量明显下降。上述两者研究对象均为肿瘤细胞,而本文则是针对大鼠CD90+Lin-骨髓细胞向肝细胞分化的过程中Klf4和Nanog的变化,结果显示最终两者表达量均较原始有所下降,这表明成熟肝细胞多能性下降。但是在此过程中两者表达量并非呈现单方向线性下降,单方向仅上调或下降Klf4、Nanog的表达可能会导致细胞像上述肿瘤细胞方向发展。
DNA甲基化是表观遗传学主要的修饰方式之一,基因启动子区的甲基化变化是调控基因表达的一个重要方式。DNA甲基化是在DNA甲基转移酶的催化下,在CpG二核苷酸5′端胞嘧啶第5位碳原子插入一个甲基集团,使之转变为5-甲基胞嘧啶的反应。本文结果显示,与诱导第0天比较,诱导第7天Klf4启动子区第1、2个CpG位点甲基化频率升高;与诱导第7天比较,诱导第14天Klf4启动子区第1个CpG位点甲基化频率升高,第2、3个CpG位点甲基化频率降低。与诱导第0天比较,诱导第7天Nanog启动子区第1个CpG位点甲基化频率降低,第2个CpG位点甲基化频率升高;与诱导第7天比较,诱导第14天Nanog启动子区第1个CpG位点甲基化频率升高,第2个CpG位点甲基化频率降低。上述结果提示,Klf4、Nanog基因启动子区CpG位点的甲基化变化不仅会影响Klf4、Nanog的表达,还可能会影响到其他与分化有关基因的表达,在体外诱导大鼠CD90+Lin-骨髓细胞向肝细胞分化过程中很可能起重要的调控作用。
[1] Liao X, Ancheng JY, Zhou QJ, et al. Therapeutic effect of autologous bone marrow-derived liver stem cells transplantation in hepatitis B virus-induced liver cirrhosis[J]. Hepatogastroenterology, 2013,60(123):406-409.
[2] 秦安成,廖彩仙,王宇,等.自体骨髓源性肝干细胞移植治疗肝炎后肝硬化的临床研究[J].南方医科大学学报,2010,30(3):529-531.
[3] 潘润华,阿斯楞,张茂,等.焦磷酸测序法检测OCT4启动子在大鼠骨髓源性肝干细胞分化中的甲基化变化[J].生命科学研究,2016,20(2):113-118.
[4] 黎冠宏,王薇,李继业,等.H3K27me2 在大鼠骨髓源性肝干细胞分化过程中的变化[J].山东大学学报(医学版),2014,52(6):28-32.
[5] Li Y, McClintick J, Zhong L, et al. Murine embryonic stem cell differentiation is promoted by socs-3 and inhibited by the zinc finger transcription factor Klf4[J]. Blood, 2005,105(2):635-637.
[6] Zhang W, Chen X, Kato Y, et al. Novel cross talk of Krüppel-like factor 4 and beta-catenin regulates normal intestinal homeostasis and tumor repression[J]. Mol Cell Biot, 2006,26(6):2055-2064.
[7] Zheng H, Pritchard DM, Yang X, et al. KLF4 gene expression is inhibited by the notch signaling pathway that controls goblet cell differentiation in mouse gastronintestinal tract[J]. Am J Physiol Gastrointst Liver Physiol, 2009,296(3):490-498.
[8] Li HX, Han M, Bernier M, et al. Krüppel-like factor 4 promotes differentiation by transforming growth factor-beta receptor-mediated Smad and P38 MAPK signaling in vascular smooth muscle cells[J]. J Biol Chem, 2010,285(23):17846-17856.
[9] Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J]. Cell, 2006,126(4):663-676.
[10] Chen X, Johns DC, Geiman DE, et al.Krüppel-like factor 4(gut-enriched Krüppel-like factor) inhibits cell proliferation by blocking G1/S progression of the cell cycle[J]. J Biol Chem, 2001,276(32):30423-30428.
[11] Shie JL, Chen ZY, Fu M, et al. Gut-enriched Krüppel-like factor repress cyclin D1 promoter activity through Sp1 motif[J]. Nucleic Acids Res, 2000,28(15):2969-2976.
[12] Hall J, Guo G, Wray J, et al. Oct4 and LIF/Stat3 additively induce Krüppel factors to sustain embryonic stem cell self-renewal[J]. Cell Stem Cell, 2009,5(6):597-609.
[13] Mitsui K, Tokuzawa Y, Itoh H, et al. The homeoprotein Nanog is required for maintenance of pluripotency in mouse epiblast and ES cells[J]. Cell, 2003,113(5):631-642.
[14] Yu J, Vodyanik MA, Smuga-Otto K, et al. Induced pluri potent stem cell lines derived from human somatic cells[J]. Science, 2007,318(5858):1917-1920.
[15] Zhong XM, Jin Y. Critical roles of coactivator p300 in mouse embryonic stem cell differentiation and Nanog expression[J]. J Biol Chem, 2009,284(14):9168-9175.
[16] Lee S, Wottrich S, Bonavida B. Crosstalks between Raf-kinase inhibitor protein and cancer stem cell transcription factors (Oct4, KLF4, Sox2, Nanog)[J]. Tumour Biol, 2017,39(4):1010428317692253.
[17] Chan KK, Zhang J, Chia NY, et al. KLF4 and PBX1 directly regulate NANOG expression in human embryonic stem cells[J]. Stem Cells, 2009,27(9):2114-2125.
[18] Choi MR, In YH, Park J, et al. Genome-scale DNA methylation pattern profling of human bone marrow mesenchymal stem cells in long-term culture[J]. Exp Mol Med, 2012,44(8):503-512.
[19] 汪炎,牛朝诗,李仲颖,等.胶质瘤干细胞中Nanog基因启动子区甲基化检测及意义[J].中华神经外科疾病研究杂志,2014,13(5):389-393.
[20] 曹跃鹏,庞红双,陈成,等.结肠癌组织KLF4基因启动子甲基化状态及其临床意义[J].现代实用医学,2015,27(11):1448-1450.
Expression of Klf4 and Nanog and their promoter methylation during differentiation of rat bone marrow CD90+Lin-cells to hepatocytes
LIUQincheng,ZHANGZilang,PANRunhua,LIUNing,HANXiaoyu,GUOLinghong,WANGChunming,LIAOCaixian
(NanfangHospitalofSouthernMedicalUniversity,Guangzhou510515,China)
Objective To observe the expression of Klf4 and Nanog and the promoter region CpG site methylation changes during differentiation of rat bone marrow CD90+Lin-cells to hepatocytes. Methods Rat bone marrow CD90+Lin-cells were induced in vitro by 25 μg/L recombinant human hepatocyte growth factor and 0.1 nmol/L dexamethasone. DNA and RNA were extracted from cells on day 0, 7, and 14 of induction. Real-time fluorescent quantitative PCR was used to detect Klf4 and Nanog mRNA expression. Methylation Specific PCR was performed to detect methylation variation of CpG sites in Klf4 and Nanog promoters. Results Compared with the day 0, the relative expression of Klf4 mRNA decreased on day 7 and day 14 (P<0.05); compared with the day 0, the relative expression of Nanog mRNA decreased on day 7 and day 14 (P<0.05). Compared with the day 0, the methylation frequency of the first and second CpG sites in Klf4 promoter increased on day 7 (P<0.05); compared with the day 7, the methylation frequency of the first CpG site in Klf4 promoter increased on day 14, while the second and third CpG sites in Klf4 promoter decreased (P<0.05). Compared with the day 0, the methylation frequency of the first site in Nanog promoter decreased in day 7, while the second sites in Nanog promoter increased (P<0.05); compared with the day 7, the methylation frequency of the first CpG site in Nanog promoter increased on day 14, while the second CpG site in Nanog promoter decreased (P<0.05).Conclusions During differentiation of rat bone marrow CD90+Lin-cells to hepatocytes in vitro, the expression of Klf4 and Nanog first increases and then decreases as time passes, and the CpG sites methylated degrees of both promoters vary as time passes. The methylation of CpG site in the promoter region of Klf4 and Nanog not only affects the expression of Klf4 and Nanog, but also plays an important regulatory role.
bone marrow mesenchymal stem cells; bone marrow CD90+Lin-cells; Nanog gene; Klf4 gene
广东省科技计划项目(2010B080701069)。
刘钦成(1992-),男,在读硕士,主要研究方向为肝和肝干细胞移植。E-mail: 276309233@qq.com
廖彩仙(1960-),男,教授,主任医师,博士生导师,主要研究方向为肝和肝干细胞移植。E-mail: liaocx@fimmu.com
10.3969/j.issn.1002-266X.2017.31.004
R394.2
A
1002-266X(2017)31-0013-04
2017-06-13)

