四株解磷菌分泌有机酸与溶解磷酸三钙能力的研究
刘胜亮,朱舒亮,祁先慧,李晓原,张富玮,杨文英,李建贵,3
(1.新疆农业大学林业研究所,乌鲁木齐 830052;2.新疆农业大学/新疆红枣工程技术研究中心,乌鲁木齐 830052;3.新疆农业大学2612团队,乌鲁木齐 830052)
四株解磷菌分泌有机酸与溶解磷酸三钙能力的研究
刘胜亮1,2,朱舒亮1,2,祁先慧1,2,李晓原1,张富玮1,杨文英1,李建贵1,2,3
(1.新疆农业大学林业研究所,乌鲁木齐 830052;2.新疆农业大学/新疆红枣工程技术研究中心,乌鲁木齐 830052;3.新疆农业大学2612团队,乌鲁木齐 830052)
【目的】研究解磷细菌溶解难溶性磷酸盐及溶磷过程中有机酸的作用。【方法】对P7、P13、P15、P18四株解磷菌进行培养,并对其进行动态观测,用高效液相色谱法测定其有机酸种类及含量,研究其解磷量与有机酸之间的关系。【结果】4株解磷菌溶解磷酸三钙能力有显著差异,解磷能力大小依次是P15>P13>P18>P7。4株解磷菌产生有机酸的含量差异很大,并且同一株解磷菌在培养过程中产生的有机酸种类也会不同。经分析发现有机酸对速效磷的直接影响由强至弱排序依次是:丙酮酸、酒石酸、乳酸、乙酸、草酸。【结论】解磷能力最强的是P15菌株,丙酮酸对溶解磷酸三钙的直接影响系数最大。
解磷微生物;酸解作用;有机酸
0 引 言
【研究意义】磷是植物生命过程不可或缺的矿物质元素之一,在植物的生长发育和生理代谢活动中起着重要作用[1]。土壤中的磷大约有95%是植物难以直接吸收利用的无效磷,可溶性的磷在被施入土壤后大部分也迅速转化为植物难以利用的磷酸盐,因此提高土壤中磷素的利用效率,对于促进植物生长发育具有重要意义[2]。【前人研究进展】土壤中存在一些微生物,可通过新陈代谢将难溶的磷酸盐转化为植物可以吸收利用的形态,增加土壤中有效磷含量,促进作物生长[3]。相关研究发现,一些微生物可以产生有机酸来溶解土壤中难以被吸收利用的磷酸盐,或者通过有机酸的螯合作用使难以被植物吸收利用的磷酸盐溶解。伊鋆等[4]对解磷菌株PSB28解磷机理进行了研究,经高效液相色谱测定结果发现,有机酸种类和含量都发生了显著变化,因此判断该菌株解磷的主要原因是有机酸的螯合作用。钟传青等[5]研究发现解磷细菌能够产生柠檬酸、琥珀酸、乳酸以及乙酸等有机酸,这些有机酸可能与磷矿粉中的金属离子发生螯合作用产生溶磷效果。王同等[6]在研究红壤溶磷菌的筛选及溶磷机制时发现,目标菌株B1主要分泌草酸和苹果酸,通过添加有机酸对磷酸铝活化的对比试验表明,分泌有机酸溶磷仅是菌株B1溶磷机制之一。潘虹等[7]在研究石灰性土壤解磷细菌时发现,草酸是高螯合活性的有机酸,适合于溶解石灰性土壤中的难溶性无机磷。王法威等[8]的研究发现A9解磷细菌通过分泌有机酸来溶解土壤无机磷。Whitelaw等[9]研究发现解磷细菌在溶解磷酸盐时产生大量有机酸,其中葡萄糖酸含量最高,葡萄糖酸通过降低pH值,进而溶解难溶性磷以及与A13+螯合释放磷酸根。【本研究切入点】研究四种不同解磷微生物菌株产生有机酸及不同有机酸溶解磷酸三钙的能力。【拟解决的关键问题】对解磷细菌溶解难溶性磷酸盐的溶解作用及溶磷过程中有机酸的作用进行进一步的解释。
1 材料与方法
1.1 材 料
供试菌株为新疆农业大学林业研究所微生物试验室分离保存的高效解磷细菌:P7(Bacillussp.)、P13(Acinetobactersp.)、P15(Acinetobactersp.)、P18(Enternhactersp.)
供试菌株活化采用牛肉膏蛋白胨培养基:牛肉膏3.0 g,NaCl 5.0 g,蛋白胨10.0 g,pH 7.0~7.2,蒸馏水1 000 mL。
菌株解磷能力测定采用无机磷基础培养基:葡萄糖10.0 g,(NH4)2SO40.5 g,NaCl 0.3 g,KCl 0.3 g,MgSO40.3 g,FeSO40.03 g,MnSO41.0 g,Ca3(PO4)25.0 g,蒸馏水1 000 mL,pH 7.0~7.5。研究发现石灰性土壤中磷素以磷酸钙型磷占全磷比例最大,而新疆土壤以石灰性土壤为主,所以试验选择磷酸三钙为磷源进行研究[10]。
1.2 方 法
1.2.1 菌液制备和培养
种子液的制备:将用300 μg/mL利福平标记过的P7、P13、P15、P18抗利福平菌株接种于盛有250 mL牛肉膏蛋白胨培养基的三角瓶中,在180 r/min,30℃的环境中摇床培养48 h。待细菌生长充分后,用无菌水调节各种子液浓度至1×108cfu/mL。
菌液培养:向250 mL三角瓶中加入100 mL无机磷基础培养基,在高温灭菌锅中灭菌,冷却至室温静置1 d。分别将2 mL含有P7、P13、P15、P18解磷菌的种子悬液接种到无机磷培养基中,同时设不接种对照(CK),180 r/min,30℃摇床培养8 d。每个处理三次重复。
1.2.2 菌液中pH、可溶性磷和活菌数的测定
pH的测定:每隔48 h在超净工作台的无菌环境中从培养液中吸取4 mL发酵液,在4℃、6 000 r/min条件下离心10 min,取上清液使用pH计测定菌液pH值,每个样品重复三次。
可溶性磷的测定:取上述条件下离心的上清液0.1 mL,加入4.9 m蒸馏水,然后加入0.2 mL 10%VC溶液,30 s后再加入0.4 mL钼锑抗存储液,并以蒸馏水定容至10 mL,摇匀,放置15 min后,于660 nm处比色,计算可溶性磷含量,测量时每个样品重复三次。
活菌数的测定:取1 mL菌液用平板涂布法测定细菌活菌数,每个梯度三次重复。
1.2.3 菌液中有机酸种类和含量的测定
自培养开始,分别在0、48、96、144和192 h取菌液1 mL,在4℃、6 000 r/min条件下离心10 min,再经0.22 μm滤膜真空抽滤后,用高效液相色谱测定菌液有机酸。分离条件:采用U3000液相色谱仪和C18色谱柱 (250 mm×4.6 mm,5 pm),柱温为30℃,流动相为0.02 mol/L KH2PO4缓冲溶液一甲醇溶液(99∶1,用1 mol/L磷酸调节pH至2.60,紫外检测波长210 nm,进样量20 μL,流速0.5 mL/min,测定有机酸的种类和含量在不同时间的变化情况,每个样品三次重复。
1.3 数据处理
试验数据采用Spss19.0和Excel2003进行处理。
2 结果与分析
2.1 不同处理对菌液pH、解磷能力以及菌体生长状况的影响
2.1.1 摇瓶培养过程中菌株生长动态
将接种P7、P13、P15、P18接种到无机磷基础培养基进行培养,CK不作处理,每2 d进行计数,其结果显示,4种菌株在接种种子液后开始快速繁殖,在6 d时活菌数普遍达到较高水平,之后活菌数呈现缓慢下降态势,8 d时活菌数普遍低于6 d的活菌数。P15菌株虽然也在6 d达到较高水平,但是其在前4 d生长较其他菌株慢,且后期下降速度比其他菌株快,P15菌株对环境更加敏感。表1
表1 4种菌株摇瓶培养后活菌计数
Table 1 Four kinds of bacteria count
Table after shake flask culture
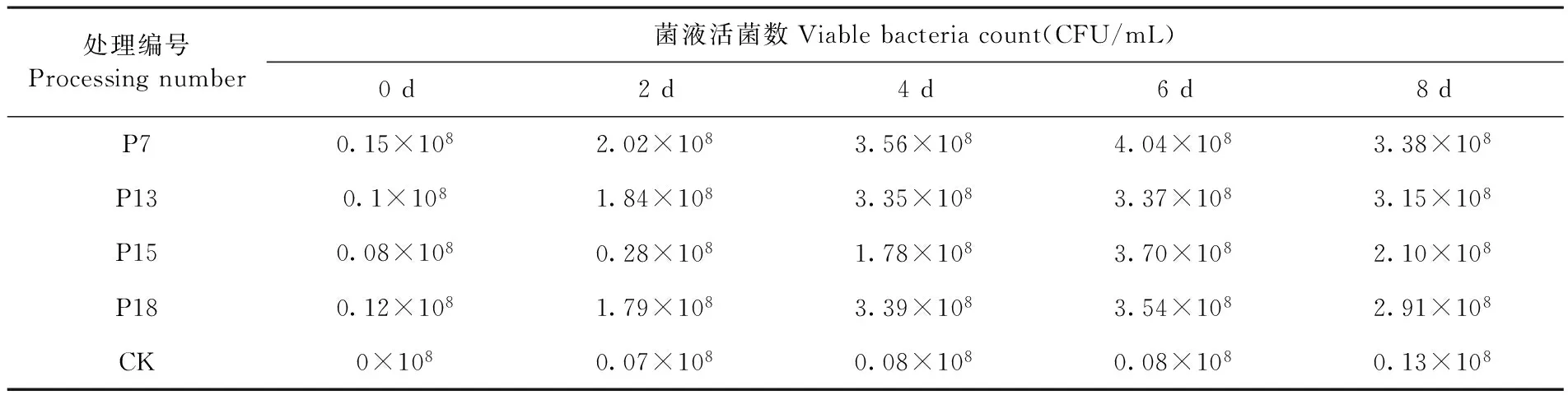
处理编号Processingnumber菌液活菌数Viablebacteriacount(CFU/mL)0d2d4d6d8dP70.15×1082.02×1083.56×1084.04×1083.38×108P130.1×1081.84×1083.35×1083.37×1083.15×108P150.08×1080.28×1081.78×1083.70×1082.10×108P180.12×1081.79×1083.39×1083.54×1082.91×108CK0×1080.07×1080.08×1080.08×1080.13×108
2.1.2 不同菌株解磷能力
分别在0、2、4、6和8 d测定五种不同处理的无机磷基础培养基中速效磷含量,研究表明,处理P13、P15速效磷含量明显高于CK的含量,处理P7、P18与CK相比速效磷含量也有一定的提高。在培养的前4 d,处理P13和P15的速效磷含量明显高于处理P7和P18,P13、P15与CK之间存在显著差异,而P7、P18与CK间的差异未达到显著水平。P15菌株对磷酸三钙的分解能力最强,结合表1可以看出,细菌对磷酸三钙的分解能力与活菌数关系不大,菌株生长过程中对磷的需求可能是促进细菌分解磷酸三钙的重要因素。而处理P13中在4 d后速效磷下降明显快于处理P15,可能与P13活菌数高于P15有关。虽然不同时间各菌表现出的溶磷能力不同,但是总体来看各菌对磷酸三钙分解能力从大到小依次为:P15>P13>P18>P7>CK。培养基中可溶性速效磷含量呈现出先增后减趋势,最后处于平稳,说明有机酸通过螯合作用来溶磷酸三钙的过程是一个逐渐平衡的过程。表2
表2 不同菌株下解磷能力变化Tabel 2 Effect of different bacteria on phosphate dissolving ability

处理编号Processingnumber不同时间解磷量Phosphorusremovalatdifferenttimes(mg/kg)0d2d4d6d8dP7020.71d27.37b26.52ab24.8aP13087.43b99.8a16.52b10.45bP15095.81a121.96a87.14a26.86aP18027.77c26.99b35.03ab30.11aCK00.38e5.28b7.1ab7.3a
注:不同小写宇母表示差异显著(P< 0.05 ),下同
Note: The different lowercases indicate significant differences(P<0.05). The same as below
2.1.3 不同菌株对pH产生的影响
5组不同处理的pH值整体呈现出先下降后缓慢升高的趋势,在第4 d时pH最低,其后缓慢上升,这与培养基中速效磷含量呈负相关。速效磷含量较高的的P13、P15两组处理中pH下降速度也比其他处理快。CK处理由于未加入任何菌株,pH虽然也下降但是下降速度较慢,且下降幅度也比其他处理小。研究6~8 d的pH与速效磷含量变化可以看出,P7菌株虽然pH明显降低,但是速效磷含量并没有显著上升;P15菌株的速效磷含量明显降低,但是其pH变化却不明显。这说明pH不是导致解磷菌溶解磷酸三钙的主要因素。图1
2.2 不同菌株产生有机酸情况及不同有机酸对磷酸三钙溶解能力的分析
2.2.1 不同菌株产生有机酸情况及解磷能力比较
对接种不同菌株的培养基进行测定,研究表明,四种细菌所产生的有机酸整体变化规律是,有机酸含量先上升后下降,或者是先上升后下降再上升,这与虞伟斌[11]以及Illmer等[12]的研究结果相近,研究认为,解磷菌溶解磷酸盐能力的大小与取样的时间具有较强的关系。研究表明,大部分有机酸含量会在第4或者第6 d时达到最高,随后开始下降,部分菌种产生的有机酸也会上升。各不同菌株产生的丙酮酸、酒石酸、草酸的变化规律较为一致,但是不同菌株间产生有机酸的含量差异较大,P13酒石酸最大浓度可达140 μg/kg,而丙酮酸含量最高只有9.53 μg/kg。不同解磷菌株所产生的乳酸含量变化差异较大,P18菌产生的乳酸在第2 d时达到最高,而P7菌在第4 d达到最高,P15菌在第6 d达到最高,P7菌在第8 d达到最高。P7和P18菌株在第8 d时都未检测到乳酸。不同菌株产生的乙酸的变化也很不规律,但研究发现,解磷能力较弱的P7、P18菌株培养基中乙酸含量比其他菌株高,乙酸的解磷能力与另外四种有机酸相比要弱。研究表明,解磷能力较好的P13、P15菌株产生的五种有机酸的含量明显高于解磷能力较弱的P7、P18菌株,有机酸溶解磷酸三钙是由多种有机酸共同作用的结果。在试验过程中五种有机酸都出现过含量特别低,甚至检测不出该种有机酸的情况,P13菌株在2 d时产生五种有机酸,在6 d时只能产三种有机酸。解磷微生物产生的有机酸的含量和种类是随着时间而变化的。图2~6
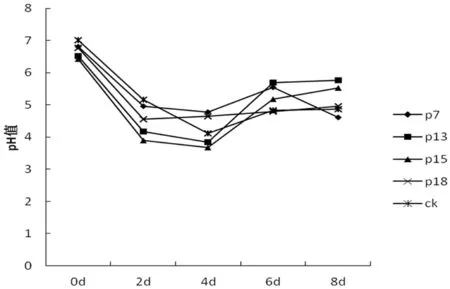
图1 不同处理培养基pH动态变化
Fig.1 The changes of pH in different treatments

图2 培养基中乳酸变化
Fig.2 Changes of lactic

图3 培养基中丙酮酸变化
Fig.3 Changes of pyruvate

图4 培养基中乙酸变化
Fig.4 Changes of acetic acid
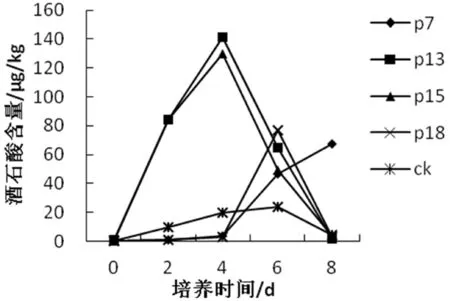
图5 培养基中酒石酸变化
Fig.5 Changes of tartaric acid

图6 培养基中草酸变化
Fig.6 Changes of oxalate
2.2.2 不同有机酸对磷酸三钙溶解能力
通径分析是通过对自变量与因变量之间的表面直接相关性进行分解,来阐述自变量对因变量的直接影响和间接影响[13]。试验利用通径分析的方法对草酸、酒石酸、丙酮酸、乳酸、乙酸五种有机酸对速效磷的影响进行了研究。研究表明,微生物对速效磷的溶解与产生的丙酮酸、酒石酸以及草酸含量在0.01水平上呈显著正相关,微生物对速效磷的溶解量与产生的乙酸含量在0.05水平上呈显著正相关,说明随着这四种有机酸升高,微生物的溶解磷酸三钙的能力也会明显增强。而乳酸与速效磷的含量之间则不具备相关性。表3
表3 速效磷含量与不同有机酸之间相关系数
Table 3 Correlation coefficient between phosphorus content and different organic acids

草酸Oxalicacid酒石酸Tartaricacid丙酮酸Pyruvicacid乳酸Lacticacid乙酸Aceticacid简单相关系数 Simplecorrelationcoefficient0.759**0.824**0.9**0.3220.45*偏相关系数 Partialcorrelationcoefficient0.4180.7920.7830.1650.239
注:N=20 “*”表示在P<0.05水平上相关性显著;“**”表示在P<0.01水平上相关性显著
Note: N=20 “*”indicates significant correlation atP<0.05 level, and‘**”indicates significant correlation atP<0.01 level
经计算得知,F=36.172,P<0.000 1,R2=0.928,整后的R2= 0.902,构建多元线性回归模型是成立的。结合理论经分析可知,各变量的标准化参数值即为各有机酸对速效磷影响的直接通径。剩余因子e=0.432,该值较大,说明对速效磷产生影响的自变量还有其他较大的影响因素未被考虑进来,因此,对微生物溶解磷酸三钙的机理还需要进一步进行深入研究。
通过计算,得出各有机酸对速效磷含量的影响的通径分析结果,通过对直接通径系数的研究发现,在上述五种有机酸对速效磷的影响中,丙酮酸对速效磷的直接影响最大,其直接通径系数是0.775,其后依次是酒石酸、乳酸、乙酸,而草酸对速效磷的直接影响是最小的。虽然草酸与速效磷之间存在显著相关,但是其直接通径系数为-0.264,因此,在讨论草酸对速效磷的影响时应该主要考虑间接影响。对间接通径系数进行分析发现,草酸通过影响酒石酸对速效磷的间接通径系数是0.292,通过影响丙酮酸对速效磷的间接通径系数是0.530,都大于它对速效磷的直接通径系数,因此,草酸对速效磷的影响主要是通过丙酮酸和酒石酸来实现的。丙酮酸对速效磷的直接通径系数为0.775,同时它还通过草酸对速效磷产生负向间接效应。在剔除了草酸、酒石酸、乙酸后,发现乳酸对速效磷的影响主要通过丙酮酸产生。表4
表4 各有机酸对速效磷含量通径系数
Table 4 Path analysis of available phosphorus in different organic acids

自变量Independentvariable简单相关系数Simplecorrelationcoefficient直接通径系数(直接作用)Directpathcoefficient间接通径系数(间接作用)草酸Oxalicacid酒石酸Tartaricacid丙酮酸Pyruvicacid乳酸Lacticacid乙酸Aceticacid合计草酸 Oxalicacid0.759-0.264-0.2920.530-0.029-0.0340.758酒石酸 Tartaricacid0.8240.544-0.081-0.065-0.018-0.037-0.071丙酮酸 Pyruvicacid0.90.775-0.1970.087-0.061-0.040-0.089乳酸 Lacticacid0.3220.0540.038-0.0870.218--0.00010.169乙酸 Aceticacid0.45-0.0790.036-0.1400.1120.0001-0.009
3 讨 论
微生物的解磷过程是一个非常复杂的过程,酸解作用被认为是一种重要的解磷机理,它是指在微生物代谢过程中分泌各种小分子量有机酸与磷矿粉发生一系列作用使磷矿粉溶解的过程。伊鋆等[4]在研究PSB28菌株解磷的机理时,发现有机酸在溶解磷酸盐时主要是通过与金属阳离子的螯合作用来实现;虞伟斌等[11]研究也发现K3分泌的苹果酸的在溶磷作用中起主要作用。试验对P7、P13、P15、P18四种解磷菌在磷胁迫条件下,产生有机酸溶解磷酸三钙的过程进行了研究,发现四种解磷菌都可以产生草酸、酒石酸、丙酮酸、乳酸、乙酸等五种有机酸。林启美等[14]在研究微生物解磷机理时发现,不同的微生物在溶解磷酸盐时,产生的有机酸的数量和种类都有很大的差异。Deubel等[15]研究指出解磷细菌解磷时分泌有机酸的种类和数量也是在不断变化的。试验中虽然4株解磷菌都能产生草酸、酒石酸、丙酮酸、乳酸、乙酸等五种有机酸,但是不同解磷菌产生有机酸的含量差异也很大,同一种解磷菌在不同时间产生的有机酸种类也有所不同,产生的有机酸的含量也有很大的差异。试验结果表明,P13、P15菌种溶解磷酸三钙能力明显高于P7、P18菌种,P13、P15产生的有机酸的含量特别是丙酮酸、草酸、酒石酸含量也明显高于其他菌种,这说明有机酸在溶解磷酸三钙的过程中起主要作用。
试验利用通经分析的方法对草酸、酒石酸、丙酮酸、乳酸、乙酸五种有机酸对速效磷的影响进行了探讨。由通径系数反映的有机酸对速效磷的直接影响由大到小排序依次是:丙酮酸、酒石酸、乳酸、乙酸、草酸。对间接通径系数进行分析发现,草酸对速效磷的影响主要是通过丙酮酸和酒石酸来实现的,乳酸对速效磷的影响主要通过丙酮酸产生。研究还发现剩余因子值较大,说明对速效磷产生影响的自变量还有其他较大的影响因素未被考虑进来,由于试验条件的限制,试验无法对所有的影响因素都进行分析,因此,对微生物溶解磷酸三钙的过程还需要进行更深一步的研究。
目前学者们对于微生物的解磷机理依然有很多争论,Lin等[16]研究认为,微生物在溶解磷酸盐时虽然会产生葡萄糖酸,但最终是葡萄糖酸中质子使难溶性的无机磷溶解。虞伟斌等[18]认为是有机酸起主导作用,他们在研究中调节培养基的pH,人工模拟质子的酸溶作用对解磷量的影响,发现解磷菌K3不仅分泌有机酸同时也产生了H+,然而质子的酸溶效果远远低于有机酸的溶磷效果。赵小蓉等[17]认为是质子作用和有机酸作用同时存在,他们在研究中发现培养基中的速效磷含量与pH值之间存有一定的相关性,他们还发现培养液中pH的降低并不是解磷微生物溶解磷酸盐的必要条件。研究也发现,当pH明显上升或下降时,速效磷含量的变化与pH变化并不完全一致,这说明pH不是导致解磷菌溶解磷酸三钙的主要因素。
4 结 论
对P7、P13、P15、P18四株解磷菌进行培养,并对其进行动态观测,研究其解磷量与有机酸之间的关系。四株解磷菌都能产生草酸、酒石酸、丙酮酸、乳酸、乙酸等五种有机酸,四种解磷菌溶解磷酸三钙能力有显著差异,解磷能力大小依次是P15>P13>P18>P7。五种有机酸对速效磷的直接影响由大到小排序依次是:丙酮酸>酒石酸>乳酸>乙酸>草酸。P13、P15产生的有机酸的含量特别是丙酮酸、草酸、酒石酸含量也明显高于其他菌种,有机酸在溶解磷酸三钙的过程中起主要作用。
References)
[1] 袁园园,张荣亭,马盼,等.小麦磷利用效率研究进展[J].山东农业科学,2016,48(1):155-160.
YUAN Yuan-yuan, ZHANG Rong-ting, MA Pan, et al. (2016). Research progress of phosphorus use efficiency in wheat (TriticumacestivumL.) [J].ShandongAgriculturalSciences, 48(1): 155-160. (in Chinese)
[2]臧威,孙剑秋,王鹏,等.东北地区四种农作物根际磷细菌的分布[J]. 中国生态农业学报,2009,17(6):1 206-1 210.
ZANG Wei, SUN Jian-qiu, WANG Peng, et al. (2009). Distribution of phosphobacteria in rhizosphere soils of four crops in Northeast China [J].ChineseJournalofEco-Agriculture, 17(6): 1,206-1,210. (in Chinese)
[3]赵小蓉,林启美.微生物解磷的研究进展[J].土壤肥料,2001,5(3):7-11.
ZHAO Xiao-rong, LIN Qi-mei. (2001). A review of phosphate-dissolving microorganisms [J].SoilsandFertilizers, 5(3): 7-11. (in Chinese)
[4]伊鋆,高晓蓉,安利佳.产气肠杆菌PSB28的解磷机理研究[J].中国农学通报,2011, 27(27):245-249.
YIN Jun, GAO Xiao-rong, AN Li-jia. (2011). The study of phosphate solubilization mechanism of enterobacter aerogenes PSB28 [J].ChineseAgriculturalScienceBulletin, 27(27): 245-249. (in Chinese)
[5]钟传青,黄为一.磷细菌P17对不同来源磷矿粉的溶磷作用及机制[J].土壤学报,2004,41 (1):931-937.
ZHONG Chuan-qing, HUANG Wei-yi. (2004). Effects and mechanism of P-solubilizing bacillus P17 strain on phosphorus solubilization of different phosphate rocks [J].ActaPedologicaSinica, 41(1): 931-937. (in Chinese)
[6]王同,孔令雅,焦加国,等.红壤溶磷菌的筛选及溶磷机制[J].土壤学报,2014,51(2):373-378.
WANG Tong,KONG Ling-ya,JIAO Jia-guo, et al. (2014). Screeing of phospate-solubilizing bacteria in red soil and their acting mechanism [J].ActaPedologicaSinica, 51(2): 373-378. (in Chinese)
[7]潘虹.石灰性土壤解磷细菌分子鉴定与解磷能力及机理初探[D].西北农林科技大学的硕士学位论文,2014.
PAN Hong. (2014).IsolationandidentificationofPSBandexplorationoftherirphosphate-solubilizingcapacityandmechanisms[D]. Master Dissertation. Northwest Agriculture and Forestry University, Xi`an.(in Chinese)
[8]王法威.A9解磷细菌解磷机制及其对潜在缺磷石灰性土壤上大豆生长的影响研究[D]. 西北农林科技大学的硕士学位论文,2014.
WANG Fa-wei. (2014).A9phosphate-solubilizingbacteriadissolvingmechanismanditsimpactonsoybeangrowthonpotentialphosphorusdeficiencyoncalcareoussoil[D]. Master Dissertation. Northwest Agriculture and Forestry University. Xi`an. (in Chinese)
[9] Whitelaw, M. A., Harden, T. J., & Helyar, K. R. (2013). Phosphate solubilisation in solution culture by the soil fungus penicillium radicum.SoilBiology&Biochemistry, 31(5): 655-665.
[10]郭艺鹏,王海儒,孙林琦,等.枣根际解磷细菌的分离筛选及16S rDNA鉴定[J].河南农业大学学报,2015,49(6):811-816, 837.
GUO Yi-peng, WANG Hai-ru, SUN Lin-qi, et al. (2015). Screening and 16S rDNA identification of phosphate-solubilizing bacteria in rhizosphere soils of jujub [J]JournalofHenanAgriculturalUniversity, 49(6): 811-816, 837. (in Chinese)
[11]虞伟斌,杨兴明,沈其荣,等.K3解磷菌的解磷机理及其对缓冲容量的响应[J].植物营养与肥料学报,2010,16(2): 354-361.
YU Wei-bin, YANG Xing-ming, SHEN Qi-rong, et al. (2010). Mechanism on phosphate solubilization of pseudomonas sp. K3 and its phosphate solubilization ability under buffering condition [J].PlantNutritionandFertilizerScience, 16(2): 354-361. (in Chinese)
[12] Illmer, P., & Schinner, F. (1995). Solubilization of inorganic calcium phosphates--solubilization mechanisms.SoilBiology&Biochemistry,27(3): 257-263.
[13]杜家菊,陈志伟.使用SPSS线性回归实现通径分析的方法[J].生物学通报,2010,45(2):4-6.
DU Jia-ju, CHEN Zhi-wei. (2010). Method of path analysis using SPSS linear regression [J].BulletinofBiology, 45(2): 4-6. (in Chinese)
[14]林启美,王华,赵小蓉,等.一些细菌和真菌的解磷能力及其机理初探[J].微生物学通报,2001, 28(2):26-29.
LIN Qi-mei, WANG Hua, ZHAO Xiao-rong, et al. (2001). Bacteria and fungi in dissolving phosphate rock [J].Microbiology,28(2): 26-29. (in Chinese)
[15] Deubel, A., Gransee, A., & Merbach, W. (2000). Transformation of organic rhizodepositions by rhizosphere bacteria and its influence on the availability of tertiary calcium phosphate.JournalofPlantNutrition&SoilScience, 163(4):387-392.
[16] Lin, T. F., Huang, H. I., Shen, F. T., & Young, C. C. (2006). The protons of gluconic acid are the major factor responsible for the dissolution of tricalcium phosphate by burkholderia cepacia, cc-al74.BioresourceTechnology, 97(7):957-960.
[18] 赵小蓉,林启美,李保国.微生物溶解磷矿粉能力与pH及分泌有机酸的关系[J].微生物学杂志,2003,23(2):5-7.
ZHAO Xiao-rong, LIN Qi-mei, LI Bao-guo. (2003). The Relationship between Rock Phosphate Solubilization and pH and Organic Acid Production of Microorganisms [J].JournalofMicrobiology, 23(2): 5-7. (in Chinese)
Study on Organic Acid Secreted from 4 Strains Phosphorus-solubilizing Bacteria and Calcium Phosphate Dissolving Ability
LIU Sheng-liang1,2, ZHU Shu-liang1,2, QI Xian-hui1,2, LI Xiao-yuan1, ZHANG Fu-wei1,YANG Wen-ying1, LI Jian-gui1,2
(1.ForestryInstitute,XinjiangAgriculturalUniversity,Urumqi830052,China; 2.XinjiangJujubeEngineeringTechnologyResearchCenter,XinjiangAgriculturalUniversity,Urumqi830052,China;3.XinjiangAgriculturalUniversity2612team,Urumqi830052,China)
【Objective】 To study organic acid secreted from phosphorus-solubilizing bacteria and calcium phosphate dissolving ability.【Method】The P7, P13, P15 and P18 phosphate-solubilizing bacteria were sent to cultivate for dynamic observation. The organic acid types and content were determined by high performance liquid chromatography (HPLC) method for studying the relationship between phosphate-solubilizing and organic acids. 【Result】The research showed that dissolving calcium phosphate capacity of the 4 strains of bacteria had significant difference, the order of which was: P15 > P13 > P18 > P7 and the content difference of four kinds of bacteria producing organic acids was also great, and organic acids produced by the same bacteria at different times were different, too. Through the path analysis, it was found that the direct effects of organic acids on available phosphorus in descending order were: pyruvic acid > tartaric acid > lactic acid > acetic acid > oxalic acid.【Conclusion】The strongest ability to solve phosphorus bacteria is the P15 strain and the direct influence coefficient of pyruvic acid on the dissolution of calcium phosphate is the largest.
phosphate dissolving microorganism; acid hydrolysis; organic acid
LI Jian-gui (1964- ), male, native place: Pingdu, Shandong. Professor, Doctor, research field: Ecology and Forestry economic management. (E-mail)lijiangui1971@163.com
10.6048/j.issn.1001-4330.2017.06.019
2017-03-14
国家自然科学基金项目“土壤和肥料在新疆灰枣cAMP形成中的作用机制”(31360194);新疆维吾尔自治区科技计划项目“南疆红枣专用PGPR制剂研制与应用”(201431106);国家林业公益性项目重大专项课题“新疆红枣、核桃专用微生物肥料研制与应用示范”(201304701)
刘胜亮(1990-),男,山东沂水人,硕士研究生,研究方向为微生物生态学,(E-mail)lcu2010@163.com
李建贵(1971-),男,山东平度人,教授,博士,研究方向为生态学、林业经济管理,(E-mail)lijiangui1971@163.com
S154.34
A
1001-4330(2017)06-1114-08
Supported by: National Natural Science Foundation of China"Mechanism of Soil and Fertilizer in the Formation of cAMP in Xinjiang Jujube"(31360194)and Key Technology R&D Planning Program"Preparation and Application of Special PGPR for Soutern Xinjiang jujube"(201431106)

