真核表达载体pEGFP-N1-ASIC2a的构建及功能验证*
李栋,张康,马晓芸,袁维秀,刘晓燕
(1.中国人民解放军总医院 麻醉手术中心,北京 100853;2.军事医学科学院毒物药物研究所,北京 100850)
真核表达载体pEGFP-N1-ASIC2a的构建及功能验证*
李栋1,张康2,马晓芸2,袁维秀1,刘晓燕2
(1.中国人民解放军总医院 麻醉手术中心,北京 100853;2.军事医学科学院毒物药物研究所,北京 100850)
目的 构建含大鼠ASIC2a全长互补脱氧核糖核酸(cDNA)的绿色荧光蛋白真核表达质粒pEGFPN1-ASIC2a并转染至HEK293细胞,观察其表达和分布情况。方法 设计、合成ASIC2a基因引物,利用聚合酶链反应(PCR)技术,以现有质粒pcDNA3.1-ASIC2a为模板扩增出含有限制性内切酶(XhoⅠ与EcoRⅠ)酶切位点的ASIC2a基因片段与载体pEGFP-N1酶切后连接形成重组质粒pEGFP-N1-ASIC2a,并瞬时转染至HEK293细胞中,利用细胞膜片钳方法观察其表达电流的情况。为进一步明确其亚细胞定位,将质粒EGFPN1-ASIC2a、pDsRed-Monomer-Mem和pDsRed2-ER共同转染至HEK293细胞中。结果 PCR扩增得到正确的ASIC2a基因片段,酶切鉴定和测序证实获得重组质粒pEGFP-N1-ASIC2a,并将其瞬转至HEK293细胞后,成功记录到ASIC2a同聚体电流。然后利用共转染的方法观察到,pEGFP-N1-ASIC2a主要在HEK293细胞内质网表达,细胞膜表达较少。结论 重组绿色荧光蛋白真核表达载体pEGFP-N1-ASIC2a构建成功,且在HEK293细胞中主要表达于内质网,为下一步研究ASIC2a的功能,特别是为ASIC2a在缺血性神经元损伤中的作用及其机制的研究奠定基础。
ASIC2a;载体构建;真核表达载体;绿色荧光蛋白
酸感受离子通道(acid-sensing ion channels,ASICs)属于上皮钠通道/退变素超家族中的一员,是一类质子(H+)激活对阳离子选择性通透的非电压依赖的配体门控性离子通道。目前,已经克隆出6种ASIC 的 亚 基 :ASIC1a、ASIC1b、ASIC2a、ASIC2b、ASIC3和ASIC4。ASICs广泛分布于哺乳动物的神经系统,参与体内包括疼痛、学习、记忆、突触传递和可塑性调节等在内的多种生理和病理过程[1]。近年来,ASICs在脑缺血神经元损伤中的作用越来越受到人们的关注。
目前,针对ASIC1a和脑缺血神经元损伤的研究较多,普遍认为ASIC1a对脑缺后神经元损伤的发生具有促进作用,阻断或下调其表达都能起到一定的神经保护作用[2-3]。但是,ASIC2a作为另一种在中枢神经系统中大量表达的ASICs亚基,关于其在脑缺血神经元损伤过程中的作用机制的研究还不是很多,且观点不一。有文献报道,在脑缺血后ASIC2a通道可能在缺血损伤过程中具有一定的脑保护作用[4]。有报道认为,ASIC2a通过促进ASIC1a的表达和上膜反而加重神经元的损伤[5]。本实验拟构建含大鼠ASIC2a全长互补脱氧核糖核酸(complementary deoxyribonucleic acid,cDNA)的重组绿色荧光蛋白表达质粒,并将其转染至HEK293细胞,使其表达有生物学活性的融合蛋白,观察ASIC2a蛋白在细胞的表达和分布情况,为进一步研究ASIC2a在缺血性神经元损伤过程中的作用及其机制奠定基础。
1 材料与方法
1.1 主要材料和试剂
人HEK293细胞(由本室保存),质粒pcDNA3.1-ASIC2a(由本室保存[6]),pEGFP-N1、pDsRed-Monomer-Mem、pDsRed2-ER载体(购自美国Clontech公司),琼脂糖凝胶纯化回收试剂盒、质粒小量快速提取试剂盒和Top10感受态细胞(购自北京博迈德公司),脂质体LipofectamineTM2000(购自美国Invitrogen公司),高保真聚合酶及其他实验中用到的限制性内切酶(购自辽宁省大连宝生物工程有限公司),DMEM培养液、胎牛血清(fetal bovine serum,PBS)(购自美国Gibco公司产品),RIPA裂解液、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)配置试剂盒(购自北京康维世纪公司),苯甲基磺酰氟、各种蛋白酶抑制剂(购自美国Sigma公司),硝酸纤维素膜(nitrocellulose filter membrane,NC)(购自美国Pall公司),小鼠抗绿色荧光蛋白(green fluorescent protein,GFP)单克隆抗体(购自美国Affinity公司),二抗山羊抗小鼠IRDye 800CW(购自美国Li-Cor公司),其余常用化学试剂均为国产分析纯试剂。
1.2 仪器与设备
DYCP-31DN型琼脂糖水平电泳槽、DYY-6C型稳压稳流定时电泳仪和WD-9413B型凝胶图像成像分析系统(均购自北京六一仪器厂),2720聚合酶链反应(polymerase chain reaction,PCR)扩增仪(美国Applied Biosystems公司),Biochrom Libra紫外分光光度计(英国Biochrom公司),BX-51型荧光显微镜及照相系统(日本Olympus公司),Mini-PROTEAN 3电泳系统(美国BioRad公司),Odyssey双色红外荧光成像系统(美国Li-Cor公司),Axopatch-200B型膜片钳放大器(美国Axon Instrument公司),Digidata-1322A型数模转换器(美国Axon Instrument公司),P-97型玻璃记录电极水平拉制仪(美国Sutter Instrument公司),BH-2型压力给药仪(美国Medical System公司)。
1.3 重组表达质粒载体的构建
1.3.1 目的片段的扩增及纯化 根据基因库(Gen-Bank)所提供的基因ASIC2a序列及pEGFP-N1提供的酶切位点设计引物。正向引物:5'-GCGCTCGA GATGGACCTCAAGGAGAGCCCCAG-3',反向引物:5'-CGCGAATTCGGCAGGCAATCTCCTCCAGGGTGC-3'。应用上述引物扩增出ASIC2a。PCR反应液为:10×Pyrobest缓冲液Ⅱ 2 μl;Pyrobest DNA 聚合酶(5 u/μl)0.1 μl;正向引物(20 μmol)1 μl,反向引物(20 μmol)1 μl;dNTP 混合物(各 2.5 mmol)1.6 μl;模板pcDNA3.1-ASIC2a质粒0.5 ng,加灭菌去离子水至20 μl。PCR反应条件为:95℃下预变性5 min,94℃ 1 min,55℃ 1 min,72℃ 1.5 min。35 个循环后72℃延时延伸7 min。PCR产物跑1.0%琼脂糖凝胶电泳进行初步鉴定,紫外灯下切下含有目的条带的凝胶块,按操作说明书用琼脂糖凝胶回收试剂盒回收目的DNA片段。在回收的目的基因片段和pEGFP-N1载体中分别加入 1μlEcoRⅠ、1 μl XhoⅠ和2 μl 10×H buffer溶液,加去离子水至20 μl。混匀后置于37℃水浴酶切3 h,酶切片段中加入适量溶胶液后转移至吸附柱中进行目的基因片段和载体片段的回收。
1.3.2 连接、转化、质粒提取和鉴定 将PCR产物酶切处理后得到的目的片段ASIC2a与pEGFP-N1载体片段进行连接:ASIC2a(XhoⅠ/EcoRⅠ)2 μl,pEGFP-N1(XhoⅠ/EcoRⅠ)1 μl,连接酶(SolutionⅠ)5 μl混匀后置于16℃连接1 h。连接产物转化至感受态细胞TOP10,涂布于有氨苄青霉素的LB平板上,过夜培养。挑取单个菌落,适量扩增后提取质粒用XhoⅠ和EcoRⅠ双酶切验证。将酶切行为正确的克隆送至北京博迈德公司测序,测序结果与数据库中序列进行比对。序列确认无误后命名为pEGFP-N1-ASIC2a。
1.4 质粒pEGFP-N1-ASIC2a转染至HEK293细胞或与pDsRed-Monomer-Mem和pDsRed2-ER共转染至HEK293细胞
转染前1天,将常规培养于含10%FBS的DMEM培养液中的HEK293细胞按2×105个/孔接种于预先放置细胞爬片的无菌6孔板中,置于37℃、5%二氧化碳CO2条件下培养。待细胞生长至90%~95%融合度时,用无血清DMEM培养液清洗2次后换用无血清的DMEM培养,并按LipofectamineTM2000说明书进行转染。具体方法如下:先将重组质粒 pEGFP-N1-ASIC2a、pDsRed-Monomer-Mem、pDsRed2-ER和脂质体LipofectamineTM2000分别溶于无血清的DMEM中,5min后将两者混合室温静置20 min,然后逐滴加入质粒-脂质体混合物,摇晃均匀后,置于37℃、5%CO2条件下培养,6 h后更换含10%FBS的DMEM培养液于37℃、5%CO2条件下继续培养48 h后Western blot检测ASIC2a蛋白表达情况、用膜片钳记录细胞的表达电流或用荧光显微镜观察细胞ASIC2a表达和分布情况。
1.5 Western blot检测重组质粒pEGFP-N1-ASIC2a在HEK293细胞中的表达
冰上收集转染质粒的HEK293细胞,常规提取蛋白,加热变性后取50μg蛋白上样至预先配置的SDS-PAGE凝胶,进行电泳。电泳后将蛋白电转至NC,5%脱脂奶粉常温封闭1 h,小鼠抗GFP单克隆抗体1∶5 000,4℃孵育过夜,然后用TBST洗膜,再用山羊抗小鼠IRDye 800CW二抗37℃避光孵育1 h。用TBST洗膜后用双色红外荧光成像系统扫描分析。
1.6 全细胞膜片钳记录电流
电流用放大器进行记录,采样软件为pClamp 8.2(美国Axon Instruments公司),数模转换器转换。玻璃记录电极使用水平拉制仪拉制。玻璃电极中灌有细胞内液:门冬酸钾镁110 mmol/L,氯化钠NaCl 10mmol/L,4-羟乙基哌嗪乙磺酸(HEPES)10mmol/L,三磷酸腺苷镁5 mmol/L,鸟苷三磷酸0.5 mmol/L,乙二醇双(2-氨基乙基醚)四乙酸(EGTA)10mmol/L,氯化钙 CaCl21mmol/L,酸碱度(pondus hydrogenii,pH)7.35;电极电阻为3~5 MΩ。将种有转染HEK 293细胞的玻片放入记录槽中,记录槽中加入细胞外液:NaCl 140 mmol/L,氯化钾 KCl 2.7 mmol/L,CaCl22.5mmol/L,氯化镁 MgCl21mmol/L,HEPES 15mmol/L,磷酸二氢钠1 mmol/L,pH 7.35。将细胞膜电位钳制在-70 mV,形成高阻封接、破膜后,利用放大器gapfree模式记录ASIC2a同聚体电流。低通滤波频率设为2kHz,采样频率为10kHz。将pH值为4.0的细胞外液灌充于单管给药玻璃电极内,其直径为10~15 μm,通过压力给药仪向细胞喷射给药。将压力给药仪的压力固定在5 psi,调节喷射时间为2~5 s。阿米洛利母液(Amiloride,100mmol)溶于细胞外液中,工作液浓度为100μmol灌流给药。所有电流记录都在室温下进行。
1.7 荧光显微镜观察pEGFP-N1-ASIC2a和荧光蛋白的表达
将转染后的HEK293细胞用PBS洗涤3次,自然风干后,滴加500 ml/L甘油缓冲液封片后置于荧光显微镜下观察。
1.8 统计学方法
采用Origin 8.0软件对记录的电流进行作图,Prism 5软件将电流峰值进行统计分析,结果以均数±标准差(±s)表示。相对电流幅值百分数(relative amplitude%)=应用阿米洛利后的电流幅值/应用阿米洛利前的电流幅值×100%,使用自身配对的t检验,P<0.05为差异有统计学意义。
2 结果
2.1 PCR产物的电泳结果及重组质粒pEGFP-N1-ASIC2a的酶切鉴定结果
以pcDNA3.1-ASIC2a质粒为模板扩增出的PCR产物进行电泳分析,在约1 600 bp处扩增出特异性目的基因条带,分子量大小基本与ASIC2a理论值相符,且条带清晰整齐。ASIC2a的PCR产物与载体pEGFP-N1连接后形成重组质粒pEGFP-N1-ASIC2a,经XhoⅠ和EcoRⅠ双酶切后,进行琼脂糖凝胶电泳,可见2条清晰的条带,其中1条的分子量与目的基因相符(1 600 bp),另一条与空载体分子量相符(4 700 bp),说明可能已获得需要的重组质粒(见图1)。将上述质粒送公司测序,结果显示其序列完全与已发表的序列相符,提示已成功获得重组质粒。
2.2 重组质粒pEGFP-N1-ASIC2a在HEK293细胞中的表达
裂解HEK293细胞提取蛋白后进行Western blot检测,结果所示(见图2),在分子量为82 kD左右处可见一清晰条带,正好与GFP分子量(26 kD)和ASIC2a分子量(56 kD)之和相符,而未转染重组质粒的HEK293细胞在相应分子量区域未检测到蛋白表达,证明质粒pEGFP-N1-ASIC2a转染HEK293细胞后成功表达。
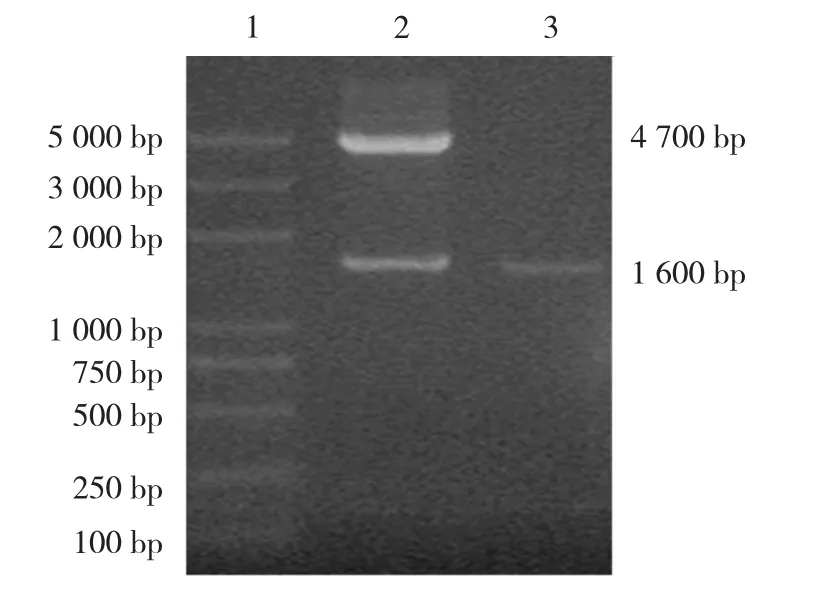
图1 PCR产物的电泳结果及重组质粒pEGFP-N1-ASIC2a的酶切鉴定
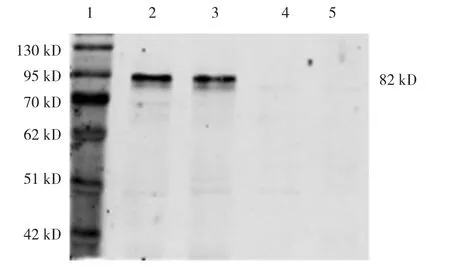
图2 重组质粒pEGFP-N1-ASIC2a在HEK293细胞中的表达
2.3 pEGFP-N1-ASIC2a在HEK293细胞表达后的ASIC2a同聚体电流情况
利用全细胞膜片钳方式记录转染pEGFP-N1-ASIC2a质粒的HEK293细胞电流。共记录6个细胞,当细胞膜电位钳制在-70 mV,胞外pH值从7.4下降至4.0时,其中4个细胞记录到明显的内向电流,当同时加入酸感受离子通道非特异性阻断剂阿米洛利(100 μmol)时,内向电流峰值明显变小,产生阻断作用,阻断作用为(81±4.6)%(P=0.001),提示重组质粒pEGFP-N1-ASIC2a转染HEK293后在细胞膜上成功表达为ASIC2a通道。未转染pEGFP-N1-ASIC2a质粒的HEK293细胞,当进行压力喷射给药时未记录到内向电流(见图3)。

图3 100 μmol阿米洛利阻断HEK-293细胞表达的ASIC2a同聚体电流 (n=4,±s)
2.4 pEGFP-N1-ASIC2a和荧光蛋白的表达和分布
将质粒pEGFP-N1-ASIC2a、pDsRed-Monomer-Mem(胞膜特异性marker)和pDsRed2-ER(内质网特异性marker)共转染至HEK293细胞,置于荧光显微镜下观察,可见HEK293细胞转染质粒pEGFP-N1-ASIC2a表达后呈绿色荧光(见图 4A、D)。转染pDsRed2-ER(见图4B)和pDsRed-Monomer-Mem(见图4E)表达后呈红色荧光。转染质粒pEGFP-N1-ASIC2a表达的荧光蛋白与转染pDsRed2-ER表达的荧光蛋白呈黄色,提示具有共定位(见图4C)。转染pEGFP-N1-ASIC2a与pDsRed-Monomer-Mem表达的荧光蛋白仅有少量的共定位(见图4F),提示在HEK293细胞中ASIC2a蛋白仅有少量表达在膜上,大量表达在内质网内。
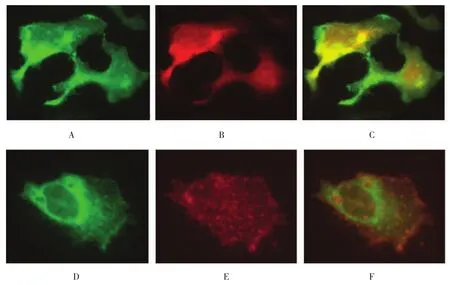
图4 质粒转染的HEK293细胞 (荧光显微镜×1 000)
3 讨论
ASIC2a作为一种在哺乳动物外周和中枢神经系统广泛分布的酸感受离子通道亚基,在体内多种病理生理过程中发挥着重要作用。曾有报道称ASIC2a可能与皮肤触觉、痛觉和味觉的产生相关[7-8]。然而随着对酸感受离子通道研究的深入,特别是近几年,人们开始关注ASIC2a与脑缺血损伤的关系,对其在缺血后神经元损伤过程中发挥的作用也进行一定的探索。JOHNSON等人[4]研究发现,在脑缺血后ASIC2a在海马和皮层神经元的表达升高,这种现象与抗凋亡蛋白B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)与B细胞淋巴因子-w(B-cell lymphoma-w,Bcl-w)参与神经保护作用非常相似,提示ASIC2a通道可能在缺血损伤过程中具有一定的脑保护作用;并且一些传统的脑保护方法和药物也能在脑缺血发生时上调ASIC2a的表达水平,笔者认为其可能是通过对ASIC2a的调节而发挥神经保护作用[9-10]。但是,JIANG等人[5]最近的报道却称ASIC2a能通过增强ASIC1a亚基的N-连接糖基化来促进ASIC1a的表达和上膜,从而加重神经元的损伤。因此,关于ASIC2a在缺血性脑损伤病理生理过程中到底发挥怎样的作用目前仍不清楚,需要人们进一步的探索和研究。
质粒pEGFP-N1因其自身携带有能表达绿色荧光蛋白的EGFP报告基因,并且其基因片段长度为717 bp,易于构建融合蛋白,常常被人们用来作为目的基因片段的载体,构建重组质粒。笔者将表达ASIC2a的基因片段与载体pEGFP-N1连接,成功构建出表达绿色荧光蛋白和ASIC2a蛋白的pEGFPN1-ASIC2a质粒,将其转染至HEK293细胞后记录到能被阿米洛利阻断的ASIC2a同聚体通道电流,提示ASIC2a具有一定的细胞膜表达量。为进一步研究其亚细胞定位,笔者将其与pDsRed2-ER和pDsRed-Monomer-Mem分别共转染至HEK293细胞,观察ASIC2a在细胞不同部位的表达,发现ASIC2a在HEK293细胞中主要表达于内质网,而在细胞膜表达较少。在本实验条件下,虽然ASIC2a蛋白细胞膜表达量较少,但仍能记录到ASIC2a同聚体电流,说明是否能记录到电流与蛋白细胞膜表达量多少无关。
综上所述,本实验中pEGFP-N1-ASIC2a质粒的成功构建为下一步研究ASIC2a的功能,特别是对其在缺血性神经元损伤中的作用及其机制的研究奠定基础。且质粒pEGFP-N1-ASIC2a转染至HEK293细胞后在不同细胞部位的表达情况对笔者后续研究具有一定的指导意义。
[1]XU T L,XIONG Z G.Dynamic regulation of acid-sensing ion channels by extracellular and intracellular modulators[J].Current Medicinal Chemistry,2007,14(16):1753-1763.
[2]SIMON R,XIONG Z.Acidotoxicity in brain ischaemia[J].Biochemical Society Transactions,2006,34(6):1356-1361.
[3]YANG Z J,NI X,CARTER E L,et al.Neuroprotective effect of acid-sensing ion channel inhibitor psalmotoxin-1 after hypoxia-ischemia in newborn piglet striatum[J].Neurobiology of Disease,2011,43(2):446-454.
[4]JOHNSON M B,JIN K,MINAMI M,et al.Global ischemia induces expression of acid-sensing ion channel 2a in rat brain[J].Journal of Cerebral Blood Flow and Metabolism,2001,21(6):734-740.
[5]JIANG N,WU J,LENG T,et al.Region specific contribution of asic2 to acidosis-and ischemia-induced neuronal injury[J].Journal of Cerebral Blood Flow and Metabolism,2017,37(2):528-540.
[6]戴薇薇,刘晓燕,马晓芸,等.大鼠酸感受离子通道亚基2a表达质粒的构建及生物学特性考察[J].沈阳药科大学学报,2008,25(2):153-157.
[7]BOHLEN C J,CHESLER A T,SHARIF-NAEINI R,et al.A heteromeric texascoralsnake toxin targetsacid-sensing ion channels to produce pain[J].Nature,2011,479(7373):410-414.
[8]PRICE M P,LEWIN G R,MCILWRATH S L,et al.The mammalian sodium channel bnc1 is required for normal touch sensation[J].Nature,2000,407(6807):1007-1011.
[9]ZHANG Y,ZHOU L,ZHANG X,et al.Ginsenoside-Rd attenuates trpm7 and asic1a but promotes asic2a expression in rats after focal cerebral ischemia[J].Neurological Sciences,2012,33(5):1125-1131.
[10]MIAO Y,ZHANG W,LIN Y,et al.Neuroprotective effects of ischemic preconditioning on globalbrain ischemia through up-regulation of acid-sensing ion channel 2a[J].International Journal of Molecular Sciences,2010,11(1):140-153.
Construction of rat pEGFP-N1-ASIC2a eukaryotic expression vector and its functional verification*
Dong Li1,Kang Zhang2,Xiao-yun Ma2,Wei-xiu Yuan1,Xiao-yan Liu2
(1.Anesthesia and Operation Centre,Chinese PLA General Hospital,Beijing,100853,China;2.Institute of Pharmacology and Toxicology,Academy of Military Medical Sciences,Beijing,100850,China)
ObjectiveTo construct the eukaryotic green fluorescent protein expression vector pEGFP-N1-ASIC2a,and to observe its expression and distribution in the HEK293 cells.MethodsASIC2a gene primers were designed and synthesised.ASIC2a gene sequence withXhoⅠ,EcoRⅠ restriction enzyme cutting site was amplified from the plasmid pcDNA3.1-ASIC2a by reversed transcription-polymerase chain reaction PCR and inserted into the eukaryotic green fluorescent protein expression vector pEGFP-N1 to form a recombinant plasmid pEGFP-N1-ASIC2a.And the plasmid pEGFP-N1-ASIC2a was transfected into HEK293 cells to observe the protein expression of current situation by cell patch clamp technique.The plasmid pEGFP-N1-ASIC2a,pDsRed-Monomer-Mem,pDsRed2-ER were transfected into the HEK293 cells,and the distribution of the protein was observed.ResultsThe correct ASIC2a gene fragment was amplified by PCR.The successful insertion of ASIC2a into the pEGFP-N1 vector was confirmed by restriction and sequence analysis.The recombinant plasmid pEGFP-N1-ASIC2a was successfully constructed in HEK293 cells.The ASIC2a homopoly-mer channel current was successfully recorded.And more pEGFP-N1-ASIC2a protein expressed in endoplasmic reticulum than in cell membrane were found.ConclusionsThe recombinant eukaryotic green fluorescent protein expression vector pEGFP-N1-ASIC2a was successfully constructed,and mainly expressed in the endoplasmic reticulum in HEK293 cells.It will be contributed to the further research on the function of ASIC2a,especially help for the studies on the effect of ASIC2a in ischemic neuronal injury and its mechanism of action.
ASIC2a;vector construction;eukaryotic expression vector;green fluorescent protein
Q782
A
10.3969/j.issn.1005-8982.2017.11.002
1005-8982(2017)11-0008-06
2016-11-29
国家自然科学基金(No:31400917)
刘晓燕,E-mail:lxy3002@163.com

