热休克蛋白90调节大鼠脑缺血/再灌注后海马CA1区c-Jun的稳定性
芦 博,刘功俭,齐敦益
(徐州医科大学附属医院麻醉科,江苏 徐州 221002)
热休克蛋白90调节大鼠脑缺血/再灌注后海马CA1区c-Jun的稳定性
芦 博,刘功俭,齐敦益
(徐州医科大学附属医院麻醉科,江苏 徐州 221002)
目的 观察热休克蛋白90调节大鼠脑缺血/再灌注损伤后海马CA1区c-Jun的稳定性。方法 免疫印迹法观察不同处理组c-Jun蛋白的表达变化,免疫沉淀法检测Hsp90与c-Jun的关系以及c-Jun泛素化水平的变化,焦油紫染色研究海马CA1区神经元的丢失。结果 1.在脑缺血再灌注后c-Jun与Hsp90形式免疫复合物。2.给予GA后c-Jun表达与I/R6h组比较有显著差异(P<0.05)。结论 GA通过抑制hsp90的分子伴侣活性,使其客户蛋白c-Jun稳定性降低发生经由泛素-蛋白酶体系统降解,从而产生减少海马神经元迟发型死亡的作用。
热休克蛋白90;脑缺血再灌注;c-Jun
目前普遍认为热休克蛋白90(heatshockprotein90,Hsp90)是一种重要的分子伴侣蛋白,在和多种客户蛋白协同作用下,可以将其正常的功能充分发挥。我室研究表明,Hsp90参与了脑缺血有关的病理及生理过程[1]。但并没有阐明其作用的分子机制。c-Jun蛋白是转录因子AP-1家族的组成成员,在脑缺血再灌注损伤后可引起神经细胞凋亡。格尔德霉素(Geldanamycin,GA)能够竞争性的结合到Hsp90的N-末端ATP/ADP结合域,导致其客户蛋白的降解。有文献报道GA可以通过抑制Hsp90的分子伴侣活性降低HEK293细胞中c-Jun蛋白水平[2]。却没有检测出细胞中内源性HSP90与内源性c-Jun的相互结合。本实验拟通过全脑缺血/再灌注的大鼠模型,研究Hsp90与c-Jun的关系,以期待通过给以GA来抑制c-Jun在脑缺血再灌注损伤后可引起神经细胞凋亡。
1 材料与方法
1.1 实验动物及材料
此研究中使用的大鼠体重均在250~300 g。GA购于美国MDBio公司,抗体(anti-c-Jun,anti-p-c-Jun,antiubiquitin和anti-Hsp90)由SantaCruz公司提供;二抗(羊抗兔),
1.2 大鼠四动脉阻断全脑缺血模型
依据参照大鼠四动脉结扎模型将本次研究的动物模型进行制备[3],随后对动物进行麻醉的注射,将双侧颈总动脉进行分离,椎动脉予以电凝操作。
1.3 动物的分组及处理措施
假手术组(Sham组)分离双侧颈总动脉,电凝椎动脉但不结扎双侧颈总动脉;缺血/再灌注组(I/R组);给药组,缺血前20 min经侧脑室注射800μM的GA10 μL,或者侧脑室注射0.16 mg/kg体重的MG1325 μL和1600μM的GA5 μL混合液,然后缺血15 min;溶剂对照组同样方法注射等体积的溶剂(20%DMSO)。
1.4 样品的制备
首先对蛋白测定样品实施再灌注,超过6小时后处死大鼠,并取其脑部,并将双侧海马进行分离。海马于液氮中提取,同时将匀浆缓冲液加入其中,离心后将上层清液去除,将0.5 mL匀浆缓冲液A加入沉淀中,随后再次进行离心,将上层清液去除,将0.5 mL匀浆缓冲液B。最后放置在适宜条件下储存。
1.5 检测方法
蛋白含量测定方法依据BCA方法进行,标准蛋白的参考依据牛血清白蛋白为准。
免疫沉淀与免疫印迹若蛋白类含量相同,均为400 μg,需将IP缓冲液加入其中,以20 μL蛋白A预吸附1 h,10000 g离心2 min,选取上册清液后将抗加入其中,量为1~2 μg,将其放在旋转混匀器上,反应时间为4小时,随后将20 μL蛋白A加入其中,将其放置在旋转混匀器上,进行2小时的反应。将其进行离心操作,并对其沉淀进行冲洗三次,利用IP缓冲液洗。待上述操作完成后将蛋白上样缓冲液加入其中,将其混匀后放置在适宜条件下,即沸水浴,时间为5分钟,1000 g离心2 min,取上清用于免疫印迹。参考Sambrook等方法,含相同蛋白量的样品或者IP处理后样品,经SDSPAGE分离后,将其在PVDF膜上进行转移,利用干转法进行。在封闭液中放置PVDF,并在温室条件下进行孵育,时间达到3小时后将一抗工作液加入其中。加入HRP标记的二抗工作液,室温孵育半小时,TBST洗膜(3 min×5),水洗。使用ECLPlus试剂盒,暗室曝光,显影定影。扫描胶片上条带,图像处理仪分析免疫印迹的灰度。
1.6 统计学处理
数据用统计分析软件SigmaStat 3.2处理,以±S.D.表示,采用q检验,P<0.05为差异有统计学意义。
2 结 果
2.1 c-Jun是Hsp90的客户蛋白
我们用hsp90的抗体(A)或者c-Jun的抗体(B)做免疫沉淀,得到的条带再用c-Jun的抗体和Hsp90的抗体做免疫印迹分析。两组结果如图1显示I/R6h组c-Jun和Hsp90形成免疫复合物,给药组(GA)可抑制免疫复合物的表达。这表明c-Jun是Hsp90的客户蛋白之一,二者在缺血再灌注损伤中形成免疫复合物。


图1 免疫沉淀分析海马CA1区的核提取物,用Hsp90的抗体做免疫沉淀,再用c-Jun的抗体做免疫印记分析(A),用c-Jun的抗体做免疫沉淀,再用Hsp90的抗体做免疫印记分析(B)
2.2 Hsp90的抑制剂GA抑制c-Jun的蛋白表达
缺血前20 min经侧脑室注射800μM的GA10 μL,然后缺血15 min,再灌注6 h。核提取物免疫印迹法分析,结果如图2显示I/R6 h组较Sham组,c-Jun表达显著增加(aP<0.05);给药组(GA)较I/R6 h组,c-Jun表达显著降低(bP<0.05)。这说明GA可以抑制由缺血再灌注引起的c-Jun表达。
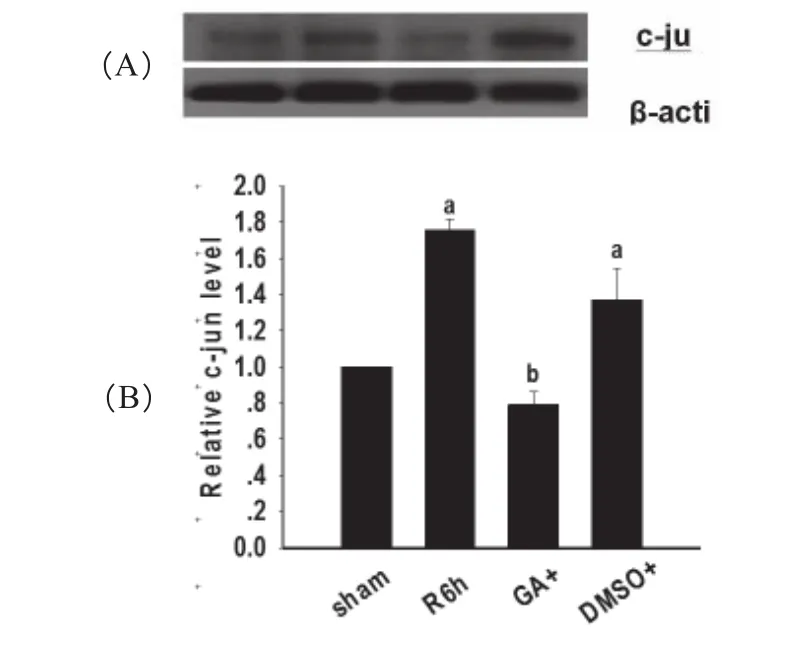
图2 免疫印迹法分析得到Sham组、I/R6h组、给药组(GA)和溶剂对照组(DMSO)的海马CA1区c-Jun的蛋白表达条带(A)及扫描图(B)(n=4)aP<0.05versusSham;bP<0.05versusR6hgroups
2.3 MG132阻断GA促进的泛素化依赖的c-Jun的降解
缺血前20 min侧脑室注射各5 μLMG132(40 μg/10 μL)GA(1600μM)的混合液和800 μM的GA10 μL,缺血15 min,再灌注3 h。结果如图3A显示由GA造成的c-Jun表达减低可被MG132完全阻断。这一结果提示c-Jun的降解经由泛素-蛋白酶体系统,于是我们用免疫沉淀的方法检测MG132作用后c-Jun的相对泛素化水平。结果如图3B显示,在MG132与GA共同存在下,c-Jun的泛素化水平降低。这说明GA引起的c-Jun表达降低通过泛素-蛋白酶体系统降解,而MG132可以阻断这种降解。
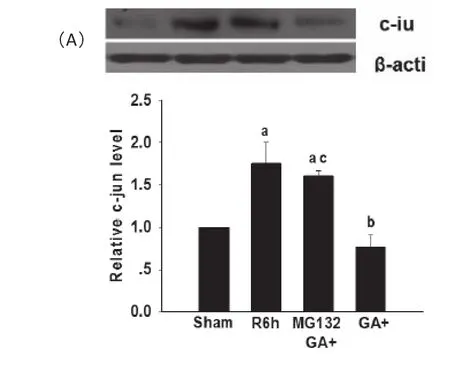

图3 (A)免疫印迹分析海马CA1区,MG132阻断GA促进的c-Jun表降解。(B)免疫沉淀法分析,MG132抑制c-Jun经泛素-蛋白酶体系统降解。(n=4)。aP<0.05versussham;bP<0.05versusR6hgroup;cP<0.05versusGAgroup
2.4 GA具有抗神经元迟发型死亡作用
缺血再灌注损伤可引起海马CA1区椎体细胞的迟发型死亡,如图4焦油紫染色结果显示,在Sham组(图4a、b),正常的椎体细胞显示出圆形淡着色的细胞核,而在R5d组(图4c、d)、G132+GA组(图4g、h)和DMSO组(图4i、j),死细胞呈现出固缩的细胞核。I/R的损伤作用可被GA(图4e、f)逆转。综上所述,GA具有抗I/R诱导的海马神经元迟发型死亡的作用。
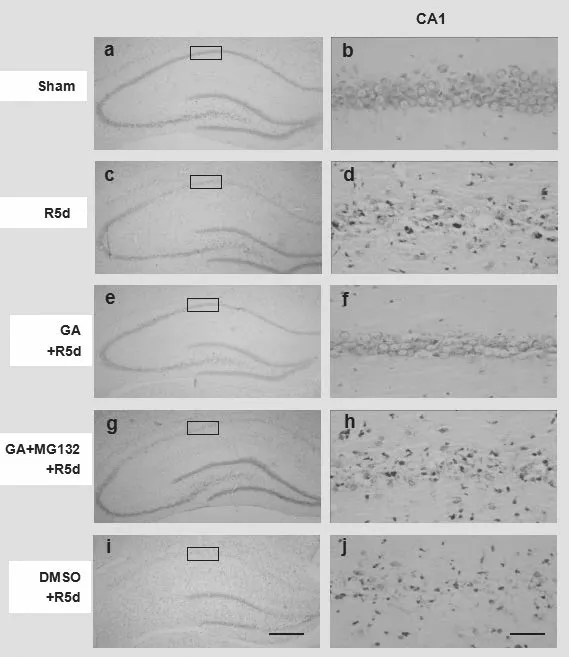
图4 各组大鼠海马CA1区形态学表现(焦油紫染色)a、c、e、g、i:x40;b、d、f、h、j:x400。比例尺200 μm(i)和10 μm(j)。在1mm的面积内计数活细胞个数。aP<0.05versustheShamgroup;bP<0.05versustheR5dgroup,n=6)
3 讨 论
在真核生物细胞中,热休克蛋白90较为常见,且该物质中的胞质蛋白较为丰富。与此同时,热休克蛋白90可以在分子伴侣中直接参与,随后调节新生客户蛋白的折叠,另外还可以调节蛋白的稳定性和活性[1、3]。以上蛋白会由多伴侣复合物进行释放,最终致使客户蛋白被降解,从而对细胞内转录调控有着不利影响,甚至会对信号转导有着严重影响[4]。
我们的研究结果都支持的观点c-Jun的是HSP90的客户蛋白(图1所示),通过给予GA抑制Hsp90的分子伴侣活性,从而使c-Jun的蛋白表达降低(图2所示)。
蛋白酶体与泛素化信号系统一起构成的泛素一蛋白酶体通路是真核生物细胞内主要的蛋白质选择性降解途径,其不仅在多种调控蛋白质加工和更新过程中直接参与,同时对细胞的增值、分化以及凋亡进行调节,除此之外,还可以调节细胞生命活动过程,如:中细胞信号转导以及应激反应。
我们的研究结果表明,c-Jun的降解主要是通过泛素-蛋白酶体途径介导。根据我们目前的结果(图3),在MG132存在的条件下,c-Jun蛋白表达明显增加。在应用疫沉淀的方法检测MG132作用后c-Jun的相对泛素化水平,我们选择了再灌注时间是3小时,而不是6小时,是因为再灌注6 h后,通过泛素-蛋白酶体途径介导的c-Jun降解已经减少,所以其水平难以测得,而在再灌注3 h后,c-Jun的降解主要由泛素-蛋白酶体途径介导,其水平易于测得。根据我们目前得到的结果,不可否认泛素-蛋白酶体途径介导c-Jun的降解,但并不是唯一的,也不可排除其他的降解途径。
c-Jun蛋白是转录因子AP-1家族的组成成员,在脑缺血再灌注损伤后可引起神经细胞凋亡[2]。前面的实验结果显示GA可以抑制c-Jun蛋白表达,通过焦油紫染色的结果(图4),给予GA可提高海马神经元存活细胞的数量,故其具有抗c-Jun诱导的海马神经元迟发型死亡作用。
[1] Yong-LingXu,C.Li,andGuang-YiZhang.ChinJNeurosci, 2003,19:74-78.
[2] FranciscoH.Cruzalegui,GilesE.HardinghamandHilmarBading. EMBOJournal,2009,18:1335-1344.
[3] YanXia,JiWang,andW.K.AlfredYung.MolecularCell, 2007,25:219-232.
[4] HironobuIguchi,TetsuoMitsui,MahoIshida.ShigenobuKanbaand JunArita.ndocrineJournal,2011,58:747-759.
[5] Acosta-SaltosA.,MakwanaM.andRaivichG.Soc. Neurosci,2007:136.
[6] KunlinJin,XiaoOuMao,RogerP.Simon,andDavidA.Greenberg.Jour nalofMolecularNeuroscience,2001,16:49-56.
本文编辑:吴玲丽
R749
B
ISSN.2095-8242.2017.32.6153.03

