颅内间叶型软骨肉瘤1例并文献回顾
顾 昕 冯 睿
(1上海市静安区中心医院神经外科 上海 200040; 2复旦大学附属华山医院神经外科 上海 200040)
颅内间叶型软骨肉瘤1例并文献回顾
顾 昕1△冯 睿2
(1上海市静安区中心医院神经外科 上海 200040;2复旦大学附属华山医院神经外科 上海 200040)
Mott[1]于1899年报道了第1例颅内软骨肉瘤(intracranial condrosarcoma,IC)。随着学者们对肿瘤不同分型的重视,Lichtenstein等[2]于1959年首先报道了间叶型软骨肉瘤(mesenchymal condrosarcoma,MC),描述其为一种恶性程度高的、侵袭性强的肿瘤。Dahlin等[3]在1962最先报道了1例颅内间叶型软骨肉瘤(intracranial mesenchymal condrosarcoma,IMC)。IC只占所有原发颅内占位的0.15%[4],十分罕见,大部位于颅底,IMC更只占其中的30%[5],目前英文文献报道约40例。IMC在临床特征上有异于其他IC的独特特征,特此讨论。
临床资料 患者女性,41岁,因“左下肢乏力伴行走不稳2个月”入院。2个月前无明显诱因首发左拇趾麻木、无力,逐渐向上发展至左下肢无力,行走困难需搀扶。左上肢乏力不明显。右侧肢体无影响。
查体 神志清楚,颅神经检查未见明显异常,左下肢肌力髋、膝、踝关节均为Ⅱ级,趾关节Ⅱ-级,左上肢肌力肩、肘、腕、指关节均为Ⅴ-级,右侧肢体肌力Ⅴ级;左下肢肌张力呈折刀样增高,左上肢及右侧无明显异常;左侧肢体膝反射、跟腱反射增强(+++),余肢体腱反射正常;左侧巴氏征、奥本海默征等病理征可疑阳性(+/-)。
影像学 头颅MRI平扫(图1)示占位大小约5 cm×6 cm×4 cm,主体位于右侧额叶后部及大脑镰旁,少量延伸至左侧,周围环形水肿带明显,T1、T2加权呈等、低混杂信号,增强后边界清楚,呈明显、欠均匀的强化,并可见脑膜尾征,中央可见低信号片状影,囊变亦可见,中线稍向左侧移位约2 mm。MRV示额部上矢状窦显示不清,周围可见走行扭曲紊乱的小血管影。术前诊断为“双侧额后、镰旁脑膜瘤”。
手术治疗 完善术前检查后全麻下行开颅肿瘤切除术,取额后冠状切口,右侧骨瓣铣开,切开右额硬脑膜即见肿瘤位于矢状窦旁,小心止血、分离肿瘤边界后,铲除与矢状窦、大脑镰粘连的肿瘤基底部,然后分块切除肿瘤,肿瘤质地偏硬,血供丰富,出血较多;肿瘤部分长入矢状窦内,粘连紧密,难以完全切除,最终达次全切除。术中输血200 mL×2次。术后当日患者左下肢肌力恢复至髋、膝、踝、趾Ⅲ级,3日后在家属搀扶下开始下地行走,病程中患者情况平稳无特殊,术后11天出院时肌力检查:髋、膝、踝、趾均Ⅳ+级,右下肢腱反射增强。术后病理结果为:IMC。经充分沟通后,患者及家属决定回当地进一步治疗,术后1个月左右患者接受普通放疗+静脉化疗(药物不详)。患者术后3个月复查MRI增强扫描(图2),显示病灶处无明显复发征象,瘤腔清晰可见,矢状窦内少量肿瘤残留可能。

A:Preoperative axial;B:Sagittal enhanced MRI showed bilateral parasagittal tumors;C:MRV showed no patency of the sagittal sinus.
图1 术前增强MRI和MRV
Fig 1 Enhanced MRI and MRV findings before operation
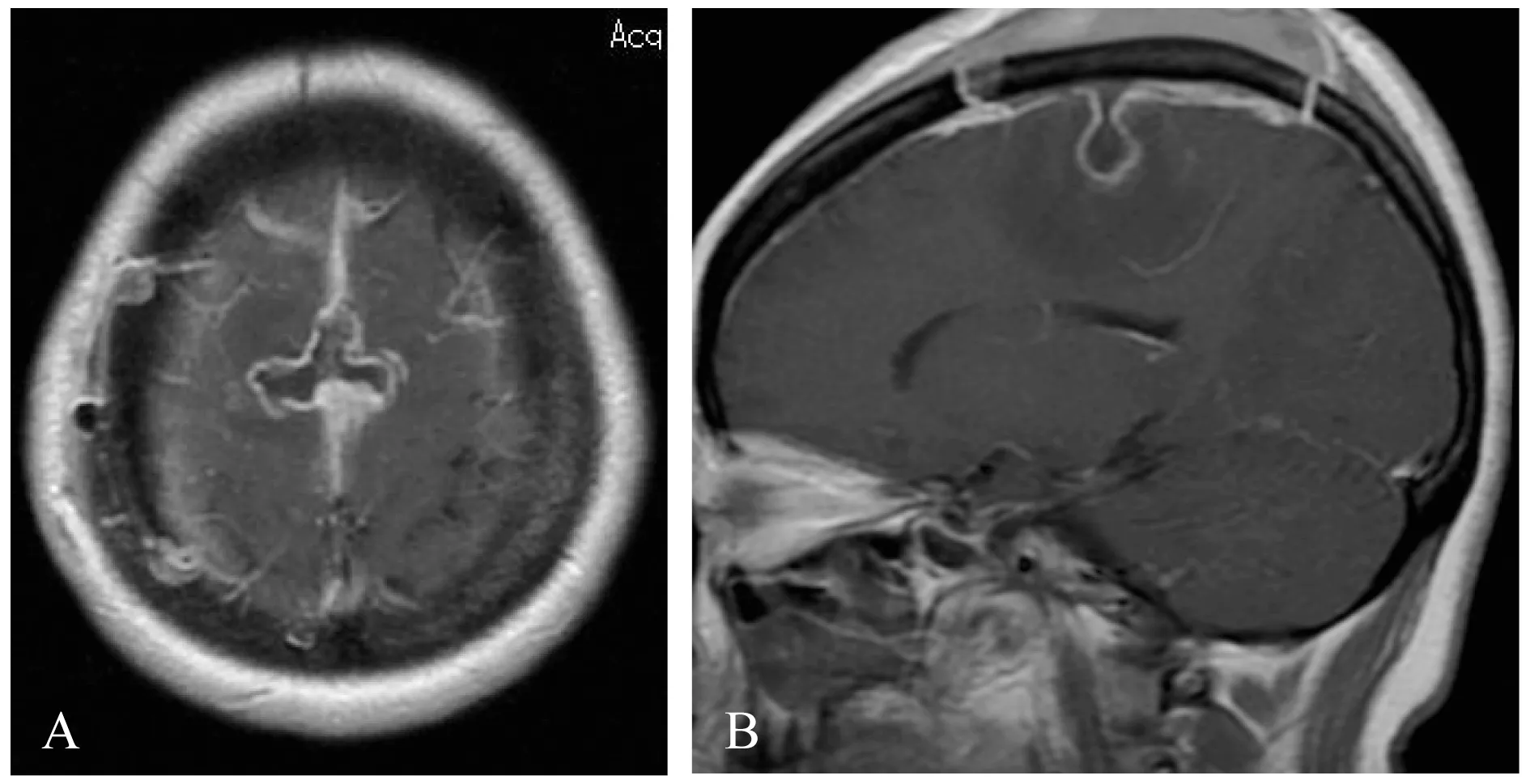
A:3 months after operation,the MRI level showed a small residual in the sagittal sinus; B:No obvious sign of recurrence in sagittal plane.
图2 术后3个月增强MRI
Fig 2 Enhanced MRI findings 3 months after operation
病理特点 大体标本呈分叶状,可见出血、钙化及囊变,切面灰白质韧。镜下见(图3):梭形瘤细胞片巢状或编织状密集排列,核染色深,核分裂相可见,小血管丰富,部分区域可见软骨形成、骨化、钙化,分化好的软骨区域与未分化的间质交错分布,二者之间的交界缘清晰。免疫组化:Vim(+),CD99(+),CD34(-),PR(-),EMA(-/+),S100(+),D2-40(-/+),MIB-1:40%。

A:A dense arrangement of cells in a nest or braid (HE);B:The positive expression of S100 tumor nuclei.
图3 肿瘤病理镜下表现(×100)
Fig 3 Pathological appearance of tumor (×100)
讨论 IMC多发于10~30岁的年轻人群[6-7]。Chen等[8]回顾的37例患者平均年龄约21.5岁,男女比例为16∶21。间叶型有女性多发倾向[9-10],黏液型在人群统计学上与间叶型类似[11],而传统型无明显年龄、性别倾向。颅内是骨外MC最常发的部位[12-13]。复旦大学附属华山医院于2008年曾报道7例IC,其中4例是IMC,均位于颅底[14]。Korten等[5]于1998年回顾了192例IC,统计结果表明:其中超过80%在颅底部位。但IMC的实际多发位置却在非颅底处。2004年Chen等[8]回顾了37例IMC患者,28/37例位于非颅底处,且位置倾向于出现在额顶区域,右侧更多[6,12]。值得一提的是,绝大部分位于大脑镰及矢状窦旁的IC都是间叶型,其他类型在此处极为罕见[11,15]。关于IMC的起源问题,目前没有定论:颅底处的IMC可认为起源于颅底软骨联合处的未分化胚胎细胞[3,11],但大部分IMC位于非颅底处。目前较流行的学说认为IMC源于硬膜或蛛网膜中原始的多能间质细胞,它们有生成软骨肉瘤的潜能[11]。也有人认为IMC起源于脑膜纤维母细胞或分化中的前间质软骨祖细胞[16]。
根据WHO对骨肿瘤的分类,软骨肉瘤病理分型为[17]:传统型,间叶型,透明细胞型和去分化型。而IC有特别的分类,Russell等[18]根据组织学结构已将IC分为传统型、间叶型和黏液型(中间型),这种分类一直延续至今,间叶型和黏液型分开归类的提出是为了区别于传统型的Ⅰ~Ⅲ分级[5],间叶型分级本身意味着侵袭性强、转归差。Lichtenstein等[2]最早建议MC为一种单独的亚型,Salvati等[13]以及Korten等[5]也认为间叶型应该被归为单独的一类。目前尚未在颅内发现透明细胞型或去分化型软骨肉瘤[17]。即IC的分型仅有传统型和间叶型两类。
传统型软骨肉瘤可有典型的蜂窝状增强[15],而IMC无此特点。CT或平片常可见占位内的点片状钙化[19],T2WI常可见钙化区+非钙化区2个区域,增强MRI可见不均匀强化[20]。超过50%的肿瘤在影像学上有显著的富血管性,高度疑似脑膜瘤或血管外皮瘤,有些甚至可与动静脉畸形混淆。然而,这些影像学特征都缺乏敏感性和特异性,因此影像学诊断十分困难。
IMC现今首选的治疗方案仍然是外科切除,继而辅以放化疗。外科全切除肿瘤已是公认的最佳和首要治疗方案[13,21],切除程度是决定长期预后的关键,因全切除后患者常可获得较长生存期。真正意义上的肿瘤全切除边界应超过肿瘤的实际边界(即扩大切除),因为研究表明MC会有伪足样突起突入周围软组织[22]。生长在颅底、侵犯颅内重要静脉窦以及术前误诊为良性转归的脑膜瘤的病例,往往得不到真正的全切除,因此后续治疗十分必要,即便全切除的病例也应积极行后续治疗。
放射治疗应用十分广泛,已成为现今MC外科治疗后首选的后续治疗方案[22]。在大多数IMC病例放疗被证明能够减轻影像学增强程度和减小占位体积[23-24]。后续进行化疗的病例极少,且大部分学者认为化疗对IMC无效。然而Spina等[7]报道的1例IMC,术后应用类肉瘤方案进行化疗,疗程结束后增强MRI显示病灶处强化明显减弱。Aksoy等[25]用替莫唑胺治疗复发的颞顶叶IMC,患者症状几乎完全消失,MRI也显示病灶体积明显减小。
IMC的转归常为短期内的原位复发或远处转移[26]。传统型与黏液型IC仅有6%的5年死亡率,而IMC的5年死亡率高达54%[17]。传统型和黏液型IC的预后取决于肿瘤的分级(Ⅰ~Ⅲ级),而间叶型本身就意味着肿瘤级别高、侵袭型强,预后极差[4]。
总之,IMC是一种罕见的、高度恶性的肿瘤,它在IC中恶性程度最高、转归最差,多发于非颅底的位置,常位于额顶叶处,多见于10~30岁的年轻人;位于镰旁者绝大多数为IMC。IMC病理学特点为软骨区域与间质区域的双相性分布。影像学表现缺乏特异性和敏感性,术前往往误诊为脑膜瘤。外科扩大切除是最佳和首选的治疗方案,但切除后往往复发快,有时可远处转移,必须行后续治疗。放射治疗是首选的、被普遍接受的后续治疗;大部分学者对化疗持保留意见,而且接受此治疗的病例极少,但已有人报道了成功化疗的病例,这也许是IMC治疗新的突破口。在临床工作中,对位于非颅底部位特别是矢旁或镰旁的酷似脑膜瘤的占位,如同时伴有上述特征,应将IMC列为鉴别诊断之一。
颅内间叶型软骨肉瘤; 外科治疗; 放射治疗;化学治疗
[1] MOTT FW.Chondro-sarcoma springing from the sella turcica[J].ArchNeurolPsychiat,1899,1:432-433.
[2] LICHTENSTEIN L,BERNSTEIN D.Unusual benign and malignant chondroid tumors of bone- a survey of some mesenchymal cartilage tumors and malignant chondroblastic tumors,including a few multicentric ones,as well as many atypical benign chondroblastomas and chondromyxoid fibromas[J].Cancer,1959,12(6):1142-1157.
[3] DAHLIN DC,HENDERSON ED.Mesenchymal chondrosarcoma.Further observations on a new entity[J].Cancer,1962,15(2):410-417.
[4] CHANDLER JP,YASHAR P,LASKIN WB,etal.Intracranial chondrosarcoma:a case report and review of the literature[J].JNeuro-Oncol,2004,68(1):33-39.
[5] KORTEN A,TER BERG HJW,SPINCEMAILLE GH,etal.Intracranial chondrosarcoma:review of the literature and report of 15 cases[J].JNeurolNeurosurPS,1998,65(1):88-92.
[6] CROSSWELL H,BUCHINO JJ,SWEETMAN R,etal.Intracranial mesenchymal chondrosarcoma in an infant[J].MedPediatrOncol,2000,34(5):370-374.
[7] LA SPINA M,DOLLO C,GIANGASPERO F,etal.Intracranial mesenchymal chondrosarcoma with osteoid formation:report of a pediatric case[J].ChildNervSyst,2003,19(9):680-682.
[8] CHEN JY,HSU SS,HO JT.Extraskeletal intracranial mesenchymal chondrosarcoma:case report and literature review[J].KaohsiungJMedSci,2004,20(5):240-246.
[9] BINGAMAN KD,ALLEYNE CH,OLSON JJ.Intracranial extraskeletal mesenchymal chondrosarcoma:Case report[J].Neurosurg,2000,46(1):207-211.
[10] CHEN JY,HSU SS,HO JT.Extraskeletal intracranial mesenchymal chondrosarcoma:case report and literature review[J].KaohsiungJMedSci,2004,20(5):240-246.
[11] ORUCKAPTAN HH,BERKER M,SOYLEMEZOGLU F,etal.Parafalcine chondrosarcoma:An unusual localization for a classical variant-case report and review of the literature[J].SurgNeurol,2001,55(3):174-179.
[12] DE CECIO R,MIGLIACCIO I,FALLETI J,etal.Congenital intracranial mesenchymal chondrosarcoma:Case report and review of the literature in pediatric patients[J].PediatrDevelPathol,2008,11(4):309-313.
[13] SALVATI M,CAROLI E,FRATI A,etal.Central nervous system mesenchymal chondrosarcoma[J].JExpClinCancRes,2005,24(2):317-324.
[14] 张荣.颅底软骨肉瘤的诊治与预后(7例报告)[J].中国神经精神疾病杂志,2008,34(4):229-232.
[15] KATHIRAVEL Y,FINNIS NDM.Primary falcine chondrosarcoma[J].JClinNeurosci,2008,15(12):1406-1409.
[16] AIGNER T,LOOS S,MULLER S,etal.Cell differentiation and matrix gene expression in mesenchymal chondrosarcomas[J].AmJPathol,2000,156(4):1327-1335.
[17] BLOCH OG,JIAN BJ,YANG I,etal.A systematic review of intracranial chondrosarcoma and survival[J].JClinNeurosci,2009,16(12):1547-1551.
[18] RUSSELL DS.Meningeal tumours:a review[J].JClinPathol,1950,3(3):191-211.
[19] RUSHING EJ,ARMONDA RA,ANSARI Q,etal.Mesenchymal chondrosarcoma-A clinicopathologic and flow cytometric study of 13 cases presenting in the central nervous system[J].Cancer,1996,77(9):1884-1891.
[20] HASHIMOTO N,UEDA T,JOYAMA S,etal.Extraskeletal mesenchymal chondrosarcoma:an imaging review of ten new patients[J].SkeletalRadiol,2005,34(12):785-792.
[21] BOSE B.Intracranial extraskeletal mesenchymal chondrosarcoma:Case report and review of the literature[J].NeurosurgQuart,2003,13(1):30-39.
[22] PELLITTERI PK,FERLITO A,FAGAN JJ,etal.Mesenchymal chondrosarcoma of the head and neck[J].OralOncol,2007,43(10):970-975.
[23] HUG EB,LOREDO LN,SLATER JD,etal.Proton radiation therapy for chordomas and chondrosarcomas of the skull base[J].JNeurosurg,1999,91(3):432-439.
[24] HOSHINO M,TANJI H,WATANABE M,etal.A case of intracranial mesenchymal chondrosarcoma-changes observed by computed tomography before and after radiotherapy (author′s transl)[J].NoShinkeiGeka,1981,9(7):843-848.
[25] AKSOY S,ABALI H,KILICKAP S,etal.Successful treatment of a chemoresistant tumor with temozolomide in an adult patient:report of a recurrent intracranial mesenchymal chondrosarcoma[J].JNeuro-Oncol,2005,71(3):333-334.
[26] SCHEITHAUER BW,RUBINSTEIN LJ.Meningeal mesenchymal chondrosarcoma-report of 8 cases with review of the literature[J].Cancer,1978,42(6):2744-2752.
R739.41
B
10.3969/j.issn.1672-8467.2017.04.030
2016-08-11;编辑:王蔚)
△Corresponding author E-mail:guxin93@sina.com

