ERK5在急性心肌梗死患者中的磷酸化水平及对体外血小板激活的影响
高 稳 李 剑 倪唤春 谢 坤 罗心平
(复旦大学附属华山医院心内科 上海 200040)
ERK5在急性心肌梗死患者中的磷酸化水平及对体外血小板激活的影响
高 稳 李 剑 倪唤春 谢 坤 罗心平△
(复旦大学附属华山医院心内科 上海 200040)
目的 观察急性心肌梗死(acute myocardial infarction,AMI)患者血小板中细胞外信号调节激酶5 (extracellular signal-regulated kinase 5,ERK5)的活化水平及其特异性抑制剂XMD8-92对血小板功能的影响,探索ERK5调节血小板活性的分子机制。方法 运用Western bolt法检测AMI患者(n=34)和稳定性心绞痛患者(n=33)血小板ERK5、Akt473及Akt308的磷酸化水平;通过检测体外血小板的聚集,测定不同浓度XMD8-92对胶原(collagen)刺激引起的血小板聚集的影响;利用荧光素酶同期检测XMD8-92对血小板致密颗粒分泌的影响;通过检测血小板在纤维蛋白原上的铺展、在血浆中的收缩,评价血小板整合素ɑIIbβ3的活化水平;运用Western bolt法检测聚集反应中XMD8-92对Akt473、Akt308及PTEN370磷酸化的影响。结果 AMI患者组ERK5及Akt473、Akt308磷酸化水平显著升高(P<0.05);ERK5抑制剂XMD8-92可抑制胶原诱导的血小板聚集、分泌、栓块收缩及在纤维蛋白原上的铺展等活化指标;XMD8-92处理后血小板Akt473、Akt308及PTEN370磷酸化水平减低。结论 ERK5的激活参与了AMI过程中血小板的活化;ERK5可通过调节PTEN的活性,从而调节Akt的磷酸化水平,进而调控血小板的功能。其特异性抑制剂有望成为新的抗栓药物。
ERK5; 血小板; 血栓; 急性心肌梗死
目前,动脉血栓性疾病成为威胁我国人民健康的首位杀手,其死亡率已超过肿瘤。其中冠心病是主要的病种,而冠心病的致死事件多为急性心肌梗死所致。已明确动脉血栓形成的关键步骤为:血管壁受损、动脉粥样硬化斑块破裂暴露血管内皮下基质,血小板立即通过其表面黏附受体 GPIb-IX-V和GPVI 黏附于内皮下胶原(collagen)组织。胶原刺激导致血小板发生一系列信号转导事件,引起血小板产生血栓烷A2以及释放细胞内颗粒内容物(如二磷酸腺苷 ADP等),最终导致血小板整合素 αIIbβ3激活,激活的整合素 αIIbβ3向内传递信号,加强血小板活化、聚集、释放颗粒,启动凝血过程[1]。由此可见,血小板活化是动脉血栓形成过程中重要的始动环节。深入研究血小板活化新调控方式进而发现新作用机制的药物是目前医学研究领域的一个重点。
丝裂原激活的蛋白激酶(mitogen-activated protein kinases,MAPK)信号通路是真核细胞中广泛存在并发挥重要调节作用的信号通路,其中细胞外信号调节激酶1/2 (extracellular signal-regulated kinases,ERK1/2)、c-Jun氨基末端激酶(c-Jun NH2-terminal kinases,JNK)和p38丝裂原活化的蛋白激酶(p38MAPK)在血小板中的作用均有较深入的研究[2-3]。最新研究发现血小板中也存在细胞外信号调节激酶5 (extracellular signal-regulated kinase 5,ERK5)的稳定表达[4],但其在急性血栓事件中的作用及调节机制尚需进一步研究。本实验拟采用ERK5特异性抑制剂研究ERK5在血小板中的作用,并探讨其分子机制,从而为ERK5作为新型抗栓药物靶点提供理论依据。
材 料 和 方 法
药品与试剂
研究对象 选择2015年1月至2016年6月于复旦大学附属华山医院急诊就诊的患者,参考指南标准[5]纳入急性ST段抬高心肌梗死患者。根据人群特征,从心内科病房中入选稳定性心绞痛患者[6]作为对照。遵循赫尔辛基宣言,在得到华山医院伦理委员会授权后(伦理号2015-050),对所有入选患者进行告知,并签署知情同意书。进行临床资料的收集,行肘部静脉取血6 mL。体外实验用血小板来自复旦大学健康志愿者,入选前签署知情同意书。
所用试剂 胶原、荧光素酶(luciferase),购自美国CHRONO-LOG公司;ADP/ATP双磷酸酶(apyrase)、前列腺素E1(PGE1)、纤维蛋白原(fibrinogen),购自美国Sigma公司;磷酸化Akt473抗体、磷酸化Akt308抗体、磷酸化ERK5抗体和GAPDH抗体,购自美国Cell Signaling公司;辣根过氧化物酶标记的山羊抗兔和山羊抗鼠IgG,购自美国Jackson公司;XMD8-92,购自美国Selleck公司;凝血酶(α-Thrombin),购自美国Enzyme Reseach公司。
比浊法测定人血小板的体外聚集 采用枸橼酸钠抗凝管采集健康志愿者血标本,加入ADP/ATP双磷酸酶和前列腺素E1抗凝,差速离心法制得血小板沉淀,重悬于台式缓冲液中,采用血细胞计数仪计数并调整浓度为3×108/mL。DMSO及终浓度为5、10、20 μmol/L的XMD8-92与血小板悬液共孵育3 min,使用Chrono-Log公司血小板聚集仪检测在胶原刺激下,相应浓度XMD8-92对人血小板聚集程度的影响[7]。
荧光素酶检测人血小板的ATP分泌 在血小板聚集反应达到平稳后,加入10 μL的荧光素酶,利用血小板聚集仪同时检测不同浓度XMD8-92对血小板ATP的分泌的影响[8]。
Western bolt法检测Akt473、Akt308、PTEN370、PTEN380、ERK5分子的磷酸化水平 采集心梗患者组和稳定性心绞痛组(对照组)血标本,差速离心法制得洗涤血小板后,直接加入等体积2×SDS裂解液。对照组血小板在聚集反应结束后,加入等体积2×SDS裂解液。在冰上充分裂解后,煮沸使蛋白变性,采用聚丙烯酰胺凝胶电泳法分离蛋白,并转至PVDF膜上。采用一抗4 ℃过夜,漂洗后加入辣根过氧化物酶标记的IgG,室温振荡孵育1 h。漂洗后显色,终止反应后拍照[9]。
血小板在纤维蛋白原上的铺展和栓块收缩
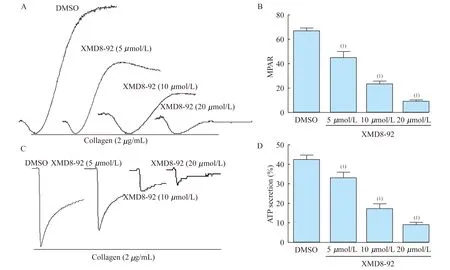
铺展 在载玻片上滴加50 μg/mL纤维蛋白原溶液100 μL,4 ℃孵育过夜,PBS洗去未结合的纤维蛋白原,加2% BSA溶液室温封闭1 h,PBS洗去未结合的BSA;分别取DMSO或不同浓度XMD8-92孵育的血小板悬液(3×107/mL)100 μL加到包被有纤维蛋白原的载玻片上,37 ℃孵育60 min,4%甲醛溶液固定后,采用鬼笔环肽对细胞骨架F-actin进行染色,荧光显微镜下观察并随机选取视野拍照,Image J软件测量血小板面积[10]。
栓块收缩 向含有DMSO或XMD8-92的富血小板的血浆中分别加入凝血酶至终浓度为1 U/mL,37 ℃孵育,分别在 1 h、3 h 观察栓块的收缩情况并拍照,Image J 软件测量栓块面积。收缩率计算公式为:1-栓块面积/起始栓块面积。
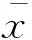
结 果
急性心肌梗死患者组及对照组ERK5、Akt473及Akt308比较 为了明确ERK5是否参与了急性心肌梗死的发病,我们首先对急性心肌梗死患者组及对照组血小板中ERK5及Akt磷酸化水平进行了分析。ERK5及Akt473及Akt308磷酸化水平在急性心肌梗死患者组较对照组显著升高,差异有统计学意义(P<0.05,图1)。参照JUPITER研究,以CRP作为炎症指标,以2.0mg/L为界[11],对心肌梗死患者组进行亚组分析。CRP≥2.0mg/L组ERK5磷酸化水平略高于非炎症组,二者差异无统计学意义(P>0.1,图1)。该结果表明,急性心肌梗死发病过程中,血小板中ERK5活性增强,其活化程度与炎症水平无明显相关性。
XMD8-92对血小板聚集和ATP分泌的影响 为了探索ERK5对血小板活化的影响,我们采用ERK5的选择性抑制剂XMD8-92[12]对血小板的聚集进行了检测。以胶原为刺激剂时,XMD8-92可显著抑制血小板体外聚集,且呈现浓度依赖性。各浓度XMD8-92预孵育组与对照组相比,血小板聚集程度差异均有统计学意义(P<0.05,图2)。
采用血小板聚集仪同时检测该抑制剂对血小板致密颗粒分泌的影响。图2可见随着XMD8-92浓度升高,对ATP分泌的抑制作用逐渐增强。与对照组相比,各处理组ATP分泌水平差异均有统计学意义(P<0.05,图2)。
XMD8-92对血小板铺展及栓块收缩的影响 整合素αIIbβ3是血小板表面最丰富的受体,血小板内信号通路激活可导致其发生构型改变,增加与配体纤维蛋白原结合的程度;反之,纤维蛋白原与整合素ɑIIbβ3结合也可以引起信号向血小板内部传导,形成外向内的扩大信号[13]。血小板在纤维蛋白原表面的铺展和在血浆中的收缩都是血小板外向内信号的反映。本实验结果显示,XMD8-92抑制了血小板在纤维蛋白原上的铺展,处理组与对照组比较,血小板平均铺展面积显著减小,差异具有统计学意义(P<0.05,图3)。
同样,XMD8-92对血小板在血浆中收缩也产生了显著抑制的效果,并呈现浓度依赖性(图3)。这些研究表明,针对ERK5为靶点抑制血小板活化,可显著抑制血栓形成的过程。
XMD8-92对Akt473、Akt308和PTEN370磷酸化的影响Akt作为生物系统中重要的靶酶,其通过对血小板聚集和分泌的调控,而在血小板活化中扮演重要角色[14]。我们对聚集反应后的血小板蛋白Akt473、Akt308位点磷酸化进行了检测。图4表明,XMD8-92对Akt这两个位点磷酸化水平均呈现浓度依赖性抑制作用。

Statistical analysis of Western blot of phosphorylated ERK5 (A),phosphorylated Akt473 (B) and phosphorylated Akt308 (C);D:Subgroups analysis of ERK5 phosphorylation levels according to the CRP levels of the AMI patients.Control group,n=33,AMI group,n=34.
图1 急性心肌梗死组及稳定性心绞痛组ERK5、Akt473及Akt308的磷酸化表达水平
Fig 1 The phosphorylation levels of ERK5,Akt473 and Akt308 in acute myocardial infarction (AMI) and stable angina (SA) group
A:The results of platelet aggregation induced by collagen in presence of XMD8-92 or dimethyl sulfoxide (DMSO);B:Collagen induced platelet aggregation was evaluated by the maximum platelet aggregation rate (MPAR);C:Platelet secretion of ATP was recorded in the presence of luciferin-luciferase agent.D:ATP secretion was evaluated by the maximum percentage.The quantitation was performed by Studentttest (mean±SEM,n≥3,(1)P<0.01).
图2 ERK5抑制剂对胶原诱导的人血小板聚集和分泌的影响
Fig 2 Effect of ERK5 inhibitor XMD8-92 on human platelets aggregation and ATP secretion in response to collagen

图3ERK5抑制剂对血小板铺展和栓块收缩的影响
Fig3EffectofERK5inhibitorXMD8-92onplateletspreadingandclotretraction

Washed human platelets were stimulated by collagen in the presence of XMD8-92 or DMSO,then immunoblotted with antibodies against:phosphorylated Akt473,phosphorylated Akt308,phosphorylated PTEN370,phosphorylated PTEN380 or GAPDH.
图4 XMD8-92对Akt473、Akt308、PTEN370和PTEN380磷酸化的影响
Fig 4 The phosphorylation levels of Akt473,Akt308,PTEN370 and PTEN380 affected by XMD8-92
我们进一步对PI3K/Akt信号通路中主要的调控激酶PTEN[15]磷酸化水平进行了检测。结果显示,XMD8-92对PTEN380位点磷酸化无显著影响,但对PTEN370位点磷酸化水平显著抑制,趋势和Akt磷酸化水平一致。因此,我们认为,XMD8-92通过影响PTEN370位点的磷酸化水平,进而调节PI3K/Akt信号通路的活化水平,从而调控血小板的分泌、聚集及血栓的形成。
讨 论
ERK5作为MAPK家族中的新成员,可通过磷酸化作用激活或抑制其下游靶蛋白Akt、Bad、Caspase3等,调节细胞的增殖、分化、凋亡及迁移等[16],在多种生物系统中发挥关键调节作用。近来有研究证明,其在人和血小板中也存在稳定表达,并利用动物模型证实其参与了急性心肌梗死的进展[4]。胶原与血小板的结合是动脉血栓形成起始的关键步骤。本研究显示:ERK5选择性抑制剂XMD8-92对胶原引起的血小板的聚集及致密颗粒释放呈浓度依赖性抑制作用,并显著抑制了血小板在纤维蛋白原上铺展及栓块收缩,证明ERK5在血小板活化中扮演重要角色。
PI3K/Akt是血小板活化中的重要信号调节通路,在血小板黏附、聚集、伸展等过程中均起关键调节作用。PTEN是该信号通路重要的调控激酶,而PTEN自身活性被其370及380位点的磷酸化负向调节[15]。PTEN可通过影响Akt磷酸化水平,负向调控胶原引起血小板的活化[7]。在本研究中,ERK5的抑制剂降低了PTEN 370位点的磷酸化水平,从而使PTEN活性增强,引起Akt磷酸化水平减弱,从而抑制了血小板的聚集及分泌。
研究表明,ERK5在血小板上特异性敲除,可改善冠脉结扎后小鼠心功能的恶化[4]。我们对急性心肌梗死后患者血小板ERK5的磷酸化水平进行检测,发现较稳定性心绞痛组,AMI组磷酸化水平显著增加,血小板活化重要指标Akt磷酸化水平也呈现类似趋势。结合动物模型中的研究,我们认为ERK5通过调控血小板的活化参与了急性心肌梗死的发生发展。本实验研究为将来把ERK5作为抗栓靶点提供了依据。今后尚需对其他刺激剂作用下ERK5的作用进行探索,并应进一步对其抑制剂进行在体研究。
[1] KAPLAN ZS,JACKSON SP.The role of platelets in atherothrombosis [J].HematologyAmSocHematolEducProgram,2011,2011: 51-61.
[2] 陈一竹,杨文龙,郭玲玉,等.白术内酯3抗血小板作用及其机制 [J].国际药学研究杂志,2016,43(3): 514-517.
[3] KHAMRANG T,HUNG KC,HSIA CH,etal.Antiplatelet activity of a newly synthesized novel ruthenium (II):a potential role for Akt/JNK signaling [J].IntJMolSci,2017,18(5):Pii:E916.doi:10.3390/ijms18050916.
[4] CAMERON SJ,TURE SK,MICKELSEN D,etal.Platelet extracellular regulated protein kinase 5 is a redox switch and triggers maladaptive platelet responses and myocardial infarct expansion [J].Circulation,2015,132(1): 47-58.
[5] TASK FORCE ON THE MANAGEMENT OF ST-SEGMENT ELEVATION ACUTE MYOCARDIAL INFARCTION OF THE ESC,STEG PG,JAMES SK,etal.ESC guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation [J].EurHeartJ,2012,33(20): 2569-2619.
[6] TASK FORCE M,MONTALESCOT G,SECHTEM U,etal.2013 ESC guidelines on the management of stable coronary artery disease: the Task Force on the management of stable coronary artery disease of the European Society of Cardiology [J].EurHeartJ,2013,34(38): 2949-3003.
[7] WENG Z,LI D,ZHANG L,etal.PTEN regulates collagen-induced platelet activation [J].Blood,2010,116(14): 2579-2581.
[8] FLEVARIS P,LI Z,ZHANG G,etal.Two distinct roles of mitogen-activated protein kinases in platelets and a novel Rac1-MAPK-dependent integrin outside-in retractile signaling pathway [J].Blood,2009,113(4): 893-901.
[9] CHEN X,ZHANG Y,WANG Y,etal.PDK1 regulates platelet activation and arterial thrombosis [J].Blood,2013,121(18): 3718-3726.
[10] 黄曼婷,吴焕林,徐丹苹.柚皮素通过PI3K/Akt通路拮抗血小板聚集的体外研究 [J].中国病理生理杂志,2017,33(3): 517-522.
[11] RIDKER PM,DANIELSON E,FONSECA FA,etal.Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein [J].NEnglJMed,2008,359(21): 2195-2207.
[12] AL-EJEH F,MIRANDA M,SHI W,etal.Kinome profiling reveals breast cancer heterogeneity and identifies targeted therapeutic opportunities for triple negative breast cancer [J].Oncotarget,2014,5(10): 3145-3158.
[13] LI Z,DELANEY MK,O′BRIEN KA,etal.Signaling during platelet adhesion and activation[J].ArteriosclerThrombVascBiol,2010,30(12): 2341-2349.
[14] O′BRIEN KA,STOJANOVIC-TERPO A,HAY N,etal.An important role for Akt3 in platelet activation and thrombosis [J].Blood,2011,118(15): 4215-4223.
[15] LAURENT PA,SEVERIN S,GRATACAP MP,etal.Class I PI 3-kinases signaling in platelet activation and thrombosis: PDK1/Akt/GSK3 axis and impact of PTEN and SHIP1 [J].AdvBiolRegul,2014,54: 162-174.
[16] BERA A,DAS F,GHOSH-CHOUDHURY N,etal.A positive feedback loop involving Erk5 and Akt turns on mesangial cell proliferation in response to PDGF [J].AmJPhysiolCellPhysiol,2014,306(11): C1089-C1100.
Phosphoryaltion levels of ERK5 in acute myocardial infarction patients and its role in platelet activationinvitro
GAO Wen, LI Jian, NI Huan-chun, XIE Kun, LUO Xin-ping△
(DepartmentofCardiology,HuashanHospital,FudanUniversity,Shanghai200040,China)
Objective To observe the phosphorylation levels of extracellular signal-regulated kinase 5 (ERK5) in acute myocardial infarction (AMI) patients and the effects of ERK5 selective inhibitor XMD8-92 on human platelet activationinvitro,and to explore its mechanism. Methods Western blot was applied to detect the phosphorylation levels of ERK5,Akt473 and Akt308 in AMI patients (n=34) and stable angina patients (n=33,control).The effects of different concentration of XMD8-92 on human platelet aggregation induced by collagen was tested by aggregometerinvitro.The release of ATP was measured simultaneously by luciferase detection.The effects of XMD8-92 on integrin ɑIIbβ3 were detected by platelet spreading on immobilized fibrinogen and clot retraction.The effects of XMD8-92 on phosphorylation levels of Akt473,Akt308 PTEN370 and ERK5 were detected by Western blot.Results The levels of phosphor-Akt473,Akt308 and phosphor-ERK5 were significantly higher in
AMI patients than that in control group (P<0.05).ERK5 inhibitor XMD8-92 diminished collagen-induced platelet aggregation,ATP secretion,the average area of platelet spreading on immobilized fibrinogen and the clot retraction extent.The levels of phosphor-Akt (Ser-473/Thr-308) and phosphor-PTEN (Ser370) were significantly down-regulated in the presence of XMD8-92. Conclusions ERK5 plays a role in platelet activation in AMI process.It regulates platelet activation by regulating PTEN and Akt phosphorylation. Its specific inhibitor is hoped to be new antithrombotic drug.
ERK5; platelet; thrombosis; acute myocardial infarction
国家自然科学基金(81270278);上海市科委科研计划项目(16411965600)
R543.3
A
10.3969/j.issn.1672-8467.2017.04.008
2016-12-06;编辑:王蔚)
△Corresponding author E-mail:luoxp2007@aliyun.com
*This work was supported by the National Natural Science Foundation of China (81270278) and the Scientific Research Project of Science and Technology Committee of Shanghai Municipality (16411965600).

