外周血单核细胞亚群及其趋化因子在急性冠脉综合征早期的表达特点
许苗苗 沈 伟 施海明 庄心宇 刘湘绪 欧 洋 孙晟甲 吴帮卫 朱志栋 陈羽斐
(复旦大学附属华山医院心内科 上海 200040)
外周血单核细胞亚群及其趋化因子在急性冠脉综合征早期的表达特点
许苗苗 沈 伟△施海明 庄心宇 刘湘绪 欧 洋 孙晟甲 吴帮卫 朱志栋 陈羽斐
(复旦大学附属华山医院心内科 上海 200040)
目的 探讨急性冠脉综合征(acute coronary syndrome,ACS)早期单核细胞亚群及其趋化因子即单核细胞趋化蛋白-1 (monocyte chemoattractant protein,MCP-1)和不规则趋化因子(fractalkine,FKN)的表达特点,并分析其相关性。方法 选取我院2016年9月至12月以胸痛症状入院拟行冠脉造影术(coronary angiography,CAG)的患者。手术当天术前抽取静脉血,采用流式细胞术检测外周血单核细胞(monocyte,Mon) 3个亚型的含量及其比例,依据分化抗原-14 (cluster differentiation-14,CD-14)和CD16表达分为3个亚型即CD14+CD16-Mon (Mon1)、CD14+CD16+Mon (Mon2)和CD14-CD16+Mon (Mon3);手术当天术前及术后一天抽取静脉血,ELISA检测Mon1的趋化因子MCP-1和Mon3的趋化因子FKN水平,比较不同组MCP-1-Mon1和FKN-Mon3水平变化,并分析其相关性。结果 共入选70例患者,结合其临床症状、心肌标志物、心电图、CAG检查结果进行诊断分组:急性心肌梗死(acute myocardium infarction,AMI)组患者30例、不稳定性心绞痛(unstable angina pectoris,UAP)组患者25例、CAG完全正常者(对照组) 15例。流式细胞术结果显示AMI组Mon1所占比例高于UAP组和正常对照组(P<0.05),Mon3在各组间尚无差异。AMI组患者外周血Mon3/Mon1比值低于对照组(P<0.05)。AMI组和UAP组患者FKN、MCP-1和红细胞分布宽度均高于对照组,并且FKN和Mon3具有强相关性(P<0.05;R=0.650 2)。 结论 单核细胞亚群(Mon1和Mon3)在ACS早期水平增高,并伴有其负责招募的趋化因子(MCP-1和FKN)增加,且FKN和Mon3具有强相关性,提示MCP-1-Mon1和FKN-Mon3两条通路可能参与患者ACS早期病理生理过程。
急性心肌梗死; 急性冠脉综合征; 单核细胞亚群; 单核细胞趋化蛋白-1; 不规则趋化因子
急性冠状动脉综合征(acute coronary syndromes,ACS)是以冠状动脉粥样硬化(coronary arteriosclerosis,AS)斑块破裂或糜烂、溃疡,继发血管完全或不完全闭塞性血栓形成为病理基础的一组临床综合征,包括急性心肌梗死(acute myocardium infarction,AMI)和不稳定性心绞痛(unstable angina pectoris,UAP)。AS以单核细胞(monocyte,Mon)黏附到内皮细胞并迁移至动脉壁下和脂质积累为特征[1]。
单核细胞分为三个亚型:CD14+CD16-、CD14+CD16+、CD14-CD16+,分别简称为Mon1 (炎症型)、Mon2 (中间型)、Mon3 (定居型)[2]。单核细胞在骨髓(骨髓造血系统)和脾脏(髓外造血系统)产生。Mon1首先在损伤部位积累并分化为巨噬细胞,然后吞噬脂质和胆固醇结晶变为富含脂质的泡沫细胞。Mon2功能尚不清楚。Mon3在脉管系统“巡逻”,然后进入损伤部位(数量少于Mon1)。ACS发生时的多重病理生理和交感反应最终介导了骨髓造血系统祖细胞的释放瀑布,也是心梗后激活骨髓的过程[3]。动物实验已证实,Mon1依赖单核细胞趋化蛋白-1 (monocyte chemoattractant protein,MCP-1)与其表面受体结合,募集并黏附到血管内皮细胞,引起炎性反应并促进粥样斑块形成,同时Mon1可在急性心肌梗死发生后发挥清除坏死心肌残骸的作用[3];Mon3依赖不规则趋化因子(fractalkine,FKN)募集到血管损伤部位,可促进斑块内血管新生从而促进斑块的破裂、糜烂和血栓形成,导致冠状动脉完全或不完全闭塞[2],同时Mon3可在AMI后的增殖修复阶段促进缺血心肌血管新生和重建。
然而,国内外关于人的单核细胞亚群在ACS患者外周血中水平的研究很少,尚未有以单核细胞在外周血的趋化及招募为切入点的研究。临床试验已证实ACS患者血浆中FKN表达上调会促使AS斑块不稳定的风险指标升高[4]。动物实验表明,依赖单核细胞不同亚型分化水平及其趋化因子FKN和MCP-1介导的信号招募机制,单核细胞亚群比例和分布在ACS中发挥重要作用。为进一步研究在人体内,ACS早期阶段MCP-1-Mon1和FKN-Mon3的水平及相关性,本临床试验首次同步检测MCP-1-Mon1和FKN-Mon3的表达特点,对单核细胞亚群及其趋化因子在ACS早期的诊断具有很强的临床意义。
资 料 和 方 法
研究对象 连续收集2016年9月至12月在复旦大学附属华山医院心内科以胸痛症状就诊,并拟行冠脉造影术(coronary angiography,CAG)的住院患者。按照入选标准将患者分为AMI组、UAP组和对照组。入选标准:年龄小于85岁拟行CAG术者,UAP诊断标准参照美国心脏病学会/美国心脏协会(AHA/AHA)2007年诊断指南[5],AMI诊断标准参照2012年AHA/AHA/ESC/WHF联合发布的第3版《全球心肌梗死新定义》[6],有胸痛症状而CAG完全正常为对照组。排除标准:合并先天性心脏病、扩张型心肌病、瓣膜性心脏病、Killip分级Ⅲ-Ⅳ级、肝脑肾重要器官功能障碍、血液系统疾病、结缔组织疾病、肿瘤的患者。
临床常规检测 研究方案经复旦大学附属华山医院伦理委员会批准(伦理审查号:KY2015-244),所有入组患者签署知情同意书,分别于CAG当天术前(-0 d)和术后1天(+1 d)晨起6:00空腹抽取静脉全血(需急诊PCI患者术前临时抽血),后序血样本检测在2 h内进行。其中,-0 d全血2 mL用于流式细胞术检测外周血单核细胞亚群,-0 d和+1 d全血4 mL经792×g离心5 min后,上层血浆用于ELISA检测MCP-1和FKN。常规测肌钙蛋白T (troponin T,cTnT)、肌酸激酶MB型同工酶(creatine kinase isoenzyme-MB,CK-MB)、肌红蛋白(myoglobin,MYO)、尿酸(uric acid,UA)。 常规检测外周血中性粒细胞(neutrophil,N)比例、淋巴细胞(lymphocyte,L)比例、单核细胞(monocyte,M)比例、红细胞分布宽度(red cell distribution width,RDW)、血小板平均体积(mean platelet volume,MPV)、胆固醇(total cholesterol)、三酰甘油(triglyceride,TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、超敏C反应蛋白(high-sensitivity C-reactive protein,Hs-CRP)水平。记录所有患者CAG检查结果,包括GENSINI评分和冠状动脉各支病变情况:左冠状动脉(left anterior descending,LAD)、左主干动脉(left main coronary artery,LM)、右冠状动脉(right coronary artery,RCA)、左室后支(posterior branch of left ventricle,PBLV)、左旋支(left circumflex,LCX)、钝缘支(obtuse marginal,OM)、对角支(diagonal branches,DI)。
主要试剂与设备 异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记鼠抗人CD14、别藻青蛋白(allophycocyanin,APC)标记鼠抗人CD16、PBS 缓冲液、淋巴细胞分离液(美国BD公司);人CX3CL1/FKN ELISA试剂盒,(R&D Cat:DCX310)和人CCL2/MCP-1 ELISA试剂盒(R&D Cat:DCP00)(美国R&D公司)。TRIzol试剂(INVITROGEN公司),逆转录试剂(日本Takara公司),PCR试剂(国药集团),引物合成由上海右升生物科技有限公司完成。
流式细胞术检测外周血单核细胞亚群
提外周血单个核细胞 取2 h内新鲜抽取的晨起空腹外周静脉血2 mL,EDTA抗凝,792×g离心5 min,将下层血细胞(约1 mL)用1 mL 1×PBS稀释1倍,轻轻吹打,将2 mL血细胞稀释液加入含2 mL淋巴细胞分离液的15 mL离心管中,静置2 min。792×g设置缓升缓降离心20 min。离心后血细胞清晰分为4层,上层为血浆层,中层为分离液层,用吸管将两者之间薄层云雾状的外周血单个核细胞(peripheral blood mononuclear cell,PBMC) PBMC层轻轻吸出,并收集到1.5 mL EP管中。
洗涤并染色 将PBMC用PBS缓冲液1 mL洗涤,792×g离心5 min;重复洗涤、离心1次,以 100 μL PBS 缓冲液重悬细胞。加入 20 μL CD14-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)、5 μL CD16-别藻青蛋白(allophycocyanin,APC)单克隆抗体 ,振荡混匀,避光室温下孵育15 min;300×g离心5 min,弃上清;PBS 缓冲液1 mL洗涤;后重悬细胞。
检测方法 前向角散射光(forward scatter,FSC)和侧向角散射光(side scatter,SSC)双参数点图检测外周血各群细胞;以 FSC为横坐标,SSC为纵坐标,建立FSC和SSC 散点图,正向设门法圈出单核细胞群(图 1 A);根据单核细胞上CD14 和 CD16 表达 水平分为CD14+CD16-Mon (Mon1)、CD14+CD16+Mon (Mon2)及 CD14-CD16+Mon (Mon3) 3个亚群(图1 B);用 Cell Quest和BD Accuri C6软件获取并分析数据。
ELISA检测血浆FKN和MCP-1表达水平 将新鲜抽取的晨起空腹外周静脉血4 mL,792×g离心5 min,取上层血浆置于2个1.5 mL EP管中,-80 ℃冷冻。其中一管按照人CX3CL1/FKN ELISA试剂盒(R&D Cat:DCX310)操作检测FKN:依次加100 μL Assay Diluent RD1-88到每孔;分别加100 μL标品、样本和空白对照到适当的孔内,贴膜,4 ℃孵育3 h;洗脱:PBS洗3次,第4次洗完后,充分拍干出去孔内液体;加200 μL预冷指示剂人的FKN 结合到每个孔,封膜,4 ℃孵育3 h;重复洗脱步骤;每孔加200 μL 底物显色剂,室温30 min避光孵育;每孔加50 μL 终止液,充分反应,颜色从蓝逐渐变黄,在450 nm下测定吸光度值。同样,另一EP管血浆用于检测MCP-1,按人CCL2/MCP-1 ELISA试剂盒(R&D Cat:DCP00)操作在450 nm下测定吸光度值(D)。

A:FSC/SSC(forward scatter/sideward scatter) dot-plot,show every peripheral blood cell population.M:Square micron.B:Monocytes were gated in a FSC/SSC dot-plot.CD14+CD16-Mon,CD14-CD16+Mon and CD14+CD16+Mon were defined according to the expression levels of CD14 and CD16 in monocytes.
图1 流式细胞术检测单核细胞亚群
Fig 1 Flow cytometry analysis monocyte subgroups
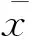
结 果
一般资料 本临床试验共入选70例患者,其中AMI组30例,年龄(65.04±2.48)岁;UAP组25例,年龄(66.41±2.30)岁;有胸痛症状而CAG完全正常者(对照组) 15例,年龄(65.64±1.43)岁。性别、高血压、糖尿病、血脂、血常规、冠状动脉病变支数等资料见表1。
临床与实验室检查AMI组RDW为12.86±0.380,UAP组RDW为12.12±0.410,明显高于正常对照组18.22±3.455,差异有统计学意义(P<0.05,表1)。AMI组术后心肌标志物(包括cTnT、MYO、CK-MB)均高于其他两组(P<0.05,表1)。冠脉病变血管支数(简写为NumberdCV)AMI组(2.077±0.175)和UAP组(1.632±0.205)均高于正常对照组(P<0.05,表1),而AMI、UAP两组之间差异无统计学意义。

表1 不同组别患者一般临床资料与实验室数据的组间比较
(1)P<0.05,AMI groupvs.UAP group;(2)P<0.05,AMI groupvs.control group;(3)P<0.05,UAP groupvs.control group.
单核细胞亚群水平 AMI组Mon1百分比最高(0.615 5± 0.066 8),与UAP组(0.357 5±0.057 4)和对照组(0.390 5±0.078 9)比较差异有统计学意义(P<0.05,t=2.908,t=2.189,图2 A )。但UAP组和对照组两组间差异无统计学意义。Mon3百分比水平同样在AMI组中最高,但Mon3在3组间差异尚无统计学意义。AMI组患者Mon3/Mon1比值(0.677 5±0.205 5)低于UAP组(1.178± 0.247 0)和对照组(1.599±0.530 9),差异有统计学意义(P<0.05,t=2.972,图 2 B)。结果提示Mon1比例早期即会快速上升,Mon3比例也有所上升,但升高幅度低于Mon1。提示斑块不稳定时Mon1已经升高,而Mon3升高尚不明显。
趋化因子水平 AMI组患者血浆MCP-1水平(130.0±10.14)明显高于对照组(99.70±7.552)且差异有统计学意义(P<0.05,t=2.401,图2 C);UAP组MCP-1水平(119.6±7.960)高于对照组(P=0.085,t=1.751,图2 C),AMI组UAP组间MCP-1水平差异无统计学意义。AMI组患者血浆FKN水平(0.329 6±0.033 0)高于正常对照组(0.024 73±0.025 7)(P=0.051 2,t=1.995,图2 D),UAP组血浆FKN水平(0.368 6±0.0276)明显高于对照组(P<0.05,t=3.196,图2 D)。AMI组FKN水平与UAP组水平相比差异无统计学意义。提示ACS时,Mon1与Mon3所对应的血浆趋化因子水平均会升高,从而发挥招募相应单核细胞的功能。
相关性分析 FKN与Mon3比例、单核细胞、淋巴细胞呈正相关(P<0.05,表2),FKN的受体CX3CR1不仅在Mon3上表达,同时在淋巴细胞等PBMC上少量表达,FKN与单核细胞百分比和淋巴细胞百分比呈正相关。FKN同时与CK-MB和LDL-C呈正相关(P<0.05,表2)。FKN与RDW和TG呈负相关,FKN与TG和RDW呈负相关(P<0.05,表2)。而Mon1、 Mon3、 MCP-1、GENSINI评分与各指标间未发现明显相关性。
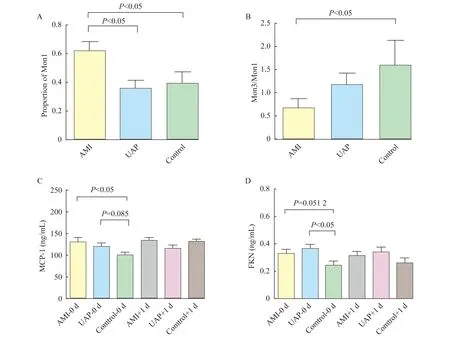

图2 单核细胞亚群及其趋化因子在AMI、UAP和Control组间的水平比较
FKN:Fractalkine;Mon3:Monocyte3;M:Monocyte;L:Lymphocyte;CK-MB:Creatine kinase isoenzyme MB;TG:Triglyceride;LDL-C:Low-density lipoprotein-cholesterol;HDL-C:High-density lipoprotein-cholesterol;RDW:Red cell distribution width.
讨 论
本研究检测了ACS患者CAG术前单核细胞亚群含量及比例,及术前和术后趋化因子水平,旨在探讨MCP-1-Mon1和FKN-Mon3两条逻辑线在ACS组中相对CAG正常组的变化及其相关性。首次证明Mon1在AMI组中所占比例明显高于UAP组和对照组,并证明AMI患者Mon3/Mon1比例降低;还发现MCP-1在ACS组中增加,提示Mon1通过MCP-1途径被募集到AS炎症部位和心肌梗死部位,促进斑块不稳定和清除坏死物质;同时发现FKN在ACS组中均增加,提示FKN表达增加可通过募集Mon3,发挥促斑块破裂并诱发ACS的作用。FKN与Mon3呈正相关(P<0.05,r=0.650 2),验证了其招募关系。ACS早期以趋化因子增高为主,可能与单核细胞亚群分化尚且滞后有关。
动物实验已证实MCP-1-Mon1和FKN-Mon3在ACS中发挥作用的靶点主要有2个微环境(动脉粥样斑块中和梗死的心肌组织中)和4个阶段(AS斑块慢性缺氧阶段、AS斑块炎症阶段、心肌梗死后的炎症阶段、缺血心肌的增殖修复阶段),且其在ACS发生发展中的作用随不同微环境和不同发展阶段而变化[3]。在AS斑块慢性炎症阶段和心肌梗死后的炎症阶段,血管内皮细胞和心肌细胞以表达MCP-1为主,募集Mon1占优势,发挥促炎作用。而在AS斑块慢性缺血缺氧阶段和缺血心肌的增殖修复阶段,血管内皮细胞或心肌细胞由表达MCP-1转变为表达FKN,后者介导Mon3募集到损伤部位,与淋巴细胞、肥大细胞等代替早期的Mon1,并通过分泌IL-10、纤维生长因子等发挥抗炎作用,并促进血管新生、成纤维细胞增殖及胶原纤维沉积,心脏组织修复[7]。但是,斑块内的血管新生可促进无症状纤维粥样斑块变为易破裂的易损斑块[3],易增加斑块破裂的风险,MCP-1-Mon1通过此途径发挥促进斑块不稳定的不良效果。既往国外关于单核细胞亚群或趋化因子的基础和临床研究结果还未达成一致结论[8-12]。有研究证实敲除兔的MCP-1基因可降低易损斑块破裂风险[13]。Ikejima等[14]证明FKN表达上调可促进UAP患者斑块破裂,这些发现均与本研究结果相符。
本临床试验首次同步研究了ACS早期阶段MCP-1-Mon1和FKN-Mon3的表达特点及相互关系,对根据单核细胞亚群及其趋化因子的表达特点早期诊断ACS具有很强的前瞻性意义。MCP-1和FKN招募不同单核细胞亚群到不同微环境并发挥相应功能,本实验检测结果提示人周血单核细胞亚群及其相应趋化因子二者的表达时程相一致,并且在ACS组中均有增加趋势,因而推测MCP-1-Mon1和FKN-Mon3在ACS中可能发挥很大的作用。
另外,在AS斑块慢性缺氧环境和梗死的心肌组织中,Mon3是通过FKN-CX3CR1-RhoA信号[2]通路促进微环境内血管新生的[15]。而在心肌梗死后,与Mon1早期即开始增加不同,Mon3在心梗发生2周后才显著增加[9],并且单核细胞分化与极化的平衡对心梗后心脏修复的影响应进行进一步的基础和临床研究[16]。
RDW反映红细胞体积的变异程度。凡是可以影响到红细胞成熟的病理因素均可导致RDW升高。AS和ACS中的炎性反应亦会进一步抑制红细胞成熟。由于AS与氧化应激、炎性反应密切相关。因此RDW在ACS中升高具有合理性[17]。
本研究病例样本量偏小,属于单中心横断面研究。今后我们将继续增加样本并进一步延长随访时间,增加观察时间点,动态评估MCP-1-Mon1和FKN-Mon3的变化情况及其对ACS患者预后的影响。在缺血心肌和动脉粥样硬化斑块两种微环境中,单核细胞及其趋化系统的表达时间和空间的差异需要后期更多的研究和探索。
[1] PIETSCH A,ERL W,LORENZ RL.Lovastatin reduces expression of the combined adhesion and scavenger receptor CD36 in human monocytic cells[J].BiochemPharmacol,1996,52(3):433-439.
[2] 许苗苗,沈伟,施海明.单核细胞在冠心病发生和发展中的作用研究进展[J].中华心血管病杂志,2016,44(4):357-360.
[3] JAIPERSAD AS,LIP GY,SILVERMAN S,etal.The role of monocytes in angiogenesis and atherosclerosis[J].JAmCollCardiol,2014,63(1):1-11.
[4] SWIRSKI FK,NAHRENDORF M.Leukocyte behavior in atherosclerosis,myocardial infarction,and heart failure[J].Science,2013,339(6116):161-166.
[5] ANDERSON JL,ADAMS CD,ANTMAN EM,etal.ACC/AHA 2007 guidelines for the management of patients with unstable angina/non ST-elevation myocardial infarction:a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the 2002 Guidelines for the Management of Patients With Unstable Angina/Non ST-Elevation Myocardial Infarction):developed in collaboration with the American College of Emergency Physicians,the Society for Cardiovascular Angiography and Interventions,and the Society of Thoracic Surgeons:endorsed by the American Association of Cardiovascular and Pulmonary Rehabilitation and the Society for Academic Emergency Medicine[J].Circulation,2007,116(7):e148-e304.
[6] THYGESEN K,ALPERT JS,JAFFE AS,etal.Third universal definition of myocardial infarction[J].EurHeartJ, 2012,33(20):2551-2567.
[7] HEUSCH G,LIBBY P,GERSH B,etal.Cardiovascular remodelling in coronary artery disease and heart failure[J].Lancet,2014,383(9932):1933-1943.
[8] ZHU L,YIN Y,ZHOU R,etal.Changes of monocyte subsets in patients with acute coronary syndrome and correlation with myocardial injury markers[J].IntJClinExpPathol,2015,8(6):7266-7271.
[9] LIEHN EA,POSTEA O,CURAJ A,etal.Repair after myocardial infarction,between fantasy and reality:the role of chemokines[J].JAmCollCardiol,2011,58(23):2357-2362.
[10] LATET SC,HOYMANS VY,VAN HERCK PL,etal.The cellular immune system in the post-myocardial infarction repair process[J].IntJCardiol,2015,179:240-247.
[11] MARTIN-REYES R,FRANCO-PELAEZ JA,LORENZO O,etal.Plasma levels of monocyte chemoattractant protein-1,n-terminal fragment of brain natriuretic peptide and calcidiol are independently associated with the complexity of coronary artery disease[J].PLoSOne,2016,11(5):e152816.
[12] CETIN MS,CETIN E,KALENDER E,etal.Monocyte to HDL cholesterol ratio predicts coronary artery disease severity and future major cardiovascular adverse events in acute coronary syndrome[J].HeartLungCirc,2016,25(11):1077-1086.
[13] ZHONG L,CHEN WQ,JI XP,etal.Dominant-negative mutation of monocyte chemoattractant protein-1 prevents vulnerable plaques from rupture in rabbits independent of serum lipid levels[J].JCellMolMed,2008,12(6A):2362-2371.
[14] IKEJIMA H,IMANISHI T,TSUJIOKA H,etal. Upregulation of fractalkine and its receptor,CX3CR1,is associated with coronary plaque rupture in patients with unstable angina pectoris[J].CircJ,2010,74(2):337-345.
[15] KUMAR AH,MARTIN K,TURNER EC,etal.Role of CX3CR1 receptor in monocyte/macrophage driven neovascularization[J].PLoSOne,2013,8(2):e57230.
[16] VAN DER LAAN AM,TER HORST EN,DELEWI R,etal.Monocyte subset accumulation in the human heart following acute myocardial infarction and the role of the spleen as monocyte reservoir[J].EurHeartJ,2014,35(6):376-385.
[17] DOGDU O,KOC F,KALAY N,etal.Assessment of red cell distribution width (RDW) in patients with coronary artery ectasia[J].ClinApplThrombHemost,2012,18(2):211-214.
Characteristic of peripheral blood monocyte subsets and chemokines in early stage of acute coronary syndrome
XU Miao-miao, SHEN Wei△, SHI Hai-ming, ZHUANG Xin-yu, LIU Xiang-xu,OU Yang, SUN Sheng-jia, WU Bang-wei, ZHU Zhi-dong, CHEN Yu-fei
(DepartmentofCardiovascularMedicine,HuashanHospital,FudanUniversity,Shanghai200040,China)
Objective To investigate the expression of monocyte subsets and their chemokine,i.e.,monocyte chemoattractant protein (MCP-1) and fractalkine (FKN), in patients with acute coronary syndrome (ACS),and to analyze their correlation. Methods Patients with the syndrome of pectoralgia and to be inspected with coronary angiography (CAG) in our hospital from Sep.to Dec.,2016 were included.Patients’ venous blood was collected on the operation day before operation,the level and proportion of monocyte (Mon) subsets,which was namely CD14+CD16-Mon (Mon1),CD14+CD16+Mon (Mon2) and CD14-CD16+Mon (Mon3) according to the expression of cluster differentiation-14 (CD14) and CD16,were detected by flow cytometry (FCM).Patients’ venous blood was collected on the operation day before operation and one day after operation,the concentrations of MCP-1 and FKN in plasma were measured by ELISA.We compared the expression levels of MCP-1-Mon1 and FKN-Mon3,and analyzed their relationship between each other respectively in different groups. Results Diagnosed according to the clinical symptoms,myocardial markers,electrocardiogram and CAG results,70 individuals were analyzed,including 30 patients with acute myocardial infarction (AMI group),25 patients with unstable angina pectoris (UAP group) and 15 patients with the chest pain symptoms and normal CAG results (control group).The percentage of Mon1 in the AMI group was higher than that in the other groups (P<0.05);no difference was observed for Mon3 among the groups (P>0.05).The Mon3/Mon1 ratio in the AMI group was lower than that in the control group (P<0.05).Moreover,the levels of FKN and MCP-1 in the ACS group were greater than those in the control group.The level of red blood cell distribution width (RDW) was significantly increased in the AMI and UAP group than that in the control group (P<0.05).There was a significant correlation between FKN and Mon3 (P<0.05,R=0.650 2). Conclusions The monocyte subset of Mon1 and Mon3 increased in the early stage of ACS,with their chemokine (FKN and MCP-1) increasing at the same time.There is a significant correlation between FKN and Mon3,which indicates MCP-1-Mon1 and FKN-Mon3 may participate in the pathophysiological process of early ACS in patients.
acute myocardium infarction; acute coronary syndromes; monocyte subsets; monocyte chemoattractant protein-1; fractalkine
上海市卫计委中医药科研基金(2014JZ006A);上海市科委科研计划项目中医类引导项目(15401932000);国家自然科学基金面上项目(81673701,81573711)
R541.4
A
10.3969/j.issn.1672-8467.2017.04.002
2017-01-19;编辑:张秀峰)
△Corresponding author E-mail:drshenwei@aliyun.com
*This work was supported by the Traditional Chinese Medicine Research Fund from Shanghai Municipal Commission of Health and Family Planning (2014JZ006A),Science and Technology Program of Traditional Chinese Medicine Guidance Project from Science and Technology Committee of Shanghai (15401932000) and the General Program of National Natural Science Foundation of China (81673701,81573711).

