评估0.1 mm PTFE生物相容性的新西兰兔实验模型
张惠锋 叶 明 闫宪刚 陈 纲 陶麒麟 贾 兵
(复旦大学附属儿科医院心血管中心 上海 201102)
评估0.1 mm PTFE生物相容性的新西兰兔实验模型
张惠锋 叶 明 闫宪刚 陈 纲 陶麒麟 贾 兵△
(复旦大学附属儿科医院心血管中心 上海 201102)
目的 建立评估0.1 mm聚四氟乙烯(polytetrafluoroethylene,PTFE)新型肺动脉瓣材料生物相容性实验的新西兰兔实验模型。方法 选取42只3 kg左右的新西兰成年兔,应用氯胺酮35 mg/kg和右旋美托咪啶0.25 mg/kg肌注麻醉,部分上段开胸,右心室流出道预置荷包,0.1 mm PTFE瓣膜材料经荷包中央小切口植入右心室,收紧荷包并打结完成操作,术后给予吸氧监护直至完全清醒。结果 42只新西兰成年兔接受了手术,死亡6只,其中2只死于麻醉药物的探索阶段,1只死于术后气胸,其余3只分别于术后5天、7天和8天死亡。经解剖发现植入瓣膜材料周围有血栓形成,调整术后抗凝治疗方案后无死亡发生。其余36只新西兰成年兔体重增长,完成整个实验过程。结论 新西兰兔适合作为0.1 mm PTFE瓣膜材料生物相容性研究的动物模型,优点是避免了气管插管和体外循环,气胸发生率低。
心瓣膜; 生物相容性; 聚四氟乙烯; 新西兰兔
0.1 mm PTFE能否作为新型肺动脉瓣的瓣膜材料,首先要评估0.1 mm PTFE的生物相容性,而评估生物相容性的关键是建立适合的动物模型。所谓适合的动物模型就是要尽量接近和模拟人体内环境。根据本实验的目的,需要将瓣膜材料植入右室流出道或者肺动脉中,常用的皮下包埋法[1]显然无法满足本实验的要求。而以往心脏实验对象多采用猪犬羊等大型哺乳动物,不仅需要开胸手术、气管插管和机械通气[2-3]、甚至体外循环,还需要大型的实验仪器和专业人员的配合;术后面临着循环呼吸功能不全、气胸、出血等问题[4],严重影响实验后动物的生存率。当前,实验动物日趋小型化,我们选择新西兰成年兔作为实验对象,并探索实验方法,建立瓣膜材质生物相容性的动物实验模型,并完成评估。
材 料 和 方 法
实验材料 本实验所用0.1 mm PTFE薄片由美国戈尔公司提供,复旦大学附属儿科医院动物实验房提供实验场所、实验操作台、消毒手术器械以及缝线等。所用药物氯胺酮由福建古田药业有限公司生产,右美托嘧啶针剂由江苏恩华药业股份有限公司生产,肝素针剂由山东枣庄赛诺康生化股份有限公司生产,阿司匹林片剂由安徽东盛制药有限公司生产。
实验对象 42只3 kg左右的新西兰成年兔由上海市青浦动物饲养站提供,均具备动物检疫合格证。
实验步骤 取3 kg左右的新西兰成年兔,采用氯胺酮35 mg/kg和右旋美托咪啶0.25 mg/kg肌注麻醉。麻醉生效后,将新西兰兔四肢固定于动物操作台上,胸部朝上,给予鼻罩吸氧。剪除颈部和胸骨上部的兔毛,常规消毒铺巾后,自胸骨上凹起始纵形正中切开胸部上1/3皮肤,小心钝性分离胸骨后间隙,紧贴胸骨左缘剪断第1~3肋骨,如果出现肋间动脉出血,可给予5-0聚丙烯缝线缝扎。应用胸骨撑开器撑开胸骨,暴露心包,剪开上部心包,显露肺总动脉和右心室流出道表面。静脉给予肝素1 mg/kg后,在右心室流出道预置荷包,在荷包中央切开一小口,同时拉紧荷包控制出血,在8 mm×3 mm的0.1 mm PTFE薄片尾端预置5-0聚丙烯缝线,前端通过切口塞入右心室,收紧荷包并打结,将薄片尾端固定于右心室表面,缝合肋骨,逐层缝合肌层和皮肤。术后给予吸氧监护直至完全清醒,一般需要2~3 h (图1、2)。
术前应用头孢类抗生素每天1次,每次100 mg/kg,术后连续应用3天。自术后第1天起连续7天给予肝素1 mg/kg皮下注射,每天1次,此后改为阿司匹林5 mg/kg口服,每天1次。
结 果
42只新西兰成年兔全部接受了手术,死亡6只,均发生于实验早期,即实验的探索阶段,究其原因如下:
麻醉 麻醉是动物模型建立成功的前提,由于无气管插管和机械辅助通气,同时需要剪断部分肋骨,对于麻醉要求高。本组中因麻醉死亡2只,分别应用25%乌拉坦4 mL/kg肌注+10%水合氯醛腹腔内注射,氯胺酮35 mg/kg+咪唑安定0.2 mg/kg肌注[5-7],均无法达到手术要求,在增加药物过程中出现呼吸抑制而死亡。直至采用氯胺酮35 mg/kg和右旋美托咪啶0.25 mg/kg肌注[8],可以维持麻醉2~3 h,对呼吸几乎无影响,同时镇痛效果好,完全耐受切皮,剪断肋骨,牵拉心脏等刺激,符合本实验的要求。
气胸 1只新西兰兔在术后苏醒期间死亡,手术后主要表现为气促和吸凹,考虑为气胸所致。在钝性分离胸骨后间隙时,由于分离过广,容易损伤左侧胸膜,造成左侧气胸。因此,在分离胸骨后间隙时尽量小心仔细,不需要过多分离,避免气胸。
血栓形成 3只新西兰兔分别于术后5天、7天和8天死亡,经解剖发现伤口及纵隔均无感染,打开右心室发现植入的材料周围有血栓形成(图3)。可能与抗凝治疗不足有关,手术当日肝素皮下注射,第2天开始口服阿司匹林,将其溶于饮水中。但是术后早期新西兰兔仍存在进食不佳等术后不良反应,故口服阿司匹林并未起到有效的抗凝作用。此后调整抗凝方案,在术后应用肝素1 mg/kg,每天1次肌注,1周后再改用阿司匹林口服,未再发生死亡。

A:The one third upper skin was opened and the first,second and third rib were divided closely to the left edge of the stern. B:The main pulmonary artery and right ventricle was exposed after the pericardium was incised.C:Suture line was put to the surface of right ventricular outflow tract.D:A small hole was made in the middle of suture line with the blade. E:The 0.1 mm PTFE strip was put into the right ventricle through the small hole.F:The suture line was tightened.RVOT:Right ventricular outflow tract.
图1 瓣膜材料(0.1 mm PTFE)植入示意图
Fig 1 The diagram of valve material (0.1 mm PTFE) implantation
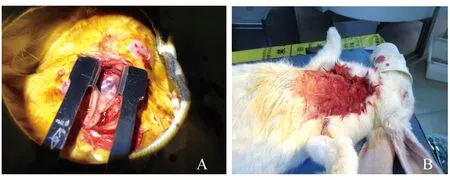
A:Exposure for pulmonary artery and right ventricular flow tract;B:Accomplished.
图2 新西兰兔模型
Fig 2 The model of New Zealand rabbit
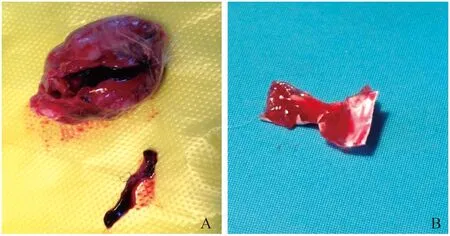
A:Thrombosis was detected inside right ventricle;B:Thrombosis was detected on the surface of 0.1 mm PTFE.
图3 死亡新西兰兔的解剖探查
Fig 3 Anatomical detection of the dead rabbits
讨 论
近年来,新西兰兔越来越多地应用于心脏动物模型的研究[9-10],源于其成本低、温顺易饲养和存活率高的特点。我们经过不断摸索,选择新西兰兔来作为心脏实验的动物模型,应用部分开胸,通过0.1 mm PTFE瓣膜材料植入的方法来评估其作为肺动脉瓣膜的生物相容性,相比于传统的动物模型具有明显优势。
我们将0.1 mm PTFE植入于新西兰兔右心室流出道来模拟人体右心系统血流环境。传统的材料相容性研究多采用小鼠为实验对象,并采用皮下包埋的方式进行[11]。虽然手术简单,但是其结果无法真实反映瓣膜材料在搏动性血流中的相容性程度。然而,在右心系统环境中血流相对缓慢、压力低、未氧合血流的血黏度较高,这些都是包埋手术所无法模拟的。主流的动物模型采用猪、犬、羊等偏大型的哺乳动物,不仅手术创伤大,而且容易损伤胸膜,死亡率高,多数需要气管插管及呼吸机正压通气[12]。由于动物的口腔深,气道开口偏上靠后,给气管插管带来极大的难度,部分动物因反复气管插管造成气道出血或穿孔而死亡。采用气管切开插管的方法,虽然解决了经口腔插管面临的难题,但是多数动物在实验后不能存活,显然不适用本研究的要求。
部分开胸的尝试 完全开胸会极大影响实验动物的呼吸,同时极易损伤胸膜从而造成气胸,需要气管插管来维持呼吸,增加了实验难度。能否部分切开胸骨,尽量避免对呼吸的影响?本实验目的是为了评估和筛选肺动脉瓣的瓣膜材料,主要手术范围局限于右心室流出道,而并不需要完全显露整个心脏,这使部分开胸[13]的设想成为可能。因此,我们初步设想从胸骨上凹处起始纵形切开上1/3胸骨。但是,新西兰兔的胸骨非常狭窄,凸起而坚硬,很难按照传统心脏手术从胸骨中央剪开。我们采用贴近胸骨剪断肋骨的办法,切断第1~3肋骨,能更好地显露右心室流出道,同时可以避开胸膜,降低气胸的发生。
右心室流出道荷包法植入 传统切开右心室或者肺动脉血管来放置0.1 mm PTFE瓣膜材料的方法会导致较多出血,而且需要体外循环。而预置荷包能够控制出血,避免了体外循环,很好地解决了这个问题。初期我们选择在主肺动脉处预置荷包,但是由于新西兰兔的肺动脉壁极其薄,荷包预置造成的针眼出血无法控制。因此我们选择右心室流出道,该处为心肌裸区,无冠状动脉分布。预置荷包操作简单,无明显出血。同时,我们将0.1 mm PTFE裁剪成8 mm×3 mm的长方形便于植入,并在尾端预置5-0聚丙烯缝线,植入后将瓣膜材料固定于右心室,避免植入后脱落造成肺动脉栓塞。
抗凝治疗的调整 初期应用肝素皮下注射1天,口服阿司匹林替代的抗凝治疗并未达到很好的效果,3只新西兰兔死于血栓。据报道相比于人类,新西兰兔具有更加亢进的凝血功能[14],纤维蛋白原含量和血黏度高。同时右心系统存在压力低、血流相对缓慢、未氧合血中增加了血液的黏稠度,更易发生血栓。我们发现在术后3天内新西兰兔食欲减退,饮水少,不能完成阿司匹林的口服剂量。因此,我们调整了抗凝方案,给予肝素1 mg/kg皮下注射,每天1次,1周后改为口服阿司匹林,未再发生新西兰兔死亡。
当前,实验动物模型日趋小型化,许多学者通过改良实验模型,创造实验条件,在小动物实验中完成了模型的建立,取得了良好的效果,降低了实验的成本。但是,心脏实验模型仍然多采用较大型的哺乳动物。我们通过不断尝试和探索,应用成年新西兰兔,采用部分开胸和右心室荷包植入的方法,避免了气管插管、体外循环和气胸的发生。我们应用该动物模型来评估0.1 mm PTFE瓣膜材料的生物相容性,并可以用于其他右心室植入手术的实验研究,例如经右心室肺动脉瓣支架植入的实验等,具有较广阔的应用前景。
[1] 汪钢,张其清,赵东鄂,等.胶原膜与聚-β-羟基丁酯在组织工程心脏瓣膜中应用的研究[J].中国危重病急救医学,2001,13(6):342-344.
[2] CHEN Z,ZHENG J,ZHANG J,etal.A novel bioabsorbable pericardial membrane substitute to reduce postoperative pericardial adhesions in a rabbit model[J].InteractCardiovascThoracSurg,2015 ,21(5):565-572.
[3] ZHOU J,LIWSKI RS,ELSON C,etal.Reduction in postsurgical adhesion formation after cardiac surgery in a rabbit model using N,O-carboxymethyl chitosan to block cell adherence[J].JThoracCardiovascSurg,2008 ,135(4):777-783.
[4] SCHMIDT MR,STOTTRUP NB,MICHELSEN MM,etal.Remote ischemic preconditioning impairs ventricular function and increases infarct size after prolonged ischemia in the isolated neonatal rabbit heart[J].JThoracCardiovascSurg,2014,147(3):1049-1055.
[5] 周昆,屈彩芹.动物实验常用麻醉剂的比较与选择[J].实验动物科学,2008,25(2):41-43.
[6] 张银,高莹,黄锦,等.氯胺酮分别联合异丙嗪、戊巴比妥钠和水合氯醛药物用于兔麻醉效果的比较与评价[J].医学研究生学报,2013,26(12):1241-1243.
[7] 郑占乐,潘进社,马利杰,等.实验兔血管外科手术不同麻醉药物的比较[J].河北医科大学学报,2008,29(3):384-387.
[8] BICER M,BAYRAM AS,GURBUZ O,etal.Assessment of the efficacy of bio-absorbable oxidized regenerated cellulose for prevention of post-operative pericardial adhesion in the rabbit model[J].JIntMedRes,2008,36(6):1311-1318.
[9] FENG J,BIANCHI C,SANDMEYER JL,etal.Bradykinin preconditioning improves the profile of cell survival proteins and limits apoptosis after cardioplegic arrest[J].Circulation,2005,112(9 Suppl):1190-1195.
[10] PRITZWALD-STEGMANN P,HOYER A,KEMPFERT J,etal.Cardioprotective effects of low-dose cyclosporin A added to histidine-tryptophan-ketoglutarate cardioplegia solution prior to total myocardial ischemia:aninvitrorabbit heart study[J].Pharmacology,2011,88(3-4):167-173.
[11] 简旭华,张镜方,胡平,等.组织工程心脏瓣叶皮下包埋实验[J].南方医科大学学报,2006,26(5):573-575.
[12] COLAK N,NAZLI Y,ALPAY MF,etal.Effect of topical N-acetylcysteine in the prevention of postoperative pericardial adhesion formation in a rabbit model[J].CardiovascPathol,2013,22(5):368-372.
[13] 薛枫,杨向军,李勋,等.兔在体心脏缺血再灌注模型的制作方法的改进[J].中国比较医学杂志,2010,20(2):51-53.
[14] MAZER CD,LEONG POI H,CHHINA T,etal.Recombinant factor VIIa affects anastomotic patency of vascular grafts in a rabbit model[J].JThoracCardiovascSurg,2011,142(2):418-423.
A novel experimental model of New Zealand rabbit for the biocompatible assessment of 0.1 mm PTFE
ZHANG Hui-feng, YE Ming, YAN Xian-gang, CHEN Gang, TAO Qi-lin, JIA Bing△
(DepartmentofCardiovascularSurgery,Children’sHospital,FudanUniversity,Shanghai201102,China)
Objective To establish a novel experimental model of New Zealand rabbit to assess the biocompatibility of 0.1 mm polytetrafluoroethylene (PTFE),a novel material of pulmonary valve.Methods Forty-two adult New Zealand rabbits about 3 kg were selected to give 35 mg/kg ketamine and 0.25 mg/kg dexmedetomidine intramuscularly for the anesthesia.The chest was open to expose the upper segment.The surface of right ventricular outflow tract (RVOT) was exposed after the pericardium was opened partially.The valve material (0.1 mm PTFE) was inserted into the right ventricle via the central mini-incision.Then the skin was closed and the rabbits were recoved with the oxygen inhalation. Results Forty-two adult New Zealand rabbits accepted the operation.Six rabbits died during the early period due to the inappropriate anesthesia drug (n=2),pneumothorax (n=1) and thrombosis (n=3),which occurred the 5th,7thand 8thpostoperative day.The anticoagulation treatment was adjusted to solve the thrombosis problem.Thirty-six rabbits survived for several months with weight increase until the experiment was finished. Conclusions The experimental model of New Zealand rabbit is appropriate for the biocompatible assessment of 0.1 mm PTFE.The advantage is to avoid intubation and cardiopulmonary bypass (CPB) and to decrease the pneumothorax.
cardiac valve; biocompatibility; polytetrafluoroethylene; New Zealand rabbit
R654.2
A
10.3969/j.issn.1672-8467.2017.04.019
2016-06-21;编辑:沈玲)
△Corresponding author E-mail:jiabing2012@hotmail.com

