骨髓基质细胞调控Hedgehog/GLI信号通路抑制HL-60细胞凋亡的研究
孟腾腾,魏 虹,管东方,马 翠,吴广胜
1.石河子大学医学院组织胚胎学教研室,新疆 石河子 832002;
2. 柘城县人民医院心内科,河南 柘城 476200;
3.石河子大学医学院第一附属医院血液风湿科,新疆 石河子 832002
骨髓基质细胞调控Hedgehog/GLI信号通路抑制HL-60细胞凋亡的研究
孟腾腾1,2,魏 虹1,管东方1,马 翠1,吴广胜3
1.石河子大学医学院组织胚胎学教研室,新疆 石河子 832002;
2. 柘城县人民医院心内科,河南 柘城 476200;
3.石河子大学医学院第一附属医院血液风湿科,新疆 石河子 832002
背景与目的:骨髓基质细胞(bone marrow stromal cells,BMSC)是造血微环境的核心组成成分。骨髓造血微环境中的BMSC能调节急性髓系白血病(acute myelogenous leukemia,AML)的增殖、存活及耐药。因此,除了直接针对AML的治疗外,阻断白血病与BMSC的相互作用将为白血病的治疗提供新的策略。Hedgehog(Hh)蛋白属于分泌蛋白家族,广泛表达于哺乳动物和非哺乳动物等多个物种中,参与调控多种肿瘤的形成、器官成熟、血管生成、干细胞分化、免疫细胞及胚胎发育。Hh信号可以通过调节肿瘤细胞增殖、分化及免疫来创造适合肿瘤生存的微环境,进而为肿瘤发展和转移创造环境。然而,骨髓造血微环境能否通过Hh信号影响HL-60细胞的存活仍不清楚。该研究旨在探究BMSC诱导的Hh信号对HL-60细胞存活的影响。方法:应用CCK-8试剂盒检测不同实验组间HL-60细胞增殖情况,AnnexinⅤ-FITC/PI双染检测各组HL-60细胞凋亡率,半定量反转录聚合酶链反应(semi-quantitative reverse transcription polymerase chain reaction,SQRT-PCR)等方法检测各实验组Hh信号通路组成成分GLI1基因及凋亡基因BCL-2、BCL-XL的表达情况,免疫荧光法检测GLI1蛋白的表达状况。结果:BMSC对HL-60细胞具有促进增殖和抑制凋亡的作用,以GLI为靶点的Hh信号通路抑制剂GANT61 10 μmol/L可以逆转BMSC的这些作用。共培养体系中HL-60细胞GLI1蛋白及mRNA表达上调,抑凋亡基因BCL-2和BCL-XL的mRNA表达上调。结论:BMSC对AML细胞具有保护作用,其机制可能是BMSC激活AML细胞中的Hh信号通路进而上调下游靶基因BCL-2和BCL-XL的表达。
急性髓系白血病;GANT61;Hedgehog-GLI信号通路
造血微环境是由基质细胞(即成骨细胞、破骨细胞、内皮细胞、周围的网状细胞及间充质干细胞)、造血细胞、细胞外基质、可溶性因子和膜结合因子构成的复杂结构,它们协同支持正常造血[1]。骨髓基质细胞(bone marrow stromal cells,BMSC)是骨髓造血微环境的重要组成成分[1],骨髓造血微环境中的BMSC调节白血病细胞的增殖[2-3]、分化[2]及凋亡[2-4],此外,BMSC作为白血病细胞的“避难所”有助于白血病细胞耐药和体内微小残留病灶形成[5]。因此,除了针对白血病细胞的治疗,阐明白血病细胞和BMSC相互作用的机制,将为白血病治疗提供新的治疗策略。Hedgehog(Hh)信号通路参与调控器官成熟、血管生成、干细胞分化、免疫细胞及胚胎发育,Hh信号通路的异常激活参与多种肿瘤发生,如基底细胞癌、肺癌、乳腺癌、胃癌、肝癌、胰腺癌及前列腺癌[6]。近年研究发现,Hh信号通路在BMSC对慢性淋巴细胞性白血病[7-8]、多发性骨髓瘤[9]的保护中起重要作用。那么在BMSC对急性髓系白血病(acute myelogenous leukemia,AML)的保护作用中,该信号通路是否发挥作用呢?BMSC HS-5可产生多种细胞因子(如GM-CSF、M-CSF及LIF等)促进骨髓前体细胞的增殖,支持长期造血[4]。本研究拟采用人AML细胞株HL-60与HS-5细胞体外建立共培养模式,模拟体内白血病细胞与其周围的造血微环境的相互作用,研究造血微环境对白血病细胞凋亡的影响及作用的可能机制,为探索以阻断二者相互作用为靶标的白血病治疗药物的研制奠定理论基础。
1 材料和方法
1.1 药物和试剂
GANT61购自美国Selleck公司,RPMI 1640培养基和胎牛血清购自美国Gibco公司,CCK-8试剂盒购自日本同仁化学研究所,AnnexinV FITC/PI细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司,TRIzol购自美国Invitrogen公司,逆转录试剂盒购自美国Thermo Fisher Scientific公司,GLI1抗体购自英国Abcam公司。
1.2 细胞株及培养条件
BMSC HS-5和AML细胞HL-60购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库,细胞培养均采用含10%胎牛血清的RPMI-1640,在37 ℃、CO2体积分数为5%的饱和湿度培养箱中培养。取生长良好、细胞存活率(台盼蓝拒染法)大于95%的细胞进行实验。
1.3 方法
实验分为HL-60细胞单独培养组、HL-60+ GANT61 10 μmol/L培养组、HL-60+HS-5细胞培养组和HL-60+HS-5+GANT61 10 μmol/L培养组。
1.3.1 BMSC对HL-60细胞增殖特性的影响
将HL-60细胞按4×104个/mL接种于有或无BMSC HS-5(3×104个/mL,培养24 h)的96孔板内,100 μL/孔,设定3个复孔。对照组仅接种BMSC HS-5。每日固定时相点取1个96孔板,每孔加入10 μL CCK-8溶液作用2 h,用酶标仪测450 nm处各孔的吸光度(D)值,绘制HL-60细胞的增殖曲线。
1.3.2 AnnexinⅤ-FITC/PI 双染检测细胞凋亡率
将HL-60细胞按5×105个/mL接种于有或无HS-5细胞(1×105个/mL,培养48 h)的24孔板内,每天固定时相收集对数生长期HL-60细胞,用冷PBS洗涤2次,1 000×g离心5 min去上清液。用Annexin结合液重悬细胞,调整细胞浓度为1×106个/mL,向细胞悬液加5 μL AnnexinⅤ-FITC 混匀,4 ℃避光温育15 min,加入10 μL PI,4 ℃避光温育5 min,上流式细胞仪检测。
1.3.3 半定量反转录聚合酶链反应(semiquantitative reverse transcription polymerase chain reaction,SQRT-PCR)检测HL-60细胞中Hh信号通路成分和抑凋亡基因表达
采用SQRT-PCR检测48 h的HL-60细胞GLI1、BCL-2、BCL-XL和GAPDH的表达。按照TRIzol试剂盒说明书提取总RNA,将mRNA反转录为cDNA,反转录产物进行上述基因扩增,扩增条件见表1。扩增产物经1.5%琼脂糖凝胶电泳后凝胶成像系统拍照,照片用Image J进行mRNA表达分析和灰度扫描。
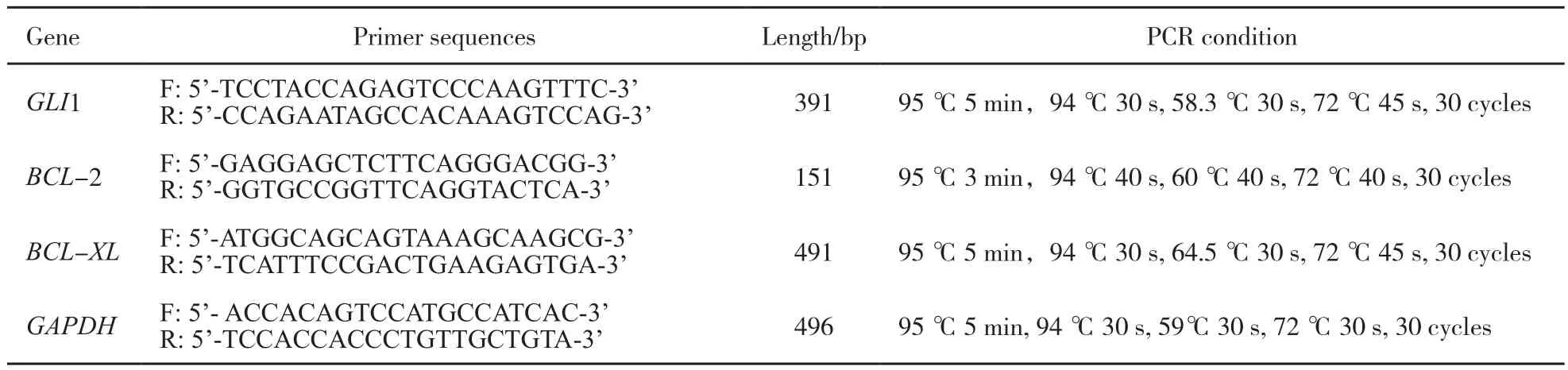
表 1 SQRT-PCR基因信息汇总Tab. 1 Primer sequences used for SQRT-PCR analysis
1.3.4 免疫荧光法检测GLI1表达
收集各组48 h时HL-60细胞,冷PBS洗2次,将100 μL细胞混悬液均匀滴加至多聚赖氨酸包被的载玻片上风干。采用4%多聚甲醛固定30 min,PBS洗3次,5 min/次,0.5% Triton X-100透膜处理10 min,PBS洗3次,5 min/次,10%山羊血清37 ℃封闭1 h,兔抗人GLI1抗体(1∶100)4 ℃温育过夜,PBS洗3次,5 min/次,用FITC荧光标记山羊抗兔二抗(1∶150)室温避光温育1 h,PBS洗3次,5 min/次,终浓度为0.1 mg/L PI室温避光温育1 min,PBS洗3次,5 min/次,封固,在共聚焦显微镜下观察。
1.4 统计学处理
2 结 果
2.1 HL-60细胞增殖曲线
通过CCK-8试剂盒检测细胞增殖情况,结果显示,与HS-5共培养的HL-60细胞生长速度比单独悬浮培养的HL-60细胞快,24 h时差异无统计学意义(P>0.05),48、72和96 h时差异有统计学意义(P<0.05);与HS-5共培养的HL-60生长速度比GANT61 10 μmol/L处理的共培养中的HL-60细胞快,同样24 h时差异无统计学意义(P>0.05),48、72和96 h时差异有统计学意义(P<0.05,图1)。
2.2 BMSC HS-5对AML细胞HL-60凋亡率的影响
24、48和72 h时,HL-60细胞培养组中HL-60细胞凋亡率均高于HL-60+HS-5细胞培养组,差异有统计学意义(P<0.05);24、48和72 h时,HL-60+HS-5+GANT61培养组中HL-60细胞凋亡率均高于HL-60+HS-5细胞培养组,24 h时差异无统计学意义(P>0.05),而48和72 h时差异有统计学意义(P<0.05);24、48和72 h时,HL-60+GANT61 10 μmol/L培养组中HL-60细胞凋亡率与HL-60细胞单独培养组中凋亡率差异无统计学意义(P>0.05,表2)。HS-5细胞抑制HL-60细胞凋亡,然后用GANT61抑制Hh信号通路可以逆转此作用(表2,图2)。
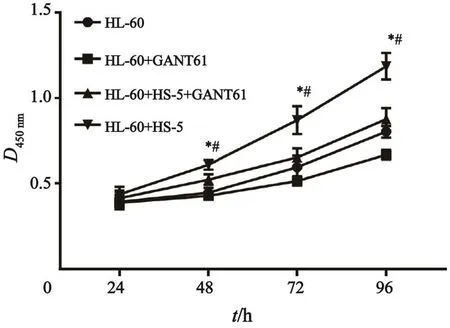
图 1 各实验组中HL-60细胞增殖情况Fig. 1 The proliferation of HL-60 cells in di ff erent treatment groups
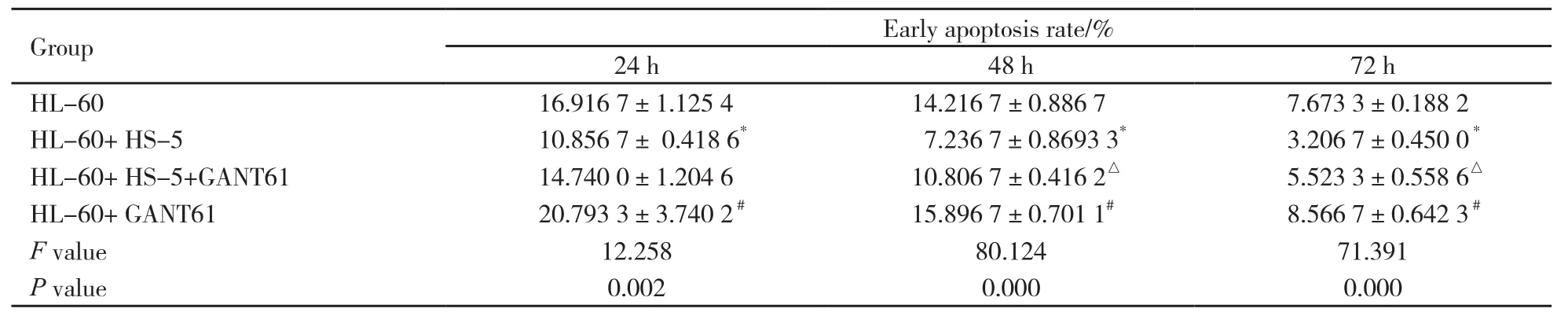
表 2 不同处理组对HL-60细胞早期凋亡率的比较Tab. 2 Comparison of early apoptosis rate of HL-60 cells in di ff erent treatment groups (n=3, x±s)
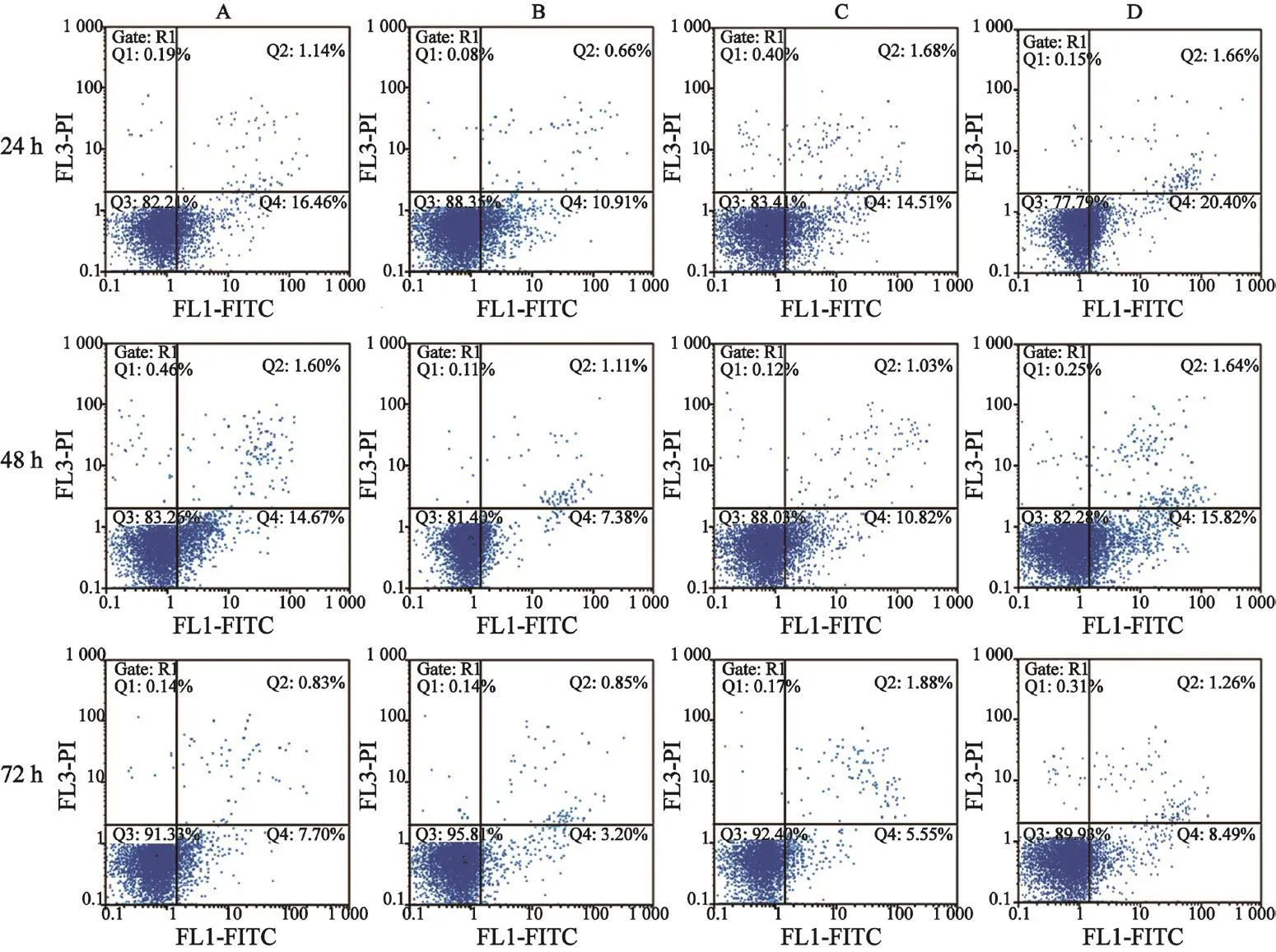
图 2 不同处理组对HL-60细胞凋亡率的比较Fig. 2 Comparison of apoptosis rate of HL-60 cells in di ff erent treatment groups
2.3 SQRT-PCR检测48 h时不同实验组中HL-60细胞中Hh信号通路成分和抑凋亡基因mRNA表达情况
与HS-5共培养的HL-60的GLI1、BCL-2和BCL-XL mRNA比GANT61 10 μmol/L处理的共培养中的HL-60细胞、单独悬浮培养的HL-60细胞表达高,差异有统计学意义(P>0.05,图3)。
2.4 细胞免疫荧光检测HL-60细胞中GLI1蛋白的表达水平
与HL-60+HS-5细胞培养组中的HL-60细胞相比,HL-60细胞单独培养组中荧光强度减弱,HL-60+HS-5+GANT61培养组中HL-60细胞中的荧光强度比HL-60+HS-5细胞培养组中HL-60细胞弱(图4)。
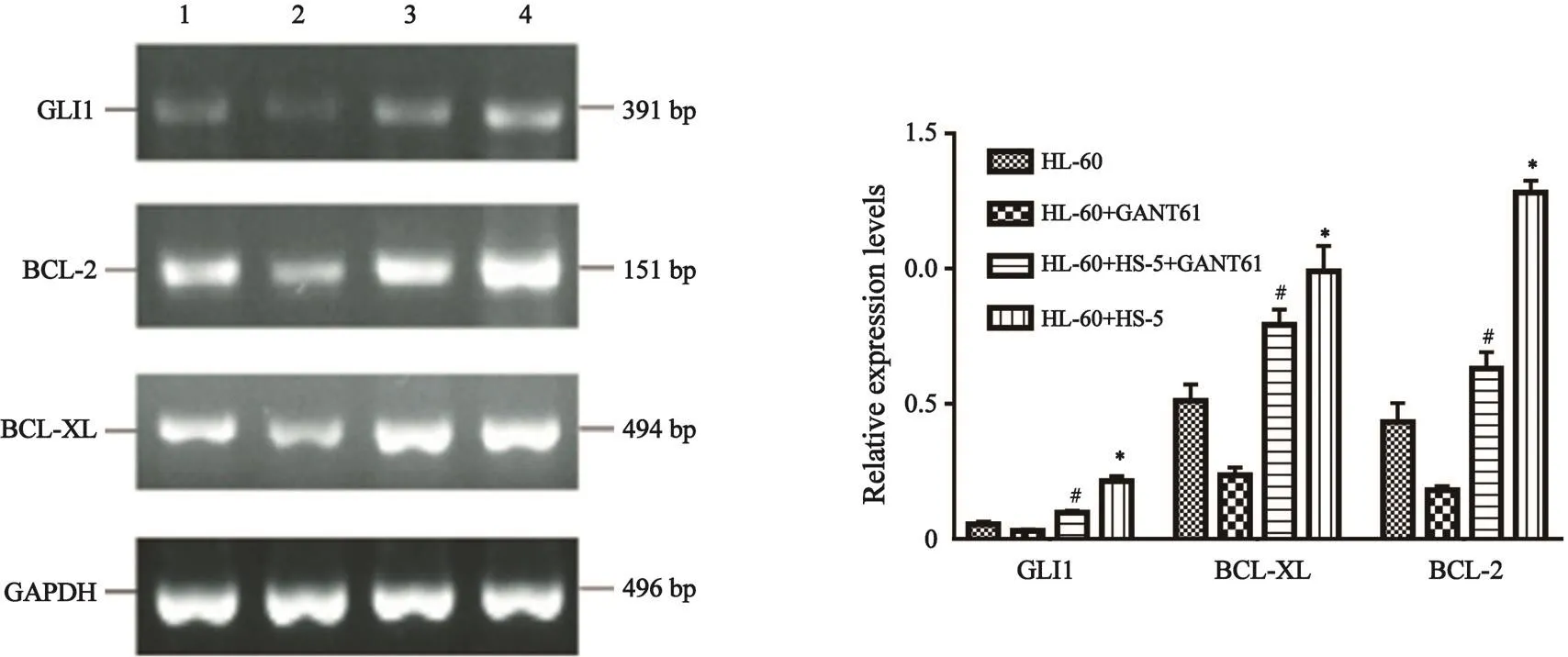
图 3 不同实验组HL-60细胞GLI1、BCL-XL和BCL-2的mRNA表达情况Fig. 3 mRNA expression of GLI1, BCL-XL and BCL-2 of HL-60 cells in di ff erent treatment groups
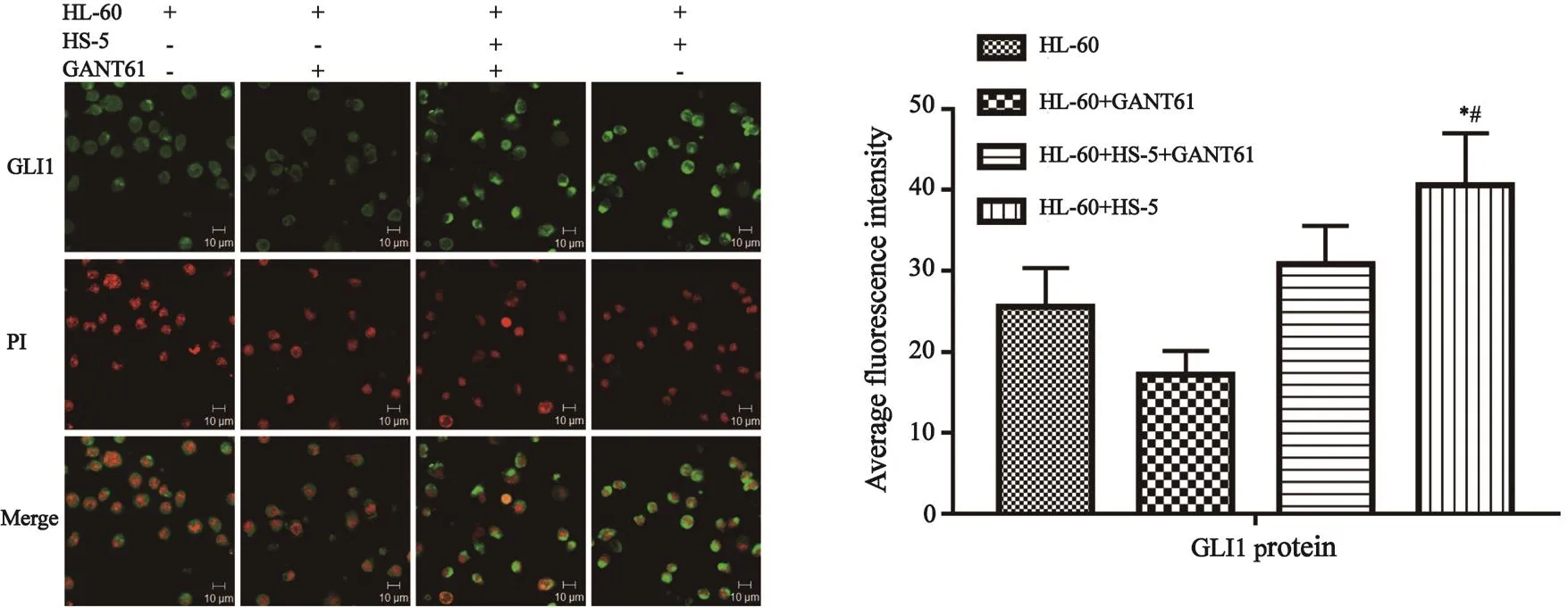
图 4 激光共聚焦观察HL-60细胞GLI1表达状况(×400)Fig. 4 GLI1 protein expression in HL-60 cells by immuno fluorescence staining (×400)
3 讨 论
Moshaver等[3]应用CFSE荧光标记法研究发现,BMSC HS-5具有促进HL-60和原代AML增殖的作用,本实验应用CCK-8法检测BMSC HS-5对HL-60细胞增殖的影响,同样发现HS-5细胞确实可以促进HL-60细胞的增殖,Garrido等[4]的研究显示,BMSC HS-5抑制AML细胞自发及化疗药物诱导的凋亡,Konopleva等[10]应用无血清及阿糖胞苷诱导HL-60细胞凋亡,发现鼠基质细胞MS-5具有抑制HL-60凋亡的作用。本实验无血清预处理HL-60细胞48 h后,建立共培养体系,AnnexinⅤ-FITC/PI双染检测细胞凋亡率发现,HS-5细胞具有抑制HL-60细胞凋亡的作用。Hh信号通路最早由Nusslein-Volhard等[11]在1980年进行遗传筛选影响果蝇胚胎形成的因素中发现。Hh-GLI信号通路包括分泌型信号糖蛋白配体Hh、跨膜蛋白受体Patched(PTCH)以及与G蛋白偶联的磷酸化受体Smoothened(SMO)组成的复合体和胶质瘤相关癌基因同源物(glioma-associated oncogene homolog,GLI)等蛋白成分,GLI是有锌指结构核转录因子,哺乳动物有3个GLI的同源基因GLI1、GLI2和GLI3,分别编码GLI1、GLI2和GLI3蛋白[12],GLI3是一个主要的转录抑制因子,GLI2存在于全长的活性形式和截短的抑制形式[13-14],GLI1仅有活化Hh信号通路的作用[15],哺乳动物中Hh信号通路的活化还需要初级纤毛的参与[16]。在哺乳动物中,当Hh配体不存在时,PTCH受体表达于细胞膜,抑制SMO的表达及初级纤毛定位,从而抑制SMO活性,然后具有抑制作用的GLI2(GLI-R)片段特别是GLI3(GLI3R)片段细胞核转移,充分抑制信号通路活化;当Hh配体与PTCH受体结合时,PTCH受体对SMO的抑制作用被解除,SMO初级纤毛上富集,促进有活性作用的GLI转录因子细胞核转移,激活下游靶基因表达,如GLI1[12]。GLI1既是Hh信号通路的组成成分,又是信号的转录靶基因 ,因此GLI1可作为信号通路激活的标记基因[17-18],以此来判断通路激活的程度。所以本实验选取检测GLI1 mRNA和蛋白表达情况来判断信号通路活化状况。Hh信号通路的异常活化参与多种实体肿瘤[6]的发生,然而Hh信号通路在恶性血液病的发生中还存在很大争论。Zhao等[19]和Dierks等[20]研究表明,BCR-ABL+CML干细胞中存在SMO高表达导致Hh信号通路活化,抑制SMO可减少CML干细胞存活,从而使白血病发病率降低。然而Hofmann等[21]的研究表明,SMO失活对正常造血无影响,包括外周血数目、干或祖细胞的数目、细胞周期状态及造血细胞集落形成能力,此外,Hh信号通路在MLL-AF9诱导的AML的发生中没有发挥作用。Gao等[22]的研究发现,条件性降低和升高SMO的表达对正常造血干细胞的自我更新和功能没有影响,而且T-ALL的发生不依赖Hh信号通路。Wellbrock等[23]应用GLI为靶点的Hh信号通路特异性抑制剂GANT61和shRNA在体内外研究Hh信号通路与AML的关系,发现AML患者存在Hh信号通路的异常活化,GLI的表达是一个不良的预后因素,可能是一种新的药物靶点。Pan等[24]的研究发现,以SMO为靶点的特异性Hh信号通路抑制剂环巴胺,对HL-60细胞的增殖和凋亡无影响,然而30 μmol/L的GANT61,48 h时明显抑制其增殖,促进其凋亡,并且与雷帕霉素具有协同杀伤作用。本实验应用GANT61处理的共培养组中,HL-60细胞的增殖速度慢于共培养组中HL-60细胞的增殖,而且凋亡率也高于共培养组,表明GANT61可以逆转BMSC HS-5对AML细胞HL-60的保护作用,同时可推测Hh信号通路在BMSC对AML细胞的保护中发挥作用。Hegde等[8]的研究表明,环巴胺能够抑制BMSC对B-CLL细胞的保护作用,从而说明Hh信号通路参与这种保护作用。Dierks等[25]的研究结果同样支持上述观点。为验证Hh信号通路同样参与骨髓微环境对AML的保护作用,本实验应用SQRT-PCR和免疫荧光技术检测GLI1在实验组中的表达情况,发现共培养组中的HL-60细胞GLI1比HL-60细胞单独悬浮培养的高,用GANT61处理共培养组后的GLI1表达量比共培养组中的HL-60细胞低,说明Hh信号通路在BMSC对AML细胞的保护作用中发挥作用。BCL-2家族蛋白是细胞凋亡的关键调节分子,线粒体是其调控内在凋亡途径的靶点[26]。本实验检测BCL-2家族中的抑凋亡基因BCL-2和BCL-XL,结果与GLI1在各组中的表达相一致。Moshaver等[3]和Konopleva等[10]的研究表明,BMSC可以上调AML细胞BCL-2的表达进而抑制其凋亡,与本研究结果一致。
综上所述,BMSC HS-5可以促进AML细胞HL-60增殖,抑制其凋亡,这些作用可能是通过激活HL-60细胞中Hh信号通路进而上调抑凋亡基因BCL-2和BCL-XL来实现的。本研究体外初步探索BMSC对AML增殖和凋亡的影响及可能作用机制,为AML的治疗提供新的治疗策略。
[1] BLAU O. Bone marrow stromal cells in the pathogenesis of acute myeloid leukemia[J]. Front Biosci (Landmark Ed), 2014, 19: 171-180.
[2] LIANG R, HUANG G S, WANG Z, et al. Effects of human bone marrow stromal cell line (HFCL) on the proliferation, differentiation and apoptosis of acute myeloid leukemia cell lines U937, HL-60 and HL-60/VCR[J]. Int J Hematol, 2008, 87(2): 152-166.
[3] MOSHAVER B, VAN DER POL M A, WESTRA A H, et al. Chemotherapeutic treatment of bone marrow stromal cells strongly affects their protective effect on acute myeloid leukemia cell survival[J]. Leuk Lymphoma, 2008, 49(1): 134-148.
[4] GARRIDO S M, APPELBAUM F R, WILLMAN C L, et al. Acute myeloid leukemia cells are protected from spontaneous and drug-induced apoptosis by direct contact with a human bone marrow stromal cell line (HS-5)[J]. Exp Hematol, 2001, 29(4): 448-457.
[5] MEADS M B, HAZLEHURST L A, DALTON W S. The bone marrow microenvironment as a tumor sanctuary and contributor to drug resistance[J]. Clin Cancer Res, 2008, 14(9): 2519-2526.
[6] RUBIN L L, DE SAUVAGE F J. Targeting the Hedgehog pathway in cancer[J]. Nat Rev Drug Discov, 2006, 5(12): 1026-1033.
[7] DESCH P, ASSLABER D, KERN D, et al. Inhibition of GLI, but not Smoothened, induces apoptosis in chronic lymphocytic leukemia cells[J]. Oncogene, 2010, 29(35): 4885-4895.
[8] HEGDE G V, PETERSON K J, EMANUEL K, et al. Hedgehog-induced survival of B-cell chronic lymphocytic leukemia cells in a stromal cell microenvironment: a potential new therapeutic target[J]. Mol Cancer Res, 2008, 6(12): 1928-1936.
[9] KOBUNE M, IYAMA S, KIKUCHI S, et al. Stromal cells expressing hedgehog-interacting protein regulate the proliferation of myeloid neoplasms[J]. Blood Cancer J, 2012, 2: e87.
[10] KONOPLEVA M, KONOPLEV S, HU W, et al. Stromal cells prevent apoptosis of AML cells by up-regulation of antiapoptotic proteins[J]. Leukemia, 2002, 16(9): 1713-1724.
[11] NUSSLEIN-VOLHARD C, WIESCHAUS E. Mutations affecting segment number and polarity in Drosophila[J]. Nature, 1980, 287(5785): 795-801.
[12] IRVINE D A, COPLAND M. Targeting hedgehog in hematologic malignancy[J]. Blood, 2012, 119(10): 2196-2204.
[13] SASAKI H, NISHIZAKI Y, HUI C, et al. Regulation of Gli2 and Gli3 activities by an amino-terminal repression domain: implication of Gli2 and Gli3 as primary mediators of Shh signaling[J]. Development, 1999, 126(17): 3915-3924.
[14] HUI C C, ANGERS S. Gli proteins in development and disease[J]. Annu Rev Cell Dev Biol, 2011, 27: 513-537.
[15] STEPAN V, RAMAMOORTHY S, NITSCHE H, et al. Regulation and function of the sonic hedgehog signal transduction pathway in isolated gastric parietal cells[J]. J Biol Chem, 2005, 280(16): 15700-15708.
[16] CORBIT K C, AANSTAD P, SINGLA V, et al. Vertebrate Smoothened functions at the primary cilium[J]. Nature, 2005, 437(7061): 1018-1021.
[17] OSTERLUND T, KOGERMAN P. Hedgehog signalling: how to get from Smo to Ci and Gli[J]. Trends Cell Biol, 2006, 16(4): 176-180.
[18] COHEN M M Jr. The hedgehog signaling network[J]. Am J Med Genet A, 2003, 123A(1): 5-28.
[19] ZHAO C, CHEN A, JAMIESON C H, et al. Hedgehog signalling is essential for maintenance of cancer stem cells in myeloid leukaemia[J]. Nature, 2009, 458(7239): 776-779.
[20] DIERKS C, BEIGI R, GUO G R, et al. Expansion of Bcr-Abl-positive leukemic stem cells is dependent on Hedgehog pathway activation[J]. Cancer Cell, 2008, 14(3): 238-249.[21] HOFMANN I, STOVER E H, CULLEN D E, et al. Hedgehog signaling is dispensable for adult murine hematopoietic stem cell function and hematopoiesis[J]. Cell Stem Cell, 2009, 4(6): 559-567.
[22] GAO J, GRAVES S, KOCH U, et al. Hedgehog signaling is dispensable for adult hematopoietic stem cell function[J]. Cell Stem Cell, 2009, 4(6): 548-558.
[23] WELLBROCK J, LATUSKE E, KOHLER J, et al. Expression of hedgehog pathway mediator Gli represents a negative prognostic marker in human acute myeloid leukemia and its inhibition exerts antileukemic effects[J]. Clin Cancer Res, 2015, 21(10): 2388-2398.
[24] PAN D, LI Y, LI Z, et al. Gli inhibitor GANT61 causes apoptosis in myeloid leukemia cells and acts in synergy with rapamycin[J]. Leuk Res, 2012, 36(6): 742-748.
[25] DIERKS C, GRBIC J, ZIRLIK K, et al. Essential role of stromally induced hedgehog signaling in B-cell malignancies[J]. Nat Med, 2007, 13(8): 944-951.
[26] OLA M S, NAWAZ M, AHSAN H. Role of Bcl-2 family proteins and caspases in the regulation of apoptosis[J]. Mol Cell Biochem, 2011, 351(1-2): 41-58.
Study on the regulation of Hedgehog/GLI signaling pathway by bone marrow stromal cells to inhibit the apoptosis of HL-60 cells
MENG Tengteng1,2, WEI Hong1, GUAN Dongfang1, MA Cui1, WU Guangsheng3
(1. Department of Histology and Embryology, College of Medicine, Shihezi University, Shihezi 832002, Xinjiang Uyghur Autonomous Region, China; 2. Department of Cardiology, the People’s Hospital of Zhecheng, Zhecheng 476200, Henan Province, China; 3. Department of Blood Rheumatology, the First Affiliated Hospital, College of Medicine, Shihezi University, Shihezi 832002, Xinjiang Uyghur Autonomous Region, China)
WEI Hong E-mail: weihong-2@163.com
Background and purpose: The key component of the hematopoietic microenvironment is bone marrow stromal cells (BMSC). Several studies have provided evidence suggesting that proliferation, survival, and drug resistance of AML can be modulated by BMSC within the bone marrow hematopoietic microenvironment. Therefore, in addition to therapies that directly target acute myelogenous leukemia (AML), interruption of leukemia cell and BMSC interactions should be considered when designing anti-AML therapeutic strategies. Hedgehog (Hh) protein belongs to a family of secreted proteins, which is widely expressed in mammals and non-mammals species and involved in the regulation of a variety of tumor formation in mature organs, angiogenesis, stem cell differentiation, immune cells, and embryonic development. Hh signaling allows for the modulation of the microenvironment to prepare a tumor-suitable niche by manipulatingtumor cell growth, differentiation, and immune regulation, thus creating an enabling environment for progression and metastasis. However, it remains unclear whether the bone marrow hematopoietic microenvironment contributes to the increased survival of HL-60 cells by Hh signaling. Therefore, we studied the influence of bone marrow stromal cell-induced Hh signaling on the survival of HL-60 cells. Methods: CCK-8 kit was used for the detection of HL-60 cell proliferation in different experimental groups. Annexin V-FITC/PI double staining was used to detect the HL-60 cell apoptotic rate. Semiquantitative reverse transcription polymerase chain reaction (SQRT-PCR) was used to detect the experimental group Hh signaling pathway components of GLI1 mRNA and BCL-2, BCL-XL expression. GLI1 apoptotic gene expression levels were measured using immunofluorescence assay. Results: Bone marrow stromal cells promote proliferation and inhibit apoptosis of HL-60 cells, and 10 μmol/L of GANT61 can reverse these effects of bone marrow stromal cells. In co-culture system of HL-60 cells, GLI1 protein and mRNA expression increased and apoptosis inhibiting gene expression of BCL-2 and BCL-XL mRNA were upregulated. Conclusion: Bone marrow stromal cells have a protective effect on acute myeloid leukemia cells. The mechanism may involve activation of the Hh signaling pathway in acute myeloid leukemia cells by bone marrow stromal cells leading to increased expression of downstream target gene BCL-2 and BCL-XL.
Acute myelogenous leukemia; GANT61; Hedgehog-GLI signaling pathway
10.19401/j.cnki.1007-3639.2017.07.004
R73-34
A
1007-3639(2017)07-0538-07
2017-02-01
2017-04-30)
魏 虹 E-mail: weihong-2@163.com

