二甲双胍对饱和脂肪酸诱导的大鼠H9C2型心肌细胞损伤的保护作用研究*
张 骁,张红明,刘大男▲,李晓燕
(1.贵州医科大学附属医院心血管内科,贵阳 550004;2.济南军区总医院,济南 250031)
二甲双胍对饱和脂肪酸诱导的大鼠H9C2型心肌细胞损伤的保护作用研究*
张 骁1,张红明2△,刘大男1▲,李晓燕2
(1.贵州医科大学附属医院心血管内科,贵阳 550004;2.济南军区总医院,济南 250031)
目的 探讨二甲双胍(Met)对饱和脂肪酸所诱导的大鼠H9C2型心肌细胞损伤作用的保护机制。方法 在对照、棕榈酸(PA)及3种不同浓度梯度Met与PA联合组培养液中培养大鼠H9C2型心肌细胞株24 h。采用蛋白质印迹法(Western blot)测定各组细胞核因子κB(NF-κB)p65、细胞间黏附因子(ICAM1)、磷酸化核因子κB抑制蛋白(p-IκBα)及磷酸化腺苷酸活化蛋白激酶(p-AMPK)的蛋白表达,实时荧光定量PCR测定各组细胞NF-κB、单核细胞趋化因子(CCL2)和ICAM1的mRNA表达。结果 与对照组相比,PA组的细胞中NF-κB p65、ICAM1、p-IκBα蛋白表达量增加(P<0.05);与PA组相比,Met+PA联合组细胞NF-κB p65、ICAM1、p-IκBα的蛋白表达量随Met浓度梯度增加表现为不同程度递减(P<0.05),p-AMPK蛋白表达量随Met浓度增加而显著增加(P<0.05)。与对照组相比,PA组CCL2、ICAM1的mRNA表达量增加(P<0.05);与PA组相比,Met+PA联合组细胞CCL2和ICAM1的mRNA表达量下降(P<0.05)。结论 Met可以减轻由饱和脂肪酸诱导细胞黏附因子和趋化因子表达增加而引起的大鼠H9C2型心肌细胞损伤。
二甲双胍;NF-κB;趋化因子;腺苷酸活化蛋白激酶
饱和脂肪酸摄入过多是导致临床上血脂异常症的主要原因,可以增加动脉粥样硬化和心血管事件发生的风险。棕榈酸(palmitic acid,PA)作为饱和脂肪酸的一种可导致心肌细胞的损伤凋亡[1]。核因子κB(nuclear factor of κB,NF-κB)是一种广泛存在于各种细胞中的转录调节因子,可以调控多种靶基因包括细胞间黏附因子(intercellular cell adhesion molecule-1,ICAM1)、单核细胞趋化因子[chemokine (C-C motif) ligand 2,CCL2]及多种免疫相关受体等,对于机体的炎症反应、应激反应和细胞凋亡起主导作用[2]。近年来研究表明,二甲双胍(metformin,Met)作为临床上常用的治疗2型糖尿病的一线药物,能够对损伤的血管内皮细胞起到一定程度保护作用[3-5]。对于这种保护作用的机制,过去有研究证实,可能是通过激活腺苷激活的蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)的途径而实现的[6]。本实验探讨Met是否对饱和脂肪酸诱导损伤的心肌细胞起到同样的保护作用,并对药物的作用机制做进一步验证。
1 材料与方法
1.1 实验材料 大鼠H9C2心肌细胞株(齐氏生物科技有限公司),Met、PA(Sigma公司),进口胎牛血清、青霉素、链霉素(Gibco公司),DMEM培养基、胰蛋白酶(HyClone公司),NF-κB p65抗体、ICAM1抗体(Abcam公司),磷酸化核因子κB抑制蛋白(p-IκBα)抗体、p-AMPK抗体(Santa公司),RNA提取试剂Trizol(Invitrogen公司),逆转录试剂盒、荧光PCR试剂盒(TaKaRa公司),引物由上海博尚生物公司合成。
1.2 方法
1.2.1 细胞培养及分组 采用H9C2型大鼠心肌细胞株在含10%胎牛血清和1%双抗的DMEM培养基中,37℃、5%CO2下培养,每2天换液,0.25%胰酶-EDTA消化传代。取对数生长期的细胞,调整细胞浓度接种至6孔板,37 ℃、5%CO2孵育2 h。每两个孔为一组进行编号,一共5组,依次分为对照组、PA组(300 μmol/L)、低浓度Met(1 mmol/L)+PA(300 μmol/L)联合组、中浓度Met(2 mmol/L)+PA(300 μmol/L)联合组、高浓度Met(4 mmol/L)+PA(300 μmol/L)联合组,在无血清的培养基中继续培养细胞至24 h。
1.2.2 药物刺激的配制 83 mg Met溶于1 000 μL三蒸水过滤制成500 mmol/L的母液,-20 ℃保存。0.025 6 g PA溶于1 mL无水乙醇,60 ℃水浴完全溶解后加入20 μL 10 mol/L NaOH,颠倒混匀溶于不含饱和脂肪酸的牛血清清蛋白(bovine serum albumin,BSA)溶液,振荡混匀过滤制成10 mol/L PA母液,4 ℃存放。
1.2.3 蛋白质印迹法(Western blot)测定NF-κB p65、ICAM1、p-IκBα和p-AMPK的蛋白表达 各组H9C2心肌细胞样本分别取160 μg总蛋白,经SDS-PAGE电泳、转膜、封闭2 h后,依分子量分别与兔抗大鼠NF-κB p65、ICAM1、p-IκBα和p-AMPK抗体混合后4 ℃过夜。TBST洗涤3次后,与山羊抗兔IgG室温下孵育2 h,加入ECL显色底物,凝胶成像分析仪上成像。设β-actin为内参,用ImageJ软件测定NF-κB p65、ICAM1、p-IκBα和p-AMPK的灰度值并与内参进行比较。
1.2.4 实时荧光定量PCR测定NF-κB、ICAM1及CCL2的mRNA表达 在NCBI Gen Bank数据库中查询NF-κB、ICAM1、CCL2,采用Primer 5.0软件设计引物。NF-κB:上游引物为5′-AAC AGA GAG GAT TTC GTT TCC G-3′,下游引物为5′-TTT GAC CTG AGG GTA AGA CTT CT-3′,扩增产物长度190 bp;ICAM1:上游引物为5′-ATG CCC AGA CAT CTG TGT CC-3′,下游引物为5′-GGG GTC TCT ATG CCC AAC AA-3′,扩增产物长度104 bp;CCL2:上游引物为5′-CAG CCA GAT GCA ATC AAT GCC-3′,下游引物为5′-TGG AAT CCT GAA CCC ACT TCT-3′,扩增产物长度112 bp。按照试剂盒说明书进行细胞总RNA的提取,采用逆转录试剂盒(20 μL体系)逆转录所得cDNA为模板进行PCR扩增目的片段,于LightCycler PCR仪上进行定量检测,在加样操作过程中注意避光,各反应液配置在冰上进行。反应条件:预变性,95 ℃ 30 s;PCR反应,95 ℃ 5 s,58 ℃ 30 s,72 ℃ 30 s,40个循环,随后进行溶解曲线分析。结合扩增曲线及溶解曲线分析,将符合要求的样本基因定量PCR原始数据取3次重复的平均值,经β-actin校正,用Light Cycler 4.0软件进行数据处理,用2-ΔΔCt法分析数据。

2 结 果
2.1 大鼠H9C2心肌细胞生长特点 使用倒置相差显微镜(Olympus公司)观察,H9C2细胞贴壁生长,单个细胞形态以现梭型、三角形为主,细胞质为透明、细胞核圆形。见图1。

A:×40;B:×200
图1 大鼠H9C2细胞
2.2 各组细胞NF-κB p65、ICAM1、p-IκBα和p-AMPK的蛋白表达水平 PA组细胞的NF-κB p65、ICAM1、p-IκBα蛋白表达量明显高于对照组(P<0.05)。与PA组相比,Met+PA联合组细胞的NF-κB p65、p-IκBα蛋白表达量随Met浓度增加而明显递减(P<0.05),Met+PA联合组组间比较差异有统计学意义(P<0.05);ICAM1蛋白表达量明显降低(P<0.05),其中中浓度Met+PA联合组细胞的ICAM1蛋白表达量最低(P<0.05)。随着Met浓度梯度的增加,Met+PA联合组细胞的p-AMPK蛋白表达量与对照组和PA组相比显著增高(P<0.05),其中中浓度Met+PA联合组细胞的p-AMPK蛋白表达量最高(P<0.05)。见图2、3。

*:P<0.05,与对照组相比;#:P<0.05,与PA组相比
图2 各组NF-κB p65和ICAM1的蛋白表达
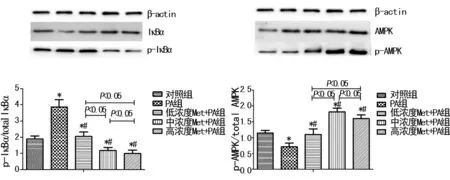
*:P<0.05,与对照组相比;#:P<0.05,与PA组相比
图3 各组p-IκBα和p-AMPK的蛋白表达
2.3 各组细胞NFκB、CCL2和ICAM1的mRNA表达水平 与对照组比较,PA组NF-κB的mRNA表达量有所增加但差异无统计学意义(P>0.05),CCL2和ICAM1的mRNA表达量明显增加(P<0.05)。与PA组相比,不同浓度的Met+PA联合组细胞NF-κB的mRNA表达量逐渐减少但差异无统计学意义(P>0.05);Met+PA联合组细胞CCL2和ICAM1的mRNA表达量随Met浓度增加而减少(P<0.05),Met+PA联合组组间比较差异有统计学意义(P<0.05)。见图4。

*:P>0.05,与对照组相比;#:P>0.05,与PA组相比;a:P<0.05,与对照组相比;b:P<0.05,与 PA组相比
图4 各组细胞的NF-κB、CCL2和ICAM1的mRNA表达
3 讨 论
高浓度饱和脂肪酸环境下的血管内皮细胞损伤与脂质形成是动脉粥样硬化形成的始动因素,长时间受这种高危因素影响还能够引起心肌细胞的大量损伤凋亡[7],严重危害了人类的健康。Met作为一款常用的降糖药物在近年来国内外的前沿研究中有了很多新的发现,除了已熟知的抗动脉粥样硬化的作用之外,还发现它对脊髓损伤的神经细胞抗炎抗凋亡的作用及降低前列腺癌的发病率的作用等[8-9]。更有报道认为,Met是一种个体在感染源环境中的潜在心肌保护剂[10]。
本研究以大鼠H9C2型心肌细胞为基础,通过高浓度饱和脂肪酸诱导细胞凋亡损伤,验证Met对上述受损心肌细胞的保护作用。有研究证明,动脉粥样硬化斑块的形成与细胞黏附因子和趋化因子的增多有着至关重要的关系[11]。Yan等[12]发现,高浓度软脂酸诱导人脐静脉内皮细胞时,可使核因子κB抑制蛋白(inhibitor of nuclear factor κB,IκB)磷酸化增加,使其对NF-κB的抑制作用减弱。在本实验中,PA能够引起细胞NF-κB、p-IκBα、ICAM1的蛋白表达明显升高,也可以诱导CCL2和ICAM1的mRNA表达量上调,这说明高浓度饱和脂肪酸一方面可以通过增加细胞黏附因子和趋化因子的表达促进粥样斑块的形成,造成心脑血管疾病的发生,另一方面可以使IκB蛋白磷酸化从而降低其对NF-κB的抑制作用,使细胞内NF-κB表达增多启动炎症反应,引起细胞的凋亡与损伤。实验结果显示,在同等浓度PA条件的细胞组中,Met能够显著降低细胞NF-κB p65、ICAM1、p-IκBα的蛋白表达和CCL2、ICAM1的mRNA表达,且表达程度随Met浓度梯度增加而下降,这表明Met能够减轻PA诱导的H9C2型心肌细胞损伤,并且对受损细胞的保护作用在一定范围内随Met浓度的增加而增强。另外,本实验对药物的作用机制进一步研究发现,Met能够显著增强受损细胞p-AMPK的蛋白表达,与Met浓度增加呈正相关。这也证实了饱和脂肪酸诱导的细胞损伤可以通过AMPK通路的激活而减轻[6],继而增加脂肪酸氧化分解,减少由NF-κB介导的免疫反应、炎症反应与细胞凋亡,使细胞黏附因子和趋化因子表达降低。
综上所述,激活AMPK通路很可能是Met对饱和脂肪酸诱导的心肌细胞损伤保护作用的机制,深入探讨其机制,有助于证实Met在高脂肪酸血症时对心肌细胞的保护作用,对临床上血脂异常症患者降低心血管事件的发生率及受损心肌组织的恢复提供了新的思路。
[1]王小芳,张金盈,赵晓燕,等.二甲双胍对原代心肌细胞凋亡的影响[J].临床心血管病杂志,2013,26(4):1001-1439.
[2]李利,方强.核因子-κB的结构和功能研究及与全身炎症反应综合征的关系[J].国外医学(临床生物化学与检验学分册),2005,26(11):792-794.
[3]Xu W,Deng YY,Yang L,et al.Metformin ameliorates the proinflammatory state in patients with carotid artery atherosclerosis through sirtuin 1 induction[J].Transl Res,2015,166(5):451-458.
[4]宋娜娜,丁文惠.二甲双胍心血管保护效应的研究进展[J].中国糖尿病杂志,2013,21(12):1140-1141.
[5]Ghosh S,Lakshmanan AP,Hwang MJ,et al.Metformin improves endothelial function in aortic tissue and microvascular endothelial cells subjected to diabetic hyperglycaemic conditions[J].Biochem Pharmacol,2015,98(3):412-421.
[6]程莹,母义明,汪保安,等.激活的一磷酸腺苷活化蛋白激酶对软脂酸诱导的血管内皮细胞损伤的保护作用[J].第二军医大学学报,2006,27(9):957-960.
[7]张治宇,赵彤,袁志忠,等.饱和脂肪酸致乳鼠心肌细胞损伤凋亡的代谢机制[J].心脏杂志,2009,21(5):652-656.
[8]Wang C,Liu C,Gao K,et al.Metformin preconditioning provide neuroprotection through enhancement of autophagy and suppression of inflammation and apoptosis after spinal cord injury[J].Biochem Biophys Res Commun,2016,477(4):534-540.
[9]Pennanen P,Syvül H,Blüuer M,et al.The effects of metformin and simvastatin on the growth of LNCaP and RWPE-1 prostate epithelial cell lines[J].Eur J Pharmacol,2016,788(2):160-167.
[10]Tzanavari T,Varela A,Theocharis S,et al.Metformin protects against infection-induced myocardial dysfunction[J].Metabolism,2016,65(10):1447-1458.
[11]Bosamirjanic-Azaric B,Rizzo M,LjubomirSormaz,et al.Atorvastatin in stable angina patients lowers CCL2 and ICAM1 expression:Pleiotropic evidence from plasma mRNA analyses[J].Clin Biochem,2013,46(15):1526-1531.
[12]Yan S,Zhang X,Zheng H,et al.Clematichinenoside inhibits VCAM-1 and ICAM-1 expression in TNF-α-treated endothelial cells via NADPH oxidase-dependent IκB kinase/NF-κB pathway[J].Free Radic Biol Med,2015,78(3):190-201.
Protective effect of metformin on H9C2 rat myocardial cell damage induced by saturated fatty acid*
ZhangXiao1,ZhangHongming2△,LiuDanan1▲,LiXiaoyan2
(1.DepartmentofCardiology,AffiliatedHospital,GuizhouMedicalUniversity,Guiyang,Guizhou550004,China;2.GeneralHospitalofJinanMilitaryRegion,Jinan,Shandong250031,China)
Objective To investigate the mechanisms of metformin (Met) for protecting H9C2 myocardial cells damage induced by saturated fatty acids (palmitic acid,PA) in rats.Methods Rat H9C2 myocardial cell lines in blank control group,PA group and three different concentrations of metformin and PA combination groups were cultured for 24 h.Then Western blot was adopted to detect the protein expression of nuclear factor κB p65 (NFκB p65),intercellular cell adhesion molecule-1 (ICAM1),phosphorylated inhibitor of nuclear factor κB (p-IκBα) and phosphorylated adenosine monophosphate activated protein kinase(p-AMPK);the quantitative real-time PCR(qRT-PCR) was used to detect the mRNA expression of nuclear factor of nuclear factor κB(NFκB),chemokine (C-C motif) ligand 2 (CCL2) andintercellular cell adhesion molecule-1(ICAM1).Results Compared with the control groups,the protein expression of NFκB p65,p-IκBα and ICAM1 in the PA group was increased (P<0.05);compared with the PA group,the protein expression of NFκB p65,IκBα and ICAM1 in the Met+PA combination groups was decreased in various degrees with the Met concentration increase (allP<0.05),while the protein expression of p-AMPK was significantly risen with the Met concentration increase (allP<0.05).Compared with the control group,the mRNA expression of CCL2 and ICAM1 in the PA group was increased (P<0.05);compared with the PA group,the mRNA expression of CCL2 and ICAM1 in the Met+PA combination groups was decreased (P<0.05).Conclusion Met can alleviate H9C2 myocardial cellular damage caused by saturated fatty acid inducing increase of CCL2 and ICAM1 expression.
metformin;NF-Kappa B;chemokine;adenosine activated protein kinase
全军后勤科研重大项目(AWS13C008)。 作者简介:张骁(1990-),硕士,主要从事高血压、高血脂机制的病理生理研究。△
,E-mail:13295416075@163.com。▲通信作者,E-mail:liudanau2000@sina.com。
� 著·
10.3969/j.issn.1671-8348.2017.20.002
R542.2
A
1671-8348(2017)20-2741-03
2017-02-05
2017-04-10)

