表没食子儿茶素没食子酸酯对肠缺血再灌注损伤的保护作用研究
杨旭堃,申 芹,杜 宇△
(1.四川大学华西第四医院重症监护室,成都 610041;2.中航工业363医院放疗科,成都 610041)
表没食子儿茶素没食子酸酯对肠缺血再灌注损伤的保护作用研究
杨旭堃1,申 芹2,杜 宇1△
(1.四川大学华西第四医院重症监护室,成都 610041;2.中航工业363医院放疗科,成都 610041)
目的 探讨表没食子儿茶素没食子酸酯(EGCG)对大鼠肠缺血再灌注损伤的影响及其作用机制。方法 40只SD 大鼠均分为4组:假手术组(Sham组)、肠道缺血再灌注损伤组(IRI组)、EGCG预处理组(EGCG组)和Wnt激动剂HLY78组(Wnt-Ag组)。IRI、EGCG和Wnt-Ag组无损伤血管夹夹闭肠系膜上动脉(SMA)45 min构建肠缺血再灌注损伤模型,Sham组只做假手术处理。EGCG组在缺血前45 min腹腔注射EGCG(50 mg/kg),Wnt-Ag组在缺血前45 min腹腔注射EGCG(50 mg/kg)+Wnt-Ag(5 mg/kg),Sham组和IRI组腹腔注射等量生理盐水。再灌注4 h后HE染色观察肠组织病理形态;免疫组织化学检测细胞凋亡;RT-PCR和ELISA检测肠道和血清肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)、白细胞介素1(IL-1)表达,Western blot法检测肠组织Wnt、β-catenin、p53、Bax和BCL-2表达。结果 与Sham组相比,IRI组IL-6、IL-1、TNF-α、Wnt、β-catenin、p53、Bax、细胞凋亡和肠道病理改变明显增加,而BCL-2表达明显减少。与IRI组相比,EGCG组IL-6、IL-1、TNF-α、Wnt、β-catenin、p53、Bax、细胞凋亡和肠道病理改变明显减少,而BCL-2表达明显增加。与EGCG组相比,Wnt-Ag组IL-6、IL-1、TNF-α、Wnt、β-catenin、p53、Bax、细胞凋亡和肠道病理改变明显增加,而BCL-2表达明显减少。结论 EGCG可通过抑制炎症和凋亡而减轻肠缺血再灌注损伤,这种保护作用可能是通过抑制Wnt/β-catenin信号途径介导。
表没食子儿茶素没食子酸酯;肠缺血再灌注损伤;Wnt/β-catenin/p53
肠缺血再灌注损伤是指肠道供血中断后,重新恢复肠道血供导致肠道损伤进一步加重的临床危相,好发于绞榨性肠道梗阻、休克、坏死性肠炎、心脏体外大循环及肠移植手术等,是导致肠道功能障碍的重要原因,其发病率和致死率都较高。因此减轻肠缺血再灌注损伤具有重要的临床现实意义[1-3]。肠缺血再灌注损伤的发病机制复杂,目前尚未完全阐清,既往研究提示肠缺血再灌注损伤的发病机制包括炎症、凋亡、坏死、自噬等,其中凋亡和炎症在其中扮演至关重要的角色[1-3]。表没食子儿茶素没食子酸酯(EGCG),俗称茶多酚,是绿茶的主要提取物,既往研究发现其具有抗凋亡、抗炎、抗肿瘤等生物学活性[4-5]。有研究发现,其对肝、心脏、肾等一些重要器官缺血再灌注损伤具有保护作用[4-5]。本实验采用大鼠肠缺血再灌注损伤模型,观察EGCG对肠缺血再灌注损伤的保护作用,并初步探讨其作用机制。
1 材料与方法
1.1 实验动物 雄性SD大鼠40只,体质量(220±20)g,合格证号SCXK(京)2011-20139,由武汉大学实验动物中心提供。
1.2 试剂与仪器 白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)、白细胞介素1(IL-1)ELISA检测盒(Ebioscience,美国),EGCG(Sigma,美国)经HPLC鉴定纯度超过99%,HLY78(Sigma,美国),水合氯醛(武汉谷歌),Wnt、β-catenin、Bax、BCL-2(CST,美国),β-actin (Abgent,美国),Tunel试剂盒(南京凯基),TRIzol reagent (Invitrogen,美国),逆转录试剂盒(GeneCopoeia,美国),SYBR green(Takara,日本),RT-PCR引物(擎科生物技术有限公司)。HE染色试剂和显微镜(Olympus BX51)及成像系统(HITMAS-30)均由华西医院病理科实验室临床病理组提供。
1.3 方法
1.3.1 分组及建模 SD大鼠放置在SPF动物饲养室内喂养。适应性喂养1周后,状态良好,分为假手术组(Sham组)、肠缺血再灌注损伤组(IRI组)、EGCG预处理组(EGCG组)和Wnt激动剂HLY78组(Wnt-Ag组),每组10只。剂量参考文献[4-5],EGCG组在缺血前45 min腹腔注射EGCG (50 mg/kg),Wnt-Ag组在缺血前 45 min腹腔注射EGCG (50 mg/kg)+Wnt-Ag (5 mg/kg),Sham组和IRI组腹腔注射等量生理盐水。具体手术方式如下:大鼠在腹腔注射10%水合氯醛(4 mL/kg)麻醉状态下,行腹部正中切口,钝性分离肠系膜上动脉(SMA)根部,用微血管夹夹闭SMA根部,完全阻断血流45 min后松开血管夹,恢复肠道血流形成再灌注。缝合腹部,再灌注4 h后处死大鼠,收集标本。Sham组操作同上,但开腹后不夹闭SMA[6]。
1.3.2 肠道组织学检查 小肠组织切片经10%中性甲醛固定、石蜡包埋,HE染色之后,在光镜下观察小肠组织病理学变化。小肠损伤程度用积分法评估[6]:0分为正常绒毛和腺体;1分为部分绒毛顶部上皮轻度受损;2分为上皮下腺体轻度受损;3分为上皮下间隙扩大,毛细血管充血;4分为上皮与固有层中度分离,腺体受损;5分为部分绒毛顶部脱落;6分为绒毛脱落明显,毛细血管扩张;7分为固有层绒毛脱落,腺体受损明显;8分为固有层开始消化分解;9分为出血、溃疡。
1.3.3 细胞凋亡的检测 利用Tunel凋亡试剂盒检测肠组织细胞凋亡,凋亡细胞(阳性细胞)为细胞核染成棕黄色,非凋亡细胞(阴性细胞)胞核为蓝色,具体方法参考说明书。
1.3.4 RT-PCR和ELISA检测 称取适量肠组织,置入1.5 mL EP管中,利用 TRIzol 法提取总RNA,紫外分光光度计测定RNA含量。采用 TaqMan Reverse Transcription Reagents试剂盒,将mRNA反转录成cDNA。取反转录产物采用Power SYBR Green PCR Master Mix试剂盒进行实时定量 PCR 反应。PCR 以β-actin为内参,具体方法参考文献[6]。TNF-α:上游引物5′-GCC TCG TCT CAT AGA CAA GAT GGT-3′,下游引物5′-GAA GGC AGC CCT GGT AAC C-3′;IL-1:上游引物5′-TCT CGC CCA GGG AGT GCA AAG AGA G-3′,下游引物5′-TCT CGC CCA GGG AAC ATC TCG AAG CG-3′;IL-6:上游引物5′-CTG CAA GAG ACT TCC ATC CAG-3′,下游引物5′-AGT GGT ATA GAC AGG TCT GTT GG-3′;β-actin:上游引物5′-AGA GGG AAA TCG TGC GTG AC-3′,下游引物5′-CAA TAG TGA TGA CCT GGC CGT-3′。SYBR实时定量PCR法检测TNF-α、IL-6和IL-1 mRNA相对表达基于比较CT(threshold cycle)值法,每个样本的mRNA水平用各内参β-actin含量进行标准化,用得到的各样本的Ct值按公式2-ΔΔCT计算相对表达量。取各组血清按照ELISA试剂盒说明书操作步骤检测血清中IL-6、TNF-α和IL-1表达水平。
1.3.5 Western blot检测蛋白表达 取肠组织按照每50 mg组织中加入1 mL RIPA裂解液(以1∶50加入50×cocktail),冰上匀浆,裂解30 min后,4 ℃ 12 000 r/min离心30 min后取上清,BCA法测定蛋白浓度。以含50 μg蛋白质的上样量,经十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳(5 %浓缩胶,10 %分离胶,恒压80~100 V)后转膜(PVDF膜,恒流300 mA),然后洗膜,以5%脱脂奶粉(TBST配制)封闭1 h,Wnt(1∶1 000)、 β-catenin(1∶1 000)、p53(1∶1 000)、Bax(1∶500)、BCL-2(1∶1 000)、β-actin(1∶3 000)单抗孵育过夜,再次振洗后加入羊抗兔IgG-HRP(二抗)37 ℃孵育1 h。洗膜后加ECL试剂,Kodak化学发光仪曝光显示目的蛋白,并拍照。以Quantity one对条带进行定量分析,以目的条带和β-actin条带积分灰度值比值作为结果。

2 结 果
2.1 各组病理学变化 与Sham组相比,IRI组小肠黏膜上皮下间隙扩大,腺体受损及毛细血管充血、水肿,肠道组织有大量绒毛脱落、糜烂、炎性细胞浸润、肠道组织结构破坏明显增加(P<0.05),其损伤评分为(6.0±1.0)分,而Sham组损伤评分为(0.5±0.2)分。与IRI组相比,EGCG组肠道病理改变明显减少(P<0.05),其损伤评分为(3.5±0.5)分。与EGCG组相比,Wnt-Ag组肠道病理改变明显增加(P<0.05),其损伤评分为(5.5±0.5)分。见图1。
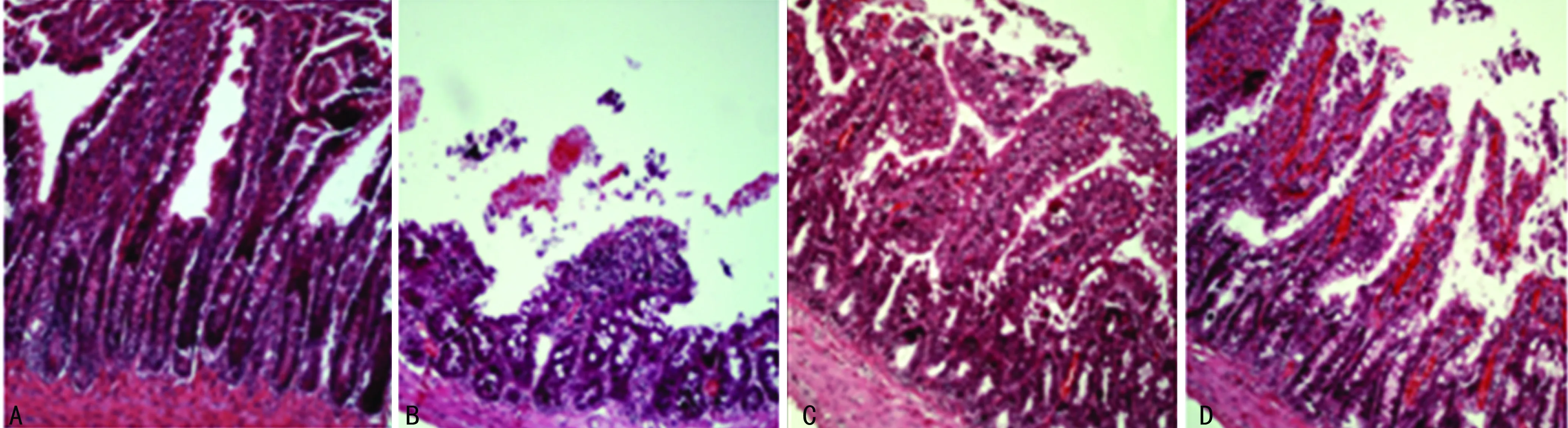
A:Sham组;B:IRI组;C:EGCG组;D:Wnt-Ag组
图1 各组肠组织病理学变化(×200)

A:Sham组;B:IRI组;C:EGCG组;D:Wnt-Ag组

图2 各组肠道细胞凋亡情况(×200)
*:P<0.01,与Sham组比较;#:P<0.05,与IRI组比较;△:P<0.05,与EGCG组比较
2.2 各组肠道细胞凋亡情况 与Sham组相比,IRI组的凋亡细胞明显增加(P<0.05);与IRI组相比,EGCG组的凋亡细胞明显减少(P<0.05);与EGCG组相比,Wnt-Ag组的凋亡细胞明显增加(P<0.05)。见图2。
2.3 各组TNF-α、IL-6和 IL-1 的表达比较 与Sham组相比,EGCG组IL-6、IL-1 和TNF-α表达明显增加(P<0.05);EGCG组与IRI组、Wnt-Ag组相比明显减少(P<0.05)。见表1。
2.4 各组Bax、BCL-2蛋白表达情况 与Sham组相比,EGCG组促凋亡蛋白Bax表达明显增加(P<0.05),而抗凋亡蛋白BCL-2明显减少(P<0.05)。与IRI组相比,EGCG组促凋亡蛋白Bax表达明显减少(P<0.05),而抗凋亡蛋白BCL-2明显增加(P<0.05)。Wnt-Ag组与EGCG组相比,促凋亡蛋白Bax表达明显增加(P<0.05),而抗凋亡蛋白BCL-2明显减少 (P<0.05)。见图3、表2。

图3 各组Bax、BCL-2蛋白表达情况
2.5 各组Wnt、β-catenin和p53蛋白表达情况 与Sham组相比,IRI组Wnt、β-catenin和p53蛋白表达明显增加(P<0.05);EGCG组与IRI组相比Wnt、β-catenin和p53蛋白表达明显减少 (P<0.05);Wnt-Ag 组与EGCG组相比,Wnt、β-catenin和p53蛋白表达明显增加 (P<0.05)。见图4、表3。

表2 EGCG对Bax、BCL-2蛋白表达影响
*:P<0.05,与Sham组比较;#:P<0.05,与IRI组比较;△:P<0.05,与Wnt-Ag组比较
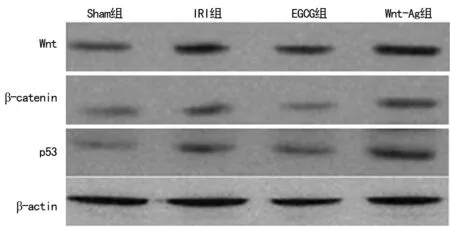
图4 各组Wnt、β-catenin和p53蛋白表达情况

组别Wnt/β-actinβ-catenin/β-actinp53/β-actinSham组0.17±0.030.05±0.020.04±0.02IRI组0.47±0.08*0.18±0.03*0.22±0.03*

续表3 EGCG对Wnt、β-catenin和p53蛋白表达影响
*:P<0.05,与Sham组比较;#:P<0.05,与IRI组比较;△:P<0.05,与Wnt-Ag组比较
3 讨 论
肠道缺血再灌注损伤诱发肠道缺血缺氧、炎症反应及肠壁通透性改变,不仅导致肠道局部受损,还引发肠道黏膜屏障广泛破坏,致使肠道内细菌广泛移位、进而引起炎性细胞因子和炎症介质广泛释放,并广泛激活机体程序性细胞凋亡,故而引发肠道功能严重受损伤,以及缺血再灌注损伤患者预后不佳的重要原因[7-10]。此外,大量研究表明抑制炎症和凋亡是减轻缺血再灌注损伤的有效治疗途径。TNF-α是诱发炎性反应的始动因子,是炎症反应早期损伤内皮细胞的重要原因[2-3]。IL-6、IL-1是继发性于内皮细胞受损后产生的炎症因子,可损伤肠道黏膜和组织细胞,导致肠道功能受损[1-3]。Bax是促凋亡蛋白,其与Tunel表达水平的变化可反映体内凋亡的程度。BCL-2是机体主要的抗凋亡蛋白,可抑制肠道黏膜细胞广泛死亡,发挥抗凋亡的功效,其表达量可反映机体抗凋亡的能力。既往研究显示,EGCG具有抗炎和抗凋亡的活性,可减少脓毒血症诱发的全身炎症因子的表达。TNF-α是肠道缺血再灌注损伤预后不佳的重要原因,但具体机制尚不清[4-5],而EGCG能减少TNF-α在缺血再灌注损伤大鼠的表达水平,抑制缺血再灌注损伤相关的炎症反应[4-5]。本实验通过检测大鼠细胞凋亡,Bax、BCL-2、IL-6、IL-1和TNF-α的表达及肠道黏膜形态改变来评估缺血再灌注损伤后凋亡、炎症及肠道损伤程度。结果显示,与Sham组相比,IRI组细胞凋亡、IL-6、IL-1、TNF-α、Bax表达水平及肠道损伤明显增加,而BCL-2表达明显减少,这与既往研究提示缺血再灌注损伤导致的肠道黏膜损伤与凋亡和炎性反应相关相一致。而EGCG组与IRI组相比,细胞凋亡、IL-6、IL-1、TNF-α、Bax表达水平及肠道损伤明显减少,而BCL-2表达增加。提示EGCG可通过抗凋亡和抗炎减轻缺血再灌注损伤。而EGCG抑制凋亡和炎症的具体机制尚不清。
Wnt/β-catenin信号通路是体内重要的促炎/凋亡信号途径之一[11-12]。既往研究显示,肠道缺血再灌注损伤时可激活Wnt/β-catenin信号通路,
作用于下游的如p53靶点,导致BCL-2/Bax表达下调和TNF-α表达上调,从而导致肠道严重受损[11-12]。EGCG组能抑制Wnt/β-catenin信号通路激活,下调p53、Bax和细胞凋亡表达,但上调BCL-2表达,从而减轻肠道缺血再灌注损伤。为了进一步证实,EGCG对肠道缺血再灌注损伤的保护作用与抑制Wnt/β-catenin信号通路相关。本实验选用Wnt特异性激动剂HLY78,进一步观察EGCG对缺血再灌注损伤的保护作用与Wnt/β-catenin信号通路的关联。结果显示HLY78可逆转EGCG抑制凋亡和炎症因子释放的作用。由此推断,EGCG可通过抑制Wnt/β-catenin/p53信号途径而减轻肠道缺血再灌注损伤。
综上所述,EGCG预处理可通过抑制凋亡和炎症因子的释放而保护肠道缺血再灌注损伤,这种保护作用部分是通过抑制Wnt/β-catenin/p53信号途径,具体的机制尚需继续深入研究。
[1]Gonzalez LM,Moeser AJ,Blikslager AT,et al.Animal models of ischemia-reperfusion-induced intestinal injury:progress and promise for translational research[J].Am J Physiol Gastrointest Liver Physiol,2015,308(1):63-75.
[2]Bhattacharyya A,Chattopadhyay R,Mitra S,et al.Oxidative stress:an essential factor in the pathogenesis of gastrointestinal mucosal diseases[J].Physiol Rev,2014,94(5):329-354.
[3]Lenaerts K,Ceulemans LJ,Hundscheid IH,et al.New insights in intestinal ischemia-reperfusion injury:implications for intestinal transplantation[J].Curr Opin Organ Transplant,2013,18(4):298-303.
[4]Legeay S,Rodier M,Fillon L,et al.Epigallocatechin gallate:A review of its beneficial properties to prevent metabolic syndrome[J].Nutrients,2015,7(30):5443-5468.
[5]Camfield DA,Stough C,Farrimond J,et al.Acute effects of tea constituents L-theanine,caffeine,and epigallocatechin gallate on cognitive function and mood:a systematic review and meta-analysis[J].Nutr Rev,2014,72(6):507-522.
[6]Ji YY,Wang ZD,Wang SF,et al.Ischemic preconditioning ameliorates intestinal injury induced by ischemia-reperfusion in rats[J].World J Gastroenterol,2015,21(70):8081-8088.
[7]Grootjans J,Lenaerts K,Buurman WA,et al.Life and death at the mucosal-luminal interface:New perspectives on human intestinalischemia-reperfusion[J].World J Gastroenterol,2016,22(9):2760-2770.
[8]Dalal A.Intestinal transplantation:The anesthesia perspective[J].Transplant Rev (Orlando),2016,30(2):100-108.
[9]Trentadue G,Dijkstra G.Current understanding of alloimmunity of the intestinal graft[J].Curr Opin Organ Transplant,2015,20(3):286-294.
[10]von Websky MW,Kalff JC,Schöfer N.Current knowledge on regulation and impairment of motility after intestinal transplantation[J].Curr Opin Organ Transplant,2015,20(3):303-307.
[11]Charni M,Rivlin N,Molchadsky A,et al.p53 in liver pathologies-taking the good with the bad[J].J Mol Med (Berl),2014,92(20):1229-1234.
[12]Xia Y,He Z,Liu B,et al.Downregulation of Meg3 enhances cisplatin resistance of lung cancer cells through activation of the Wnt/β-catenin signaling pathway[J].Mol Med Rep,2015,12(32):4530-4537.
Protective effect of epigallocatechin-3-gallate on intestine ischemia reperfusion injury
YangXukun1,ShenQing2,DuYu1△
(1.DepartmentofICU,WestChinaFourthHospital,SichuanUniversity,Chengdu,Sichuan610041,China;2.DepartmentofRadiology,363HospitalofChinaAviationIndustry,Chengdu,Sichuan610041,China)
Objective To investigate the effect and mechanism of epigallocatechin-3-gallate(EGCG) on intestine ischemia reperfusion injury(IRI) in rats. Methods Forty SD rats were randomly and equally divided into 4 groups:sham group(Sham),intestinal ischemia reperfusion injury group(IRI),EGCG pretreatment group(EGCG) and HLY78 group (Wnt-Ag ).The IRI,EGCG and WNT-AG groups were performed the superior mesenteric artery(SMA) ligation for 45 min by non-injury vascular clamp to construct the IRI model.EGCG (50 mg/kg) was administrated by intraperitoneal injection at 45 min before ischemia in EGCG group.The Wnt-Ag group was administrated by intraperitoneal injection of EGCG(50 mg/kg) plus Wnt-Ag (5 mg/kg) at 45 min before ischemia.The IRI group and Sham group were administrated by same dosage of normal saline.The pathological morphology of intestinal tissue was observed by staining at 4 h after reperfusion.The cellular apoptosis was detected by immunohistochemistry.The expressions of tumor necrosis factor-α(TNF-α),interleukin- 1(IL-1),interleukin- 6(IL-6) in the serum and intestinal tract were examined by ELISA and RT-PCR.The expressions of Wnt,β-catenin,p53,Bax and BCL-2 were measured by Western blot.Results Compared with the Sham group,the expression of IL-6,IL-1,TNF-α,Wnt,β-catenin,Bax,cell apoptosis and pathological change of intestinal tract in the IRI group were significantly increased,while the expression of BCL-2 was significantly decreased.Compared with the IRI group,the expression of IL-6,IL-1,TNF-α,Wnt,β-catenin,p53,Bax,cell apoptosis and the pathological change of intestinal tracrt in the EGCG group were significantly decreased,while the expression of BCL-2 was significantly increased.Compared with the EGCG group,the expression of IL-6,IL-1,TNF-α,Wnt,β-catenin,Bax,cell apoptosis and pathological change of intestinal tract in the Wnt-Ag group were increased,while the expression of BCL-2 was significantly decreased.Conclusion EGCG can alleviate intestine ischemia-reperfusion injury by suppressing inflammation and apoptosis,this protective effect may be mediated by suppressing Wnt/β-catenin signal pathway.
EGCG;intestine ischemia-reperfusion injury;Wnt/β-catenin/p53
杨旭堃(1986-),住院医师,硕士,主要从事重症医学研究。△
,E-mail:4717154@qq.com。
��·基础研究
10.3969/j.issn.1671-8348.2017.20.005
R574
A
1671-8348(2017)20-2751-04
2017-02-07
2017-04-12)

