苦参叶生物总碱提取工艺的优化及含量测定
陆平祝 常楚瑞 龙庆德 王晓丽 许德勇


摘要[目的]优化苦参叶生物总碱的提取工艺,并测定其所含的生物碱含量。[方法]采用紫外分光光度法进行单因素试验和正交试验,考察乙醇体积分数、料液比、提取温度、提取时间、提取次数对苦参叶总生物碱含量的影响,并采用高效液相色谱法对生物碱含量进行测定。[结果]苦参叶生物总碱的最优提取工艺为:料液比1∶25,90 ℃水浴,80%乙醇,回流提取1次,提取时间2 h;苦参叶中苦参碱、槐定碱、氧化苦参碱含量较高。[结论]紫外分光光度法的生物总碱提取率高,稳定性、重现性好;苦参叶含有5种指标性成分,其中苦参碱和氧化苦参碱的含量总和符合药典规定含量,叶的潜在应用价值大,为苦参叶的研发提供理论依据。
关键词苦参叶;生物碱;工艺优化;含量测定;紫外分光光度法;HPLC
中图分类号R284.2文献标识码A文章编号0517-6611(2017)17-0096-04
Abstract[Objective] The research aimed to optimize the extraction process of total alkaloids from Sophora flavescens leaves and determine the alkaloid content.[Method]The single factor test and orthogonal test were carried out by UV spectrophotometry,the optimum conditions of the extraction of total alkaloids from Sophora flavescens leaves were studied by ethanol volume fraction,solidliquid ratio,extraction temperature,extraction time and extraction times.And the content of alkaloids was determined by high performance liquid chromatography(HPLC).[Result]The optimal extraction process of total alkaloids from Sophora flavescens leaves was as follows:solidliquid ratio was 1∶25,90 ℃ water bath,80% ethanol,reflux extraction one time,extraction time 2 h.The contents of matrine,sophoridine,oxymatrine were relatively high in Sophora flavescens leaves.[Conclusion] UV spectrophotometric method has stability,reproducibility and higher extraction ratio.Sophora flavescens leaves contain five kinds of indicator components,in which the total content of matrine and oxymatrine meets the requirements of pharmacopoeia.The potential application of the leaves is great,which provides the theoretical basis for the development of Sophora flavescens leaves.
Key wordsSophara flavescens Ait.leaves;Alkaloids;Process optimization;Content determination; UV spectrophotometry;HPLC
基金項目贵州省中药现代化科技产业研究开发专项(黔科合ZY字〔2012〕3004号);贵州省科技计划项目(黔科合重大专项字〔2015〕6009-2)。
作者简介陆平祝(1990—),女,侗族,贵州黎平人,硕士研究生,研究方向:中草药研发。*通讯作者,副教授,从事中草药研发工作。
收稿日期2017-03-31
苦参为豆科植物苦参(Sophara flavescens Ait.)的干燥根,其性味苦,性寒,有小毒[1]。作为传统的中药,临床上主要应用其根部,其主要成分含有苦参碱、氧化苦参碱、槐定碱、槐果碱、氧化槐果碱。在中医临床应用中,苦参与其他中草药配伍,可治疗多种疾病[2-3]。通过现代医学对苦参药理毒性的全面分析和深入试验研究,使苦参的应用范围和领域扩大,苦参原料的用量也逐年增长。笔者采集样品和考察苦参生态环境因子时发现苦参叶常被废弃,现已经完成了苦参根、茎、叶生物总碱含量累积与生态因子的相关性初步研究,发现苦参叶生物总碱含量相对较高[4],而目前对苦参叶的提取工艺研究鲜见报道。紫外分光光度法是鉴别苦参化合物的一种重要技术,目前广泛用于测定中药的总碱,该技术适合批量药材的检测。该试验采用紫外分光光度法进行单因素试验[5-7]和正交试验,测定苦参叶总生物碱类化合物的含量,优化苦参叶的提取工艺,并采用高效液相色谱测定5种指标性生物碱,以期提高整株植物的药用价值和经济效益。
1材料与方法
1.1材料
1.1.1儀器。METTLER TOLEDO电子天平(梅特勒-托利多仪器上海有限公司);AS系列超声波清洗机(天津奥特赛恩斯仪器有限公司,250 W,100 kHz);Q-250B高速多功能粉碎机(上海冰都电器有限公司);UV-5800PC型紫外可见分光光度计(上海元析仪器有限公司);HH-Z数显恒温水浴锅(常州澳华仪器有限公司);DROGON移液枪(上海恒奇仪器有限公司);Agilent1100(VWD)。
1.1.2试材。苦参叶,2015年6月份上旬采摘于贵州黎平县高屯镇;苦参碱、氧化苦参碱、槐定碱标准品(中国食品药品检定研究院,批号110805-200508、110780-201007、110784-200804);槐果碱、氧化槐果碱标准品(上海源叶生物科技有限公司,批号Z25A16L17029、Z18S6B3547);乙腈、无水乙醇为色谱纯,甲醇、无水乙醇为分析纯,科伦试剂有限公司。
1.2方法
1.2.1对照品溶液的制备。
1.2.1.1苦參碱对照品。精密取苦参碱对照品5 mg,加到25 mL容量瓶中,加无水乙醇制成0.2 g/L的对照品溶液,即得。
1.2.1.2混合对照品。精密称取苦参碱对照品、氧化苦参碱对照品、槐果碱对照品、槐定碱对照品、氧化槐果碱对照品,用甲醇溶解并制成含槐果碱0.022 9 mg/mL、苦参碱0083 2 mg/mL、氧化苦参碱0.491 2 mg/mL、槐定碱0.104 4 mg/mL、氧化槐果碱0.376 2 mg/mL的对照品储备液。
1.2.2苦参碱标准曲线的绘制。
1.2.2.1测定波长的选择。微量移液枪吸取对照品溶液100 μL分别加入25 mL具塞试管中,85 ℃水浴蒸干溶液后,加入溴麝香草酚蓝磷酸氢二钠缓冲溶液6 mL(pH=7.6),再精密加入三氯甲烷6 mL,密塞剧烈振摇2 min,放置30 min,使水层和三氯甲烷层完全分层后,弃去上清液;以0 mL对照品溶液,按照同样方法得到空白对照。在紫外分光光度计200~800 nm进行扫描,结果显示对照品溶液在416 nm 处有最大吸收,故选择416 nm作为含量测定的波长,与报道的相关文献相符[8]。
1.2.2.2 标准曲线的绘制。用微量进样器精密吸取苦参碱对照品溶液0、100、150、200、250、300 μL分别加入25 mL具塞试管中,按照“1.2.2.1”方法测定其吸光度,以苦参总碱浓度为横坐标、吸光度为纵坐标绘制标准曲线,得出线性回归方程为y=0.043 9x+005 9(R2=0.999 2),表明苦参碱在255~6.80 μg/mL有良好的线性关系。
1.2.3单因素试验设计。
1.2.3.1提取次数考察。取苦参叶3份,每份精密称定20 g,于80 ℃水浴中,25倍量80%乙醇分别回流提取1、2、3次,每次1.0 h,按“1.2.2”方法测定苦参生物总碱。
1.2.3.2提取时间考察。取苦参叶4份,每份精密称定2.0 g,于85 ℃水浴中,25倍量80%乙醇分别回流提取1.0、1.5、2.0、2.5 h,按“1.2.2”方法测定苦参生物总碱。
1.2.3.3料液比考察。取苦参叶4份,每份精密称定2.0 g,于85 ℃水浴中,分别用15、20、25、30、35倍量的80%乙醇分别回流提取1 h,按“1.2.2”方法测定苦参生物总碱。
1.2.3.4乙醇体积分数考察。取苦参叶4份,每份精密称定2.0 g,于85 ℃水浴中,用25倍量70%、75%、80%、85%、90%乙醇分别回流提取2 h,按“1.2.2”方法测定苦参生物总碱。
1.2.3.5提取温度考察。取苦参叶4份,每份精密称定2.0 g,分别于70、75、80、85、90 ℃水浴中,用25倍量80%乙醇分别回流提取2 h,按“1.2.2”方法测定苦参生物总碱。
1.2.4供试品溶液的制备。将苦参叶粉碎过3号筛(60目),精密称取苦参叶粉末,利用单因素试验中不同提取条件进行回流提取,所得提取液加入石油醚萃取5~6次,萃取至石油醚层颜色明显变浅,弃去石油醚萃取液,目的是为了除去色素、树脂等脂溶性杂质,得到苦参叶萃取溶液[9-10]。
1.2.5苦参生物总碱测定。微量加样枪吸取供试品溶液150 μL加入25 mL具塞试管,按“1.2.2”方法测定苦参生物总碱。
1.2.6正交试验法对苦参叶生物总碱提取工艺的优化。综合单因素试验,选取影响苦参叶生物总碱的料液比(A)、乙醇体积分数(B)、提取温度(C)、提取时间(D)4个因素,以苦参生物总碱提取率为参考指标,分别取4因素3水平对苦参叶中生物碱的提取条件进行优化,正交试验因素和水平见表1。
1.2.7HPLC色谱条件。色谱柱为Inertsil NH2(5 μm,4.6 mm×250 mm);流动相为乙腈:无水乙醇:3%磷酸(84∶10∶6),检测波长210 nm;柱温30 ℃;进样量10 μL;理论板数大于8 000。
2结果与分析
2.1单因素试验
2.1.1提取次数考察。由图1可知,苦参叶生物总碱提取率随着提取次数的增加有明显的下降趋势,由于提取次数为非连续变量,回归处理困难,固定提取次数为1次。
2.2.2提取时间考察。由图2可知,提取时间在1.0~2.0 h,苦参叶生物总碱提取率增加,在2.0 h苦参叶生物总碱提取率最高,随着时间的延长,苦参叶生物总碱提取率稍有下降。因此,最佳的提取时间是2.0 h。
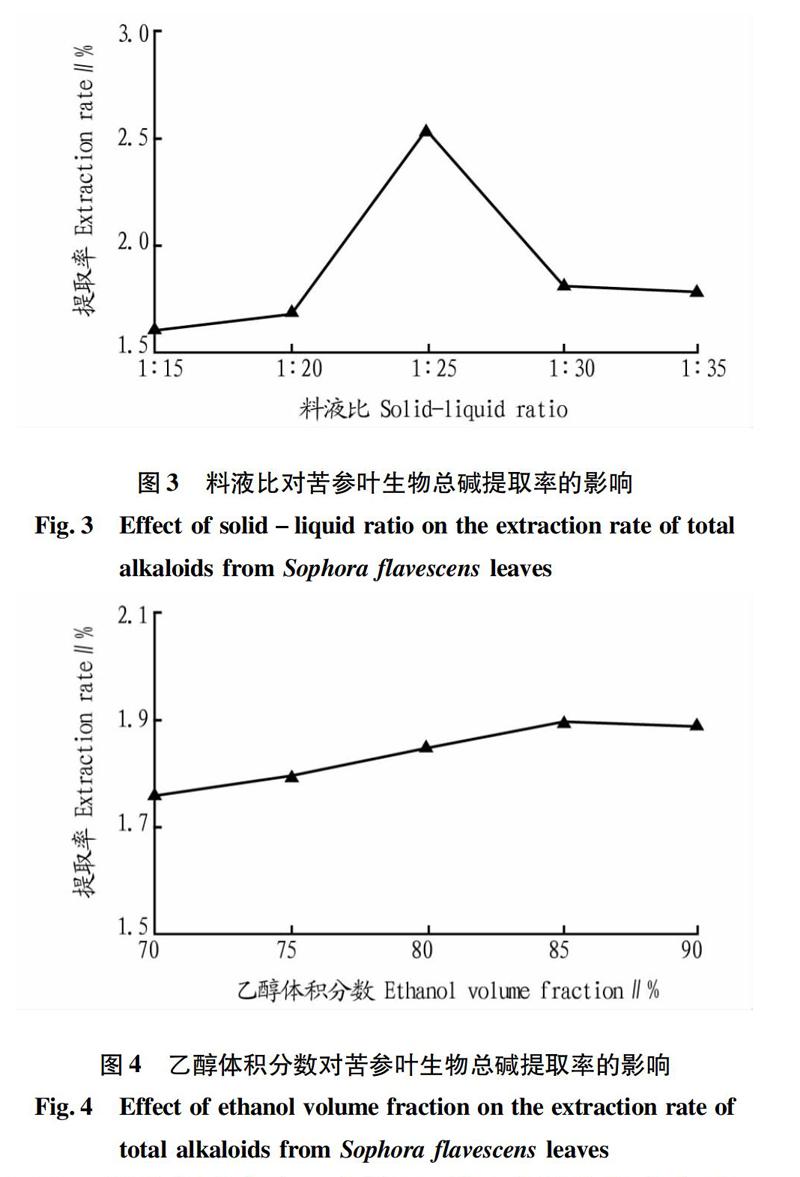
2.2.3料液比考察。由图3可知,料液比在1∶15~1∶25,苦参叶生物总碱提取率一直处于上升趋势,料液比在1∶25时提取率达最高,随着料液比不断增加,苦参叶生物总碱提取率急速下降。因此,最适宜的料液比是1∶25。
2.2.4乙醇体积分数考察。由图4可知,在乙醇体积分数为70%~85%時,苦参叶生物总碱提取率随着乙醇浓度的增加而增大,在乙醇体积分数85%时苦参叶生物总碱提取率达到最高,随后又下降的趋势。因此,选择乙醇体积分数为85%最合适。
2.2.5提取温度考察。由图5可知,在提取温度为70~85 ℃时,苦参叶生物总碱的提取率随温度的升高而增加,提取温度为85 ℃有利于苦参叶生物总碱的提取,而随温度的升高,苦参叶生物总碱提取率有下降趋势。因此,最佳的提取温度为85 ℃。
2.2正交试验从表2可以看出,各因素对苦参叶生物总碱提取率的影响从大到小依次为A、C、D、B;方差结果表明,A、C对苦参叶生物总碱提取率有显著影响(P<0.05),B、D的影响较小。由极差R可知,苦参叶生物总碱的最佳提取条件为A2B1C3D3,即料液比为1∶25,乙醇体积分数为80%,提取温度为90 ℃,提取时间为2 h。
经过正交试验得出最佳的提取工艺参数为:料液比为1∶25,在90 ℃水浴中80%乙醇回流提取1次,提取時间2 h;在此条件下,苦参叶生物总碱提取率的预测值为2.83%。对以上工艺参数进行验证,经过3次平行试验,得到的苦参叶生物总碱提取率平均值为2.86%,与预测值无显著差异,表明该条件下苦参叶生物总碱提取率最大。
2.3样品含量测定
2.3.1对照品和苦参供试品的图谱。优化验证下所得的溶液,精密量取“1.2.4”的苦参叶萃取液10 mL,经5 g无水硫酸钠过滤,取续滤液在85 ℃水浴锅蒸干,用甲醇溶解定容至10 mL,按照“1.2.7”色谱条件对混合对照品和供试品进行测定,所得色谱图以AIA格式导入“中药色谱指纹图谱相似度评价系统”软件[11-14]。通过中位数评价、多点校正、自动匹配,生成具有综合特征信息的参照图谱(图6a),再通过该软件中“参照图谱入档”导入3份供试品提取物(图6b),其与对照品图的保留时间对比发现(图6),在相同的位置有相应的色谱峰,其中1號峰为槐果碱,2号峰为苦参碱,3号峰为氧化槐果碱,4号峰为槐定碱,5号峰为氧化苦参碱。
2.3.2苦参叶的含量测定。精密量取“1.2.4”苦参叶萃取液10 mL,经5 g无水硫酸钠过滤,取续滤液在85 ℃水浴锅蒸干,用甲醇溶解定容至10 mL,按照“1.2.7”色谱条件测定含量,结果显示(表3),苦参叶含有的5种生物碱的含量从大到小依次为氧化苦参碱、槐定碱、苦参碱、槐果碱、氧化槐果碱,其中苦参碱和氧化苦参碱的含量总和(1.25%)大于1.20%,达到《中华人民共和国药典》规定苦参药用部位的含量。
3结论与讨论
采用紫外分光光度法进行单因素试验和L9(34)正交试验,最终确定最优提取工艺条件为:料液比为1∶25,乙醇体积分数为80%,提取温度为90 ℃,提取时间为2 h。试验结果表明,该方法简单、快速、准确,可以作为测定苦参中总碱含量的一种有效方法。
考虑近几年苦参碱及氧化苦参碱有效应用于临床的需求量越来越大,资源逐年减少,该试验对总碱含量比较大的苦参叶的提取工艺进行了优化,为苦参及其制剂的进一步开放与研究提供数据分析;探讨苦参叶的含量,为苦参植物不同组织器官的合理开发利用和保护苦参植物资源提供科学依据,避免资源浪费。
参考文献
[1] 国家药典委员会.中华人民共和国药典:2010版一部[S].北京:化学工业出版社,2010:188.
[2] 付佃华,付亚杰,张栋栋.苦参碱在妇科疾病方面的实验及临床研究进展[J].基层医学论坛,2015,19(4):551-552.
[3] 冉贤金,胡虞乾.氧化苦参碱和拉米夫定体外抗乙肝病毒的比较[J].中国生化药物杂志,2012,33(2):142-144.
[4] 陆平祝,常楚瑞,龙庆德,等.黔产苦参根、茎、叶中生物碱含量累积与生态因子的相关性[J].中国实验方剂学杂志,2017,23(6):43-47.
[5] 敖道夫,巴达拉胡,布日额.正交实验法优选苦参总碱提取工艺[J].内蒙古民族大学学报(自然科学版),2009,24(1):75-78.
[6] 骆冉冉,刘文娣,邓丽莉,等.响应面法优化黄芩茎叶总黄酮提取工艺[J].食品安全质量检测学报,2013,4(6):1865-1872.
[7] 周滢,费曜.川产赶黄草不同部位的槲皮素含量比较[J].世界科学技术—中医药现代,2014,16(9):2047-2049.
[8] 杨美玲,曹新录,崔东亚,等.苦参碱的提取与含量测定[J].浙江农业科学,2011,11(2):413-415.
[9] 王晓华,朱华,王孝勋,等.广西莪术叶与根茎、块根挥发油的比较研究[J].时珍国医国药,2012,23(7):1650-1652.
[10] 田浩,石瑶,吴丽华,等.不同产地不同部位云黄连生物碱成分累积研究[J].云南大学学报(自然科学版),2012,34(5):570-576.
[11] 丁璞,王冰,宋新,等.HPLC测定五味子根茎叶中6种木脂素含量[J].中国中药杂志,2013,38(13):2078-2081.
[12] 陈晓兰,黄丽英,黄丽萍,等.不同产地金线莲根茎和叶中多糖含量对比[J].分析测试技术与仪器,2012,18(3):135-139.
[13] 吕佳,王丹,张振秋,等.HPLC同时测定苦参药材中5种生物碱含量[J].中国中医药信息杂志,2013,20(9):61-62,81.
[14] 李克,王曙东,吴龙琴,等.HPLC同时检测山豆根中苦参碱和氧化苦参碱含量[J].解放军药学学报,2014,30(1):55-57.

