水分胁迫对兰花品种“霞光”抗氧化系统的影响
徐凌彦 王瑞晶 张亚玲 王玉英 凌青

摘要[目的]研究水分胁迫对兰花品种“霞光”抗氧化系统的影响。[方法]以兰花品种“霞光”为试验材料,在水分胁迫下研究植株开花初期的丙二醛(MDA)、超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)的变化。[结果]兰花品种“霞光”植株MDA含量以及SOD、POD和CAT活性随着水分胁迫时间的延长呈上升趋势。每隔10 d浇水1次的处理已经对兰花品种“霞光”植株产生了膜脂氧化的伤害,每隔20 d浇水1次处理兰花植株的MDA含量以及SOD、POD和CAT活性均达到最大值,表明植株通过调节抗氧化物酶活性的合成代谢来应对水分胁迫。[结论]研究结果可为兰花品种“霞光”的生产栽培提供指导。
关键词兰花品种“霞光”;水分胁迫;抗氧化酶
中图分类号S682.317文献标识码A文章编号0517-6611(2017)17-0009-03
Abstract[Objective] To study the effects of water stress on the antioxidant enzymes system of orchid cultivar “Xiaguang”.[Method] Taking orchid cultivar “Xiaguang” as test materials,the changes of MDA content,SOD,POD,CAT activities of orchid cultivar “Xiaguang” under water stress at the early blossom stage were studied.[Result] MDA content,SOD,POD,CAT activities of orchid cultivar “Xiaguang” showed an increasing trend along with prolonging of water stress time.In the treatment of watering once every 10 days,oxidative damage of membrane lipid produced.In the treatment of watering once every 20 days,MDA content,SOD,POD,CAT activities of orchid cultivar “Xiaguang” all reached the maximum.That indicated the plants regulated metabolism of the activities of the antioxidant enzymes in response to water stress.[Conclusion] The research results can provide guide for the production and cultivation of orchid cultivar “Xiaguang”.
Key wordsOrchid cultivar “Xiaguang”;Water stress;Antioxidant enzymes
基金項目云南省教育厅基金项目(2011Y059);国家自然科学基金项目(30160074);云南省重点新产品开发资助项目(2012BB008);云南省昆明市科学技术局重点项目(2015-1-N-00984)。作者简介徐凌彦(1983—),女,云南昆明人,讲师,硕士,从事植物资源的利用和创新研究。*通讯作者,副教授,硕士,从事植物的利用和创新研究。
收稿日期2017-04-14
目前,世界上干旱、半干旱区域面积占土地面积的36%,遍及世界上60多个国家和地区[1]。我国也是一个干旱、半干旱面积较大的国家,其中干旱面积占30.8%。即使在非干旱区的主要农业区内,也会因为降水不均,而受到季节性干旱的侵袭,在我国的绝大部分地区干旱趋势也在不断的加剧。云南素有“世界花园”之称,尤其以山茶、杜鹃、玉兰、报春、龙胆、兰花、百合和绿绒蒿8种名花而著称。由于云南独特的气候資源优势,非常有利于花卉植物的生长,产出的花卉颜色鲜艳、茎秆挺拔、花期长而独具特色。通过简易保护方式栽培,全年都可生产鲜花和观赏植物。因此,研究水分胁迫对具有良好观赏性状的盆栽或鲜切花品种的影响,对于节约水资源、发展经济等都有重要的意义[2]。
“霞光”是由西藏虎头兰“黄素花”(Cymbidium tracyanum L.Castle)和大雪兰(Cymbidium mastersii)杂交培育而成的新品种花卉[3]。四季常绿,叶带状,每个花枝着花6~12朵,花展开时有香味,萼片和花瓣均为金黄色或卵黄色,唇瓣左右裂片之间有两行金黄色绒毛,合蕊柱背和腹面为红色,花期40~60 d。适宜生长在热带、亚热带或较温暖的地区以及气候相近的保护地里,而其适温在15~28 ℃,适应范围、温度的广泛,也为其推广栽培及观赏应用提供了可能性。
植物受到水分胁迫时会产生活性氧,对细胞造成损伤。大量研究表明,植物体内广泛存在的抗氧化酶系统[如超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等]能有效清除活性氧,保证细胞正常的生理功能,维持其对干旱胁迫的抗性。研究表明,耐旱植物在逆境条件下能使保护酶活力维持在一个较高水平,有利于清除自由基, 降低膜脂过氧化水平, 从而减轻膜伤害程度[4]。干旱条件下兰花的生理响应和抗旱性评价等方面的研究极少。郭红等[5]研究了干旱胁迫对不同栽培基质下碧玉兰的生理反应及抗性,结果表明碧玉兰叶片的相对电导率随着含水量的降低而增加,丙二醛和游离脯氨酸以及抗氧化酶活性则表现为先增后降。各种指标变化幅度随不同栽培基质而不同。王海帆等[6]研究表明碧玉兰POD活性在干旱胁迫后35 d保持比较平稳的上升趋势,42 d时出现大幅度上升;盐胁迫后呈先上升后下降的趋势。干旱胁迫下,3/4树皮+1/4泥炭所栽培碧玉兰POD活性上升较为稳定。王玉英等[7]报道了水分胁迫对兰花新品种“霞光”花期生长的影响,但对初花期植株的丙二醛(MDA)含量、POD、SOD和CAT活性变化趋势的研究鲜见报道。笔者研究了水分胁迫不同时间与对照处理下兰花品种“霞光”抗氧化系统的变化趋势,初探生殖生长初期膜脂伤害机理,旨在为其生产栽培提供指导。
1材料与方法
1.1试验材料
供试材料为兰花品种“霞光”植株,选择外形、株高和叶片数大致相当的,第3年复花的优良植株,均为自主培育的具有自主知识产权的兰株。
1.2试验方法
试验于2015年7月在云南农业大学花卉研究所大棚内进行,将挑选出的12盆植株分为4组,每组3盆,对植株进行编号。采用每隔5、10、15、20 d浇1次水的控水方法,待到植株开花的初期,于08∶00—09∶00选取开花植株的叶片,并洗净待测。栽培环境:大棚内布有20%的遮光网,栽培基质一律使用1/4树皮+1/4泥炭+1/4椰糠+1/4陶粒的混合基质[8],白天(22±2) ℃,夜晚(12±2) ℃。
1.3测定项目与方法
MDA的测定采用硫代巴比妥酸(TBA)法[9],SOD的测定采用氮蓝四唑(NBT)法[10],POD的测定采用愈创木酚法,CAT的测定采用紫外吸收法。
1.4数据处理试验数据使用Excel 2003软件进行绘制,使用dps7.05统计软件进行方差分析。
2结果与分析
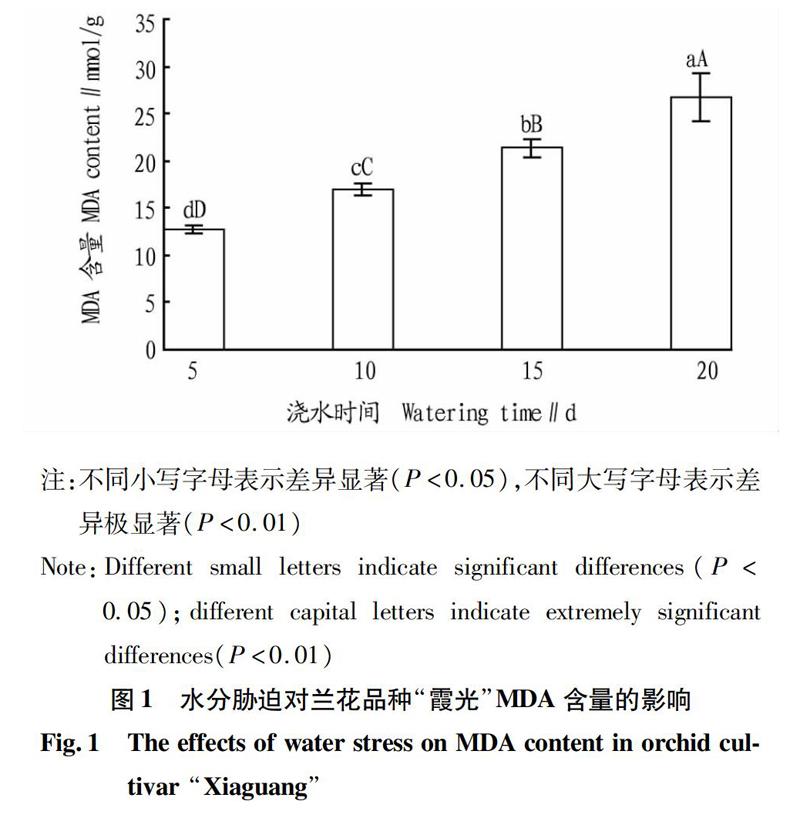
2.1水分胁迫对兰花品种“霞光”MDA含量的影响
MDA是膜脂过氧化中最重要的产物之一,植物在逆境下遭受伤害与活性氧积累诱发的膜质过氧化作用密切相关。
从图1可以看出,水分胁迫对兰花品种“霞光”植株MDA含量的影响显著。随着水分胁迫时间的延长,MDA含量逐渐增加,对照处理(每隔5 d浇水1次)MDA含量最低,而在每隔20 d浇水1次处理出现最高值,且MDA含量分别极显著高于对照处理(每隔5 d浇水1次)、每隔10 d浇水1次和每隔15 d浇水1次(P<0.01);每隔10 d浇水1次和每隔15 d浇水1次处理植株的MDA含量分别极显著高于对照处理(每隔5 d浇水1次)(P<0.01)。这表明每隔10 d浇水1次的处理就已經对兰花品种“霞光”植株产生了膜脂氧化的伤害,每隔5 d 浇水1次的处理对兰花品种“霞光”植株的膜脂氧化伤害最小,随着浇水处理间隔时间增长,对植株的膜脂伤害程度加深。
2.2水分胁迫对兰花品种“霞光”SOD活性的影响
SOD普遍存在于动植物体内,是一种清除超氧阴离子自由基的酶。SOD可清除植物体内的O2,抑制甲腙的形成,通过光还原反应后,反应液蓝色越深,说明酶活性越低,反之,酶活性就越高。
从图2可以看出,水分胁迫对兰花品种“霞光”植株SOD活性的影响显著。随着水分胁迫时间的延长,其SOD活性也逐渐增加,而对照处理(每隔5 d浇水1次)的SOD活性最低,而每隔20 d浇水1次的植株SOD出现最高值,且SOD活性分别极显著高于对照处理(每隔5 d浇水1次)、每隔10 d浇水1次和每隔15 d浇水1次(P<0.01);同时,每隔10 d浇水1次和每隔15 d浇水1次处理植株的SOD活性分别极显著高于对照处理(每隔5 d浇水1次)(P<001)。这表明采取每隔10 d浇水1次的处理SOD活性增高,而每隔5 d浇水1次处理的兰花品种“霞光”植株内的SOD活性较低。这说明兰花植株能够通过提高SOD的活性来有效清除细胞中的超氧自由基,缓解水分胁迫对细胞质的伤害。
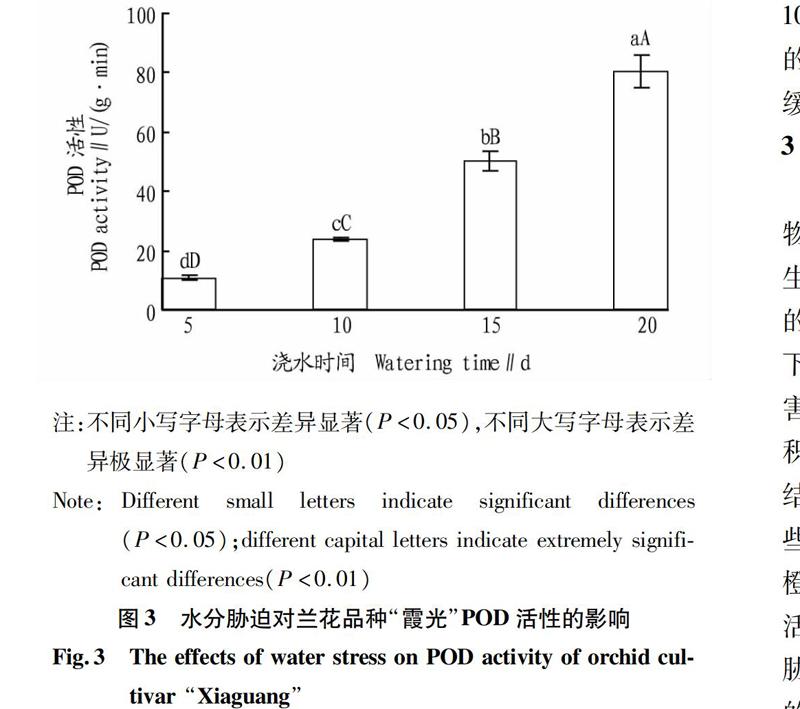
2.3水分胁迫对兰花品种“霞光”POD活性的影响
POD是植物体内普遍存在、活性较高的一种酶,它与呼吸作用、光合作用及生長素的氧化等都有密切关系,植物在生长发育过程中其活性不断发生变化,因此测定POD活性可以反映某一时期植物体内的代谢变化。
从图3可以看出,水分胁迫对兰花品种“霞光”植株内POD活性的影响显著。随着处理时间的延长,其植株内的POD活性显著增高,对照处理(每隔5 d浇水1次)POD活性最低,每隔20 d浇水1次植株内POD活性极显著高于其他处理(P<0.01);每隔10 d浇水1次、每隔15 d浇水1次处理的植株中POD活性分别极显著高于对照处理(每隔5 d浇水1次)(P<0.01)。这表明每隔10 d浇水1次的处理已对植株体内的代谢造成了一定的影响,而每隔5 d浇水1次则对兰花品种“霞光”的代谢影响较小,随处理时间的延长,植株受到的胁迫强度增强,导致植株内POD活性增强,说明兰花植株可以通过提高自身POD的活性来抵御水胁迫产生的伤害。
2.4水分胁迫对兰花品种“霞光”植株CAT活性的影响
植物在逆境下或衰老时,由于体内活性氧代谢加强使H2O2积累。H2O2可以直接或间接地氧化细胞核内核酸、蛋白质等生物大分子,并使细胞膜遭受损害,从而加速细胞的衰老和解体。CAT可以清除H2O2,这也是植物体内重要的酶促防御系统之一。由于植物组织中CAT活性与植物的抗逆性密切相关,因此其活性为机体提供了抗氧化防御机理。
从图4可以看出,水分胁迫对兰花品种“霞光”植株CAT活性的影响显著。随水分胁迫时间的延长,CAT活性逐渐增加,其中对照处理(每隔5 d浇水1次)的CAT活性最低,而在每隔20 d浇水1次的处理出现最高值,而CAT活性也分别极显著高于对照处理(每隔5 d浇水1次)、每隔10 d浇水1次和每隔15 d浇水1次(P<0.01);同时,每隔10 d浇水1次和每隔15 d浇水1次处理的植株CAT活性分别极显著高于对照处理(每隔5 d浇水1次)(P<0.01)。这表明每隔10 d浇水1次的处理已经逐渐激活CAT。这说明水
胁迫处理的植株CAT活性显著增强,可以有效清除细胞中的活性氧,缓解水胁迫对细胞质的伤害。
3讨论
花卉水分胁迫机理研究,目前主要集中在水分胁迫对植物的形态反应和生理反应的影响方面,而水分胁迫影响生殖生长期的相关研究极少。然而,水分胁迫下植物体内活性氧的积累是导致干旱胁迫的主要原因之一。在正常生长情况下,植物细胞内活性氧的产生和清除处于动态平衡,不会伤害细胞,而多种逆境胁迫都引发细胞内活性氧的过量生产、积累而打破平衡,活性氧导致膜过氧化和脱脂化从而使细胞结构和功能都受到破坏[11]。植物对胁迫的响应之一就是这些保护酶活性的变化,如小麦[12-14]、玉米[13]、花生[15]、甜橙[16]、甘蔗[17]、中山杉[18]等在干旱胁迫下均表现出保护酶活性不同程度的增加。倪书邦等[19]报道澳洲坚果花期水分胁迫条件下,各处理的SOD和POD活性随着水分胁迫强度的加剧而下降。该试验结果表明,在对照(每隔5 d浇水1次)处理,开花初期的兰花品种“霞光”植株的MDA含量及SOD、POD和CAT活性均最低,说明细胞膜所受的损伤最轻;每隔10 d浇水1次的处理已经对兰花“霞光”植株产生了膜脂氧化的伤害,每隔20 d浇水1次的处理植株的MDA含量及SOD、POD和CAT活性均达到最大值,表明在轻度、中度水分胁迫下,较高活性的保护酶系统能够有效地清除体内过多的活性氧。但随着水分胁迫强度的增加,植株内的MDA含量依然保持较高水平,表明了维持活性氧产生与清除之间尚未达到较好的动态平衡。
4结论
兰花品种“霞光”植株处于水分胁迫时,植株的MDA含量和SOD、POD和CAT活性随着水分胁迫时间的延长呈上升趋势。每隔10 d浇水1次的处理已经对兰花品种“霞光”植株产生了膜脂氧化的伤害,每隔20 d浇水1次的处理植株的MDA含量及SOD、POD和CAT活性均达到最大值,表明在轻度、中度水分胁迫下,较高活性的保护酶系统能够有效清除体内过多的活性氧,植株主要通过调节抗氧化物酶活性的合成代谢来应对水分胁迫。
参考文献
[1] 张建国,李吉跃,沈国舫.树木耐旱特性及其机理研究[M].北京:中国林业出版社,2000.
[2] 李龙梅,王毅承,张富荣.水分胁迫对二月兰生长和理化特性的影响[J].北方园艺,2011(18):77-79.
[3] 王玉英,李枝林.兰花新品种‘霞光[J].园艺学报,2013,40(5):1013-1014.
[4] BOWLER C,VAN CAMP W,VAN MONTAGU M,et al.Superoxide dismutase in plants[J].Crit Rev in Plant Sci,1994,13(3):199-218.
[5] 郭紅,王有国,李枝林.干旱胁迫对不同栽培基质下碧玉兰的生理反应及抗性分析[J].北方园艺,2012(1):79-83.
[6] 王海帆,王有国.干旱与盐胁迫下不同栽培基质碧玉兰POD活性的变化[J].亚热带农业研究,2013,9(4):235-238.
[7] 王玉英,凌青,师滢淇,等.水分胁迫对兰花“霞光”花期生长的影响[J].北方园艺,2014(24):67-69.
[8] 王玉英,凌青,苏俊,等.栽培基质及配方施肥对虎雪兰‘霞光的生长影响试验[J].西部林业科学,2013,42(6):51-56.
[9] 叶尚红.植物生理生化实验教程[M].昆明:云南出版集团公司,云南科技出版社,2010:89-90.
[10] 李合生.植物生理生化實验原理和技术[M].北京:高等教育出版社,2000:267-268.
[11] REDDY A R,CHAITANYA K V,VIVEKANANDAN M.Droughtinduced responses of photosynthesis and antioxidant metabolism in higher plants[J].Journal of plant physiology,2004,161(11):1189-1202.
[12] 王俊儒,李生秀,李凯丽.冬小麦不同生育时期水分亏缺胁迫对叶片保护酶系统的影响[J].西北植物学报,2001,21(1):47-52.
[13] 张仁和,郑友军,马国胜,等.干旱胁迫对玉米苗期叶片光合作用和保护酶的影响[J].生态学报,2011,31(5): 1303-1311.
[14] 时振振,李胜,马绍英,等.不同品种小麦抗氧化系统对水分胁迫的响应[J].草业学报,2015,24(7):68-78.
[15] 潘瑞炽, 豆志杰,叶庆生.茉莉酸甲酯对水分胁迫下花生幼苗SOD活性和膜脂过氧化作用的影响[J].植物生理学报,1995,21(3):221-228.
[16] 杨方云,魏朝富,刘英.干旱胁迫下甜橙叶片保护酶体系的变化研究[J].植物营养与肥料学报,2006,12(1): 119-124.
[17] 姚艳丽,邢淑莲,徐磊,等.水分胁迫对甘蔗、割手密和斑茅抗氧化酶活性的影响[J].甘蔗糖业,2013(6):1-4.
[18] 施钦,殷云龙,王芝权,等.中山杉及其父母本幼苗对干旱胁迫和复水的响应[J].应用生态学报,2016,27(11):3435-3443.
[19] 倪书邦,刘建福,李道高,等.澳洲坚果花期水分胁迫效应的研究[J].西南农业大学学报,2002,24(1):34-37.

