海藻酸钠包埋法固定L-阿拉伯糖异构酶的研究
王静,揣玉多,汤卫华,侯婷
(1.天津市轻工业化学研究所有限公司,天津300350;2.天津现代职业技术学院,天津300350)
海藻酸钠包埋法固定L-阿拉伯糖异构酶的研究
王静1,2,揣玉多2,汤卫华2,侯婷2
(1.天津市轻工业化学研究所有限公司,天津300350;2.天津现代职业技术学院,天津300350)
以海藻酸钠为载体,戊二醛为交联剂,对L-阿拉伯糖异构酶进行固定化。研究海藻酸钠浓度、氯化钙浓度、戊二醛浓度以及硬化时间等因素对固定化效果的影响。结果表明最佳固定化条件为:海藻酸钠浓度3.5%,氯化钙浓度3.0%,戊二醛浓度0.2%,硬化时间7 h,该条件下制备的固定化酶与游离酶相比,最适宜反应温度和pH值基本没有变化,并且具有较好的操作稳定性和贮存稳定性。
L-阿拉伯糖异构酶;固定化;海藻酸钠;戊二醛
L-阿拉伯糖异构酶是一种胞内酶,能催化合成D-塔格糖、L-核酮糖等稀有功能糖,在食品和医药领域有着重要应用[1-3]。其中L-核酮糖可经过一步生物催化转化得到L-核糖,L-核糖在食品和药物上具有巨大的潜在生物活性,而L-核酮糖是制备L-核糖最有效的生物合成途径,其中L-阿拉伯糖异构酶是生物法生产L-核酮糖最有效的酶之一[4-6]。近年来,国内外研究报道一些可用来发酵生产L-阿拉伯糖异构酶的微生物,但这些微生物产酶水平均较低[7-9],若以游离酶形式生产L-核酮糖,存在添加量偏大且不利于产品的分离纯化等缺点,造成生产成本高,不利于实现工业化生产。而固定化可以使酶具有酶活稳定、易回收、可重复使用等优点,这样可以减少L-阿拉伯糖异构酶的使用量,从而相应地降低L-核酮糖的生产成本。本文以海藻酸钠为载体,对影响L-阿拉伯糖异构酶固定化的主要因素进行研究,并研究固定化后L-阿拉伯糖异构酶的酶学性质,为固定化L-阿拉伯糖异构酶的应用提供理论依据。
1 材料与方法
1.1 药品与仪器
L-阿拉伯糖异构酶(酶活42.6 U/mL):天津现代学院生物实验室自制;海藻酸钠、无水氯化钙、25%戊二醛溶液、硫酸、咔唑、无水乙醇:国药集团化学试剂有限公司;L-阿拉伯糖、L-核酮糖、2-(N-吗啉代)磺酸基乙烷(MES)、半胱氨酸盐酸盐:Sigma公司。
UV-5500紫外可见分光光度计:上海元析仪器有限公司;PHS-3C pH计、电子天平:梅特勒-托利多仪器上海有限公司;HNY2012C恒温摇床:上海百典仪器有限公司;HH-1数显恒温水浴锅:嘉兴市中新医疗仪器有限公司。
1.2 试验方法
1.2.1 酶的固定化
将10 mL充分溶解的海藻酸钠溶液与5 mL的游离酶液混合搅拌。用6号针头的注射器将上述混合液以60滴/min的速度滴入氯化钙溶液中,即形成大小均一的光滑颗粒,0℃~4℃条件下静置硬化一定时间。将固定化酶颗粒洗涤、抽滤干燥。再加入到一定浓度的戊二醛溶液中,室温(25℃)下振荡交联1 h,倾去溶液,分别用0.9%氯化钠和去离子水洗涤固定化酶颗粒,抽滤干燥即得固定化酶,0℃~4℃条件下保存。
1.2.2 L-阿拉伯糖异构酶酶活的测定
游离酶1 mL或固定化酶1 g加入50 mmol/L底物L-阿拉伯糖(pH7.5,MES缓冲溶液配制),50℃反应30 min,HCl停止反应,离心除去酶蛋白,将上清液适当稀释后,按BK法[10]测定L-核酮糖的浓度,并计算酶活。
L-阿拉伯糖异构酶的酶活定义为:以L-阿拉伯糖为底物,1 min内转化生成1 μg的L-核酮糖所需要的酶量为一个酶活力单位。
L-阿拉伯糖异构酶的相对酶活:设定同组酶活最高的相对酶活为100%,以同组最高酶活为参照,计算出的比值为相对酶活。
2 结果与讨论
2.1 固定化条件的优化
2.1.1 海藻酸钠浓度对固定化效果的影响
取不同浓度的海藻酸钠溶液10 mL与5 mL游离酶液混合,用注射器将上述溶液逐滴加到2.0%的氯化钙溶液中,硬化4 h,测定酶活,结果见图1。
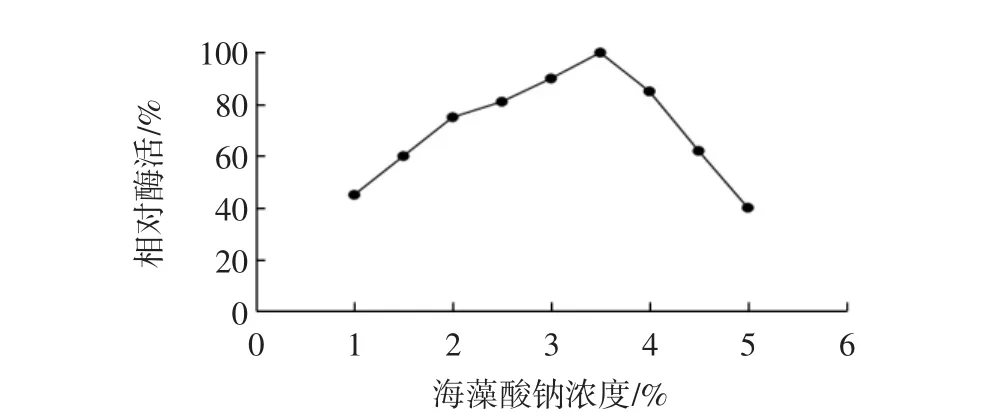
图1 海藻酸钠浓度对固定化效果的影响Fig.1 Effect of the concentration of sodium alginate on the immobilization
由图1可知,海藻酸钠浓度为3.5%时,固定化酶具有相对较高的酶活,且成型均匀,凝胶强度适中。海藻酸钠浓度过低或过高都会导致固定化酶酶活降低。这可能是由于海藻酸钠浓度太低时,形成的凝胶结构孔径较大,结构不稳定,酶容易流失;而海藻酸钠浓度较高时,溶液黏度过高,溶解困难,推压注射器费力且形成的固定化颗粒拖尾,形状不规则,酶结构受到影响,导致酶活降低。因此,选择海藻酸钠溶液浓度为3.5%。
2.1.2 氯化钙溶液浓度对固定化效果的影响
取3.5%浓度的海藻酸钠溶液10 mL与5 mL游离酶液混合,用注射器将上述溶液逐滴加到不同质量浓度的氯化钙溶液中,硬化4 h,测定酶活,结果见图2。
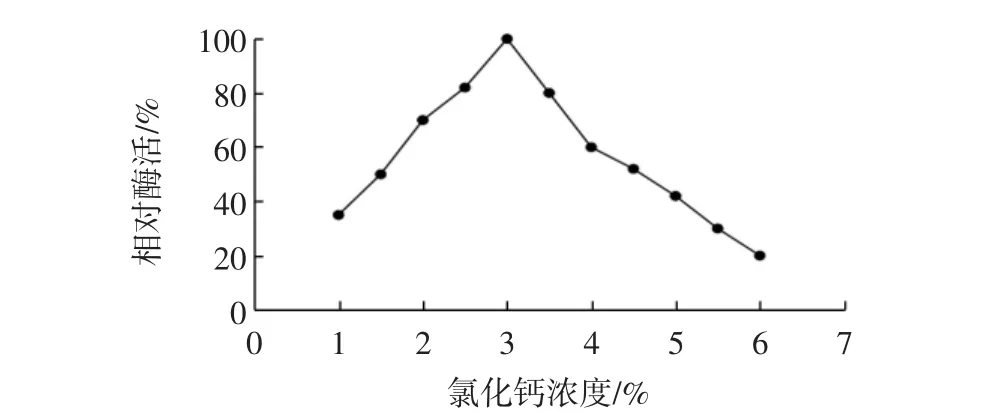
图2 氯化钙浓度对固定化效果的影响Fig.2 Effect of the concentration of calcium chloride on the immobilization
由图2可知,氯化钙浓度低于3.0%时,固定化酶活力随着氯化钙浓度的增加而增大,氯化钙浓度为3.0%时相对酶活达100%;而氯化钙浓度大于3.0%后,相对酶活随着氯化钙浓度的增大而逐渐减小。这可能是由于氯化钙浓度太低时凝胶交联度不够,包埋不完全,酶易流失,而氯化钙浓度太大时,形成的空间网状结构孔径小,高分子联结紧密,影响底物分子的扩散及其与酶的结合,不利于酶活性的发挥。因此,选择氯化钙溶液浓度为3.0%。
2.1.3 硬化时间对固定化效果的影响
保持其他固定化条件不变,分别将固定化颗粒硬化不同时间,测定酶活,结果见图3。
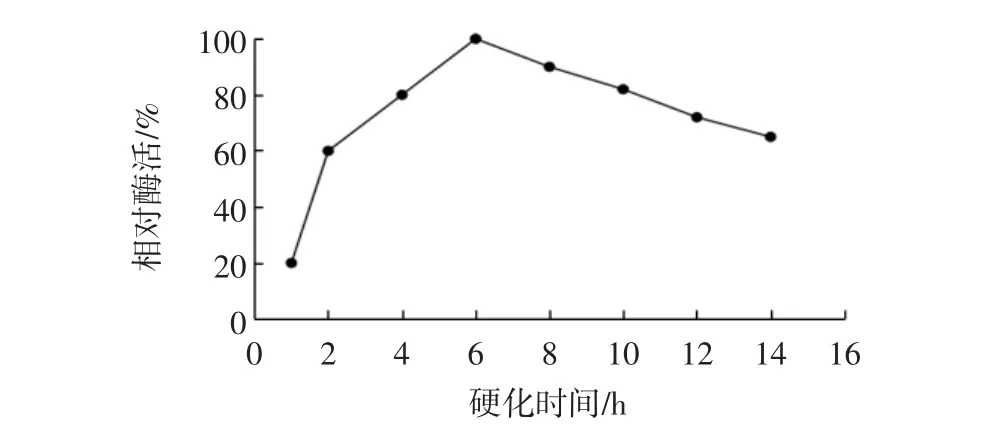
图3 硬化时间对固定化效果的影响Fig.3 Effect of the solidifying time on the immobilization
由图3可知,随着硬化时间的延长,固定化酶的相对酶活增大;当硬化时间为6 h时,相对酶活达100%;硬化时间再延长,相对酶活逐渐降低。这主要是开始硬化时,随着硬化时间的延长,包埋逐渐紧密,酶被包埋的越充分和牢固,酶流失减少,固定化酶活性逐渐增大;但硬化时间过长可能导致固定化酶交联程度高,空间网状结构过于紧密,增加了底物扩散的阻力,固定化酶的相对活性降低。因此,选择硬化时间为6 h。
2.1.4 戊二醛浓度对固定化效果的影响
海藻酸钠包埋酶分子易泄漏,固定化酶操作稳定性较差,半衰期短。戊二醛作为一种双功能试剂,可以使海藻酸钠分子交联,同时也使酶交联在载体上,增强了固定化酶的稳定性。取不同质量浓度的戊二醛溶液,考察其对固定化酶的影响,结果见图4。
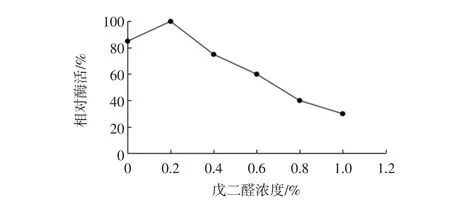
图4 戊二醛浓度对固定化效果的影响Fig.4 Effect of the concentration of flutaraldehyde on the immobilization
由图4可知,戊二醛浓度在0.2%时,固定化酶活的相对酶活最高,戊二醛浓度进一步增大造成固定化酶的活力下降。这主要是由于戊二醛浓度过高时,使酶蛋白变性失活,酶活降低。因此,选择戊二醛浓度为0.2%。
2.1.5 酶固定化条件的优化
在单因素试验的基础上进行正交试验,以酶活力为考察指标,进一步优化酶的固定化条件,正交试验因素水平设计如表1所示,正交试验结果分析见表2。
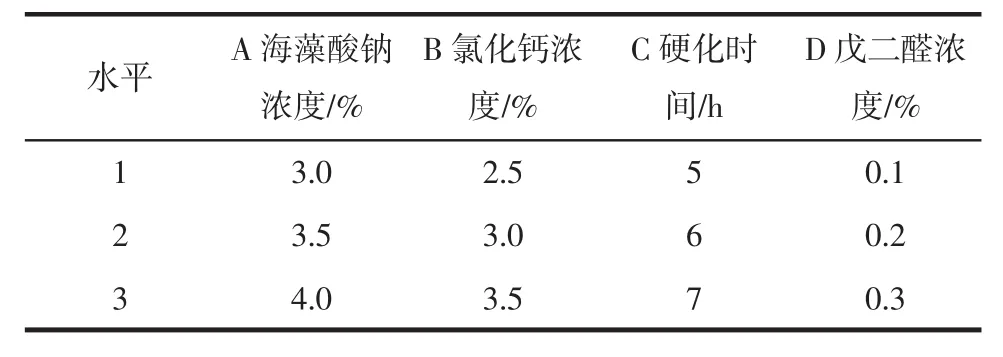
表1 正交试验因素水平Table 1 Factors and levels in orthogonal experiment
由表2可以看出海藻酸钠浓度(A)、氯化钙浓度(B)、硬化时间(C)和戊二醛浓度(D)组合A2B2C3D2最好,即海藻酸钠浓度为3.5%,氯化钙浓度为3.0%,硬化时间为7 h,戊二醛浓度为0.2%。在此条件下,固定化酶的酶活力可达16.2 U。
2.2 固定化酶的酶学性质
2.2.1 固定化酶的最适反应温度
取适量游离酶和固定化酶,在30℃~70℃温度范围内反应,测定酶活,结果见图5。

表2 正交试验结果分析Table 2 Orthogonal results

图5 温度对固定化酶和游离酶活力的影响Fig.5 Effect of temperature on the immobilized enzyme and free enzyme
由图5可知,固定化酶的最适温度范围变化不大。
2.2.2 固定化酶的最适反应pH值
取游离酶和固定化酶,在pH 6~8.5范围内反应,测定酶活,结果见图6。

图6 pH值对固定化酶和游离酶活力的影响Fig.6 Effect of pH value on the immobilized enzyme and free enzyme
由图6可知,游离酶被固定化后最适反应pH值为7.2,而游离酶的最适pH值为7.5,可见酶经固定化以后最佳反应pH值和游离酶相比发生了较小的偏移。这可能是由于载体的性质引起的微小变化。
2.2.3 固定化酶的操作稳定性
取适量固定化酶颗粒,在相同反应条件下连续进行7批次操作,并测定其酶活力,结果见图7。
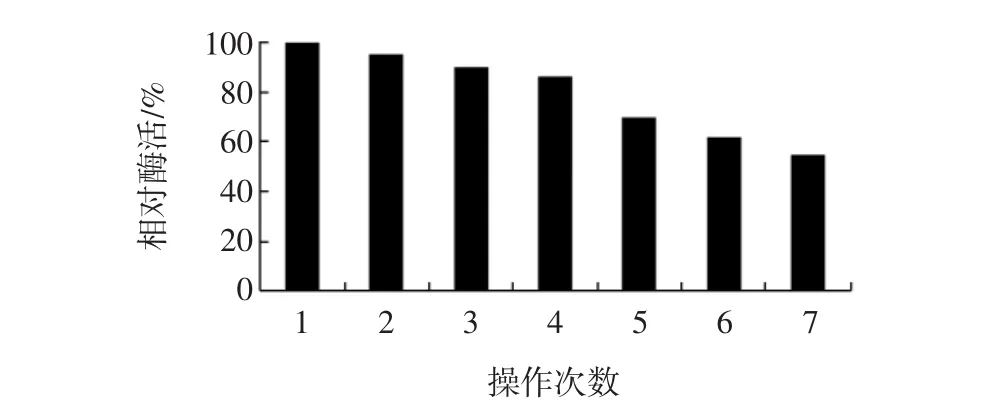
图7 固定化酶的操作稳定性Fig.7 The operation stability of immobilized enzyme
由图7可知,随着固定化酶重复操作次数的增加,固定化酶效率缓慢降低。这主要是由于凝胶反复利用,机械强度下降,酶泄露导致利用率降低,但连续操作7次后,固定化酶相对酶活仍在55%以上,说明固定化酶有较好的操作稳定性。
2.2.4 固定化酶的贮存稳定性
分别取固定化酶和游离酶保存于0℃~4℃冰箱中,每隔4天取出测定两者的残余酶活,结果见图8。

图8 固定化酶贮存稳定性Fig.8 The storage stability of immobilized enzyme
由图9可知,经过20 d的贮存,固定化酶仍保持85%的催化活性,而游离酶却只有35%的活性,这说明固定化酶比游离酶具有更好的贮存稳定性。
3 结论
以海藻酸钠为载体、戊二醛为交联剂,对L-阿拉伯糖异构酶进行固定化,研究得出制备固定化酶的最优条件为:海藻酸钠浓度3.5%,氯化钙浓度3.0%,硬化时间6 h,戊二醛浓度0.2%,该条件下制备的固定化酶与游离酶相比,最适宜反应温度和pH值基本没有变化。固定化后L-阿拉伯糖异构酶具有较好的操作稳定性,重复操作7次后相对酶活仍在55%以上。
[1]秦啸天,江波,Chi-Tang Ho.解纤维热酸菌产L-阿拉伯糖异构酶的培养条件优化[J].食品工业科技,2009,30(4):153-155,159
[2]王静.甜味剂D-塔格糖的生产及其在食品中的应用[J].中国调味品,2016,41(1):140-143
[3]Beerens K,Desmet T,Soetaert W.Enzymes for the biocatalytic production of sugars[J].Journal of Industrial Microbiology Biotechnology,2012,39(6):823-834
[4]Xu Z,Li S,Feng X H,et al.L-arabinose isomerase and its use for biotechnological production of rare sugars[J].Applied Microbiology and Biotechnology,2014,98(21):8869-8878
[5]Kim K R,Seo E S,Oh D K.L-Ribose production from L-arabinose by immobilized recombinant Escherichia coli co-expressing the L-arabinose isomerase and mannose-6-phosphate isomerase genes from Geobacillus thermodenitrificans[J].Applied biochemistry and biotechnology,2014,172(1):275-288
[6]Terami Y,Yoshida H,Uechi K,et al.Essentiality of tetramer formation of Cellulomonas parahominis L-ribose isomerase involved in novel L-ribose metabolic pathway[J].Applied Microbiology& Biotechnology,2015,99(15):6303-6313
[7]Yeom S J,Ji J H,Kim N H,et al.Substrate specificity of a mannose-6-phosphate isomerase from Bacillus subtilis and its application in the production of L-ribose[J].Applied and Environmenta Microbiology,2009,75(14):4705-4710
[8]Yeom S J,Seo E S,Kim B N,et al.Characterization of a mannose-6-phosphate isomerase from Thermus thermophiles and increased L-ribose production by its R142N mutant[J].Applied and Environmental Microbiology,2011,77(3):762-767
[9]Lim Y R,Yeom S J,Oh D K.Production of L-Ribose from L-Ribulose by a triple-site variant of mannose-6-phosphate isomerase from Geobacillus thermodenitrificans[J].Applied and Environmental Microbiology,2012,78(11/12):3880-3884
[10]陆春丽.生物酶法制备L-核糖[D].北京:北京化工大学,2012
Research on the Immobilization of L-Arabinose Isomerase by Embedded in Sodium Alginate
WANG Jing1,2,CHUAI Yu-duo2,TANG Wei-hua2,HOU Ting2
(1.Tianjin Light Industry Chemical Reseach Institute Co.,Ltd.,Tianjin 300350,China;2.Tianjin Modern Vocational Technology College,Tianjin 300350,China)
L-alabinose isomerase(L-AI)was immobilized using sodium alginate as the carrier and flutaraldehyde as the crosslinker.The effects of the concentration of sodium alginate,calcium chloride and flutaraldehyde,the solidifying time were studied.The results showed that the optimal immobilization condition were as followed:sodium alginate 3.5%,calcium chloride 3.0%,flutaraldehyde 0.2%and the solidifying time 7 h. Under the optimum condition,compared with the free L-AI,the optimum pH value and temperature of immobilized L-AI were not changed.The immobilized L-AI had good operational stability and storage stability.
L-alabinose isomerase;immobilization;sodium alginate;flutaraldehyde
2017-05-05
天津市科技计划项目(15YFFCTG00130)
王静(1978—),女(汉),副教授,博士,研究方向:精细化学品合成与应用的研究。
10.3969/j.issn.1005-6521.2017.16.020

