微囊化番茄红素的安全性评价研究
吴俊,吕中明,俞萍,施伟庆,张颖
(江苏省疾病预防控制中心,江苏南京210009)
微囊化番茄红素的安全性评价研究
吴俊,吕中明,俞萍,施伟庆,张颖*
(江苏省疾病预防控制中心,江苏南京210009)
研究微囊化番茄红素的食用安全性。通过小鼠急性经口毒性试验、遗传毒性试验(Ames试验、骨髓细胞微核试验、小鼠睾丸染色体畸变试验)和30 d喂养试验进行毒理学评价。结果表明:雌、雄小鼠经口最大耐受量为15 000 mg/kg·bw,属无毒级,Ames试验、骨髓细胞微核试验、小鼠睾丸染色体畸变试验结果均为阴性,30 d喂养试验未见大鼠的生长发育、血液学、血液生化及组织病理学有异常变化,微囊化番茄红素无急性毒性、致突变作用与亚急性毒性,在本试验剂量范围内,微囊化番茄红素作为保健食品是安全可靠的。
微囊化;番茄红素;安全性
番茄红素(lycopene)主要存在于西红柿的成熟果实植物中,是一种类胡萝卜素类的脂溶性色素[1]。番茄红素具有明确的抑癌功能[2],其抑癌机制分为氧化应激和非氧化应激两类[3]。番茄红素是类胡萝卜素类中最强的抗氧化剂之一,其清除自由基的能力已经在体内和体外试验中被广泛研究,包括单线态氧(1O2)的猝灭、二氧化氮(NO2·)的清除等[4],而非氧化应激机制则涉及番茄红素抑制p53基因的磷酸化,p53发生磷酸化之后,会失去野生型p53抑制肿瘤增殖的作用,使该基因具备癌基因功能,以及阻止G0-G1期的细胞分裂过程[5]。
利用微囊技术包埋处理客体物质,可改善其理化性质,增加稳定性和生物利用度[6]。目前针对微囊化番茄红素毒理学研究报道较少,本研究应用小鼠急性经口毒性试验、Ames试验、骨髓细胞微核试验、小鼠睾丸染色体畸变试验、30 d喂养试验对微囊化番茄红素安全性进行评价。
1 材料和方法
1.1 样品和剂量
番茄红素胶囊:由某药业有限公司提供,受试样品为胶囊内容物,紫红色至紫褐色微囊,每100 g受试样品内含番茄红素15 g,成人(体重以60 kg计)推荐剂量为140 mg/(人·天)。
1.2 实验动物和饲养环境
SPF级ICR小鼠:由北京维通利华实验动物技术有限公司提供(生产许可证号:SCXK(京)2012-0001号,合格证号:11400700126273);SD大鼠:由上海斯莱克实验动物有限责任公司提供(生产许可证号:SCXK(沪)2012-0002号,合格证号:2015000510255)。实验动物饲养于屏障系统。
1.3 仪器和菌株
ADVIA 2120五分类血液分析仪:德国SIEMENS;AU640全自动生化分析仪:日本OLYMPUS;EG1160石蜡包埋机:德国LEICA;PANNORAMIC MIDI数字病理扫描分析仪:匈牙利3DHISTECH;JJ200型精密电子天平:常州双杰测试仪器厂;鼠伤寒沙门菌组氨酸缺陷型TA97a、TA98、TA100、TA102菌株:美国Molecular Toxicology有限公司。
1.4 方法
按卫生部《保健食品检验与评价技术规范》(2003年)[7]进行试验。
1.4.1 小鼠急性经口毒性试验
采用最大耐受量试验法。选用健康ICR小鼠40只,雌雄各半,体重18.0 g~20.4 g。设计剂量为15 000 mg/ kg·bw,称取样品15 000 mg加色拉油至20 mL配制成受试物。小鼠禁食过夜后取受试物两次灌胃给予,中间间隔4 h,每次灌胃容量均为10 mL/kg,灌胃后4 h给食,观察期14 d,记录小鼠中毒表现及死亡情况。
1.4.2 Ames试验
平板掺入法。采用经鉴定基因型符合要求的TA97a、TA98、TAl00和TAl02菌株,活化系统为Aroclor1254诱导的大鼠肝S9。加0.1 mL样品,用DMSO依次连续作5倍稀释配成所需各浓度(1 000、200、40、8 μg/皿),试验共设5个剂量组,1个溶剂对照组,1个空白对照组即自发回变组,另设4个阳性对照组。
1.4.3 骨髓细胞微核试验
雌雄小鼠按体重随机分入1 875、3 750、7 500 mg/ kg·bw 3个剂量组,1个溶剂对照组(色拉油)和1个阳性对照组(环磷酰胺40 mg/kg),每组10只,雌雄各半。各组均用30 h两次灌胃法,除阳性对照组灌胃容量为20 mL/kg外,其余各组灌胃容量均为10 mL/kg。第二次灌胃后6h取股骨骨髓悬于小牛血清中直接涂片、固定、染色,镜检嗜多染红细胞(PCE)1000个/鼠,计数含微核的细胞数。每只动物观察200个PCE的同时计数所见到的正染红细胞(NCE)数,计算两者的比率(PCE/NCE)。
1.4.4 小鼠睾丸染色体畸变试验
雄性小鼠按体重随机分入1 875、3 750、7 500 mg/ kg·bw 3个样品剂量组、1个溶剂对照组(色拉油)和1个阳性对照组(丝裂霉素2 mg/kg),每组5只。样品各剂量组、溶剂对照组动物均连续灌胃5 d,每次灌胃容量均为10 mL/kg,每天1次;阳性对照组动物,腹腔注射1次,注射量为10 mL/kg。试验第14天,各组动物均于处死前6 h腹腔注射秋水仙素4 mg/kg,注射量为10 mL/kg,颈椎脱臼法处死小鼠,取两侧睾丸,去净脂肪,撕开被膜,轻轻地分离曲细精管,室温下低渗,固定液固定,离心后60%冰醋酸软化,制片,Giemsa液染色,光学显微镜下(油镜)阅片。
1.4.5 30 d喂养试验
选用4周龄健康SD大鼠,雌雄各40只。样品推荐剂量为140 mg/(人·天),即2.33 mg/kg·bw,设0(基础饲料对照)、58.3、117、233 mg/kg·bw(相当于推荐剂量的25、50、100倍)雌雄各4个剂量组,样品按不同配比掺入饲料内,拌匀,配制成不同剂量的饲料,空白对照组饲以基础饲料,连续单笼喂饲30 d。每周称1次体重和2次食物摄入量,计算每周及总的食物利用率。喂养结束时,取血,进行大体检查,取脏器称重,固定、保存,测定血红蛋白(HGB)、红细胞(RBC)、白细胞(WBC)总数及中性粒细胞(NE)、淋巴细胞(LY)、单核细胞(MO)、嗜酸性粒细胞(EO)、嗜碱性粒细胞(BA)分类,肝、肾、脾、睾丸绝对重量和脏体比,丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总蛋白(TP)、白蛋白(ALB)、血糖(GLU)、尿素氮(BUN)、肌酐(CRE)、总胆固醇(CHO)、甘油三酯(TG),动物大体解剖,肝、肾、脾、胃、小肠、睾丸(雄)、卵巢(雌)称重并进行组织病理学检查。
1.5 数据分析
各组试验原始数据使用SPSS19.0软件进行分析,组织病理学检查结果用卡方检验和四格表确切概率法分析,其他试验数据均以均数±标准差(X±S)进行表示。正态分布数据采用单因素方差分析(One-Way ANOVA)的Dunnett-t检验,若方差不齐,采用Kruskal-Wallis秩和检验分析,P<0.05为差异有统计学意义。
2 结果与分析
2.1 小鼠急性经口毒性试验
经口给予样品后,小鼠未见明显中毒表现,观察期内无动物死亡,大体解剖未见明显异常,雌、雄小鼠经口最大耐受量为15 000 mg/kg,根据小鼠急性经口毒性分级标准,属无毒级。
2.2 Ames试验
不论加S9与否,样品各剂量组的回变菌落数均未超过相应的溶剂对照值的2倍,也无剂量-反应关系。样品对标准测试菌株TA97a、TA98、TA100和TA102均未检出明显的诱变活性。
2.3 骨髓细胞微核试验
番茄红素对小鼠骨髓细胞微核发生率和PCE/ RBC比值的影响见表1。
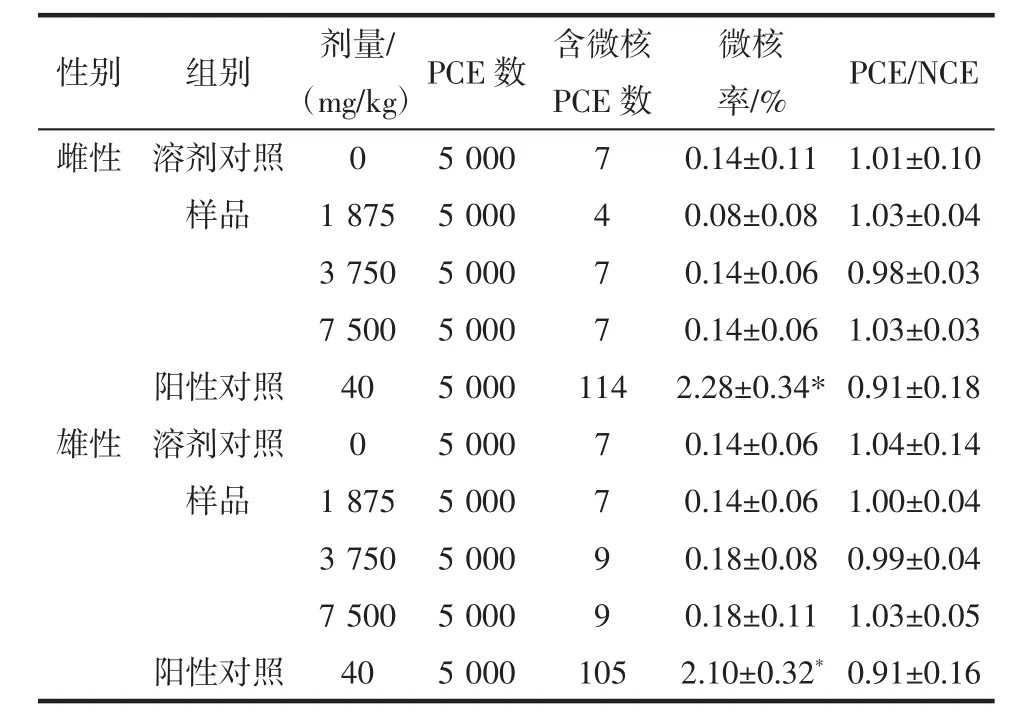
表1场 番茄红素对小鼠骨髓细胞微核发生率和PCE/RBC比值的影响Table 1 Effect of lycopene on micronucleus rate and PCE/RBC ratio in mice bone marrow cells
结果显示番茄红素各剂量组微核率与阴性对照组比较差异无统计学意义(P>0.05),环磷酞胺阳性对照组与阴性对照组比较差异有统计学意义(P<0.05),且未见番茄红素对小鼠骨髓嗜多染红细胞微核形成及PCE/RBC比值产生影响。
2.4 小鼠睾丸染色体畸变试验
番茄红素各剂量组小鼠睾丸染色体畸变细胞率与溶剂对照组比较差异无统计学意义(P>0.05),丝裂霉素阳性对照组与溶剂对照组比较差异有统计学意义(P<0.05),结果见表2。
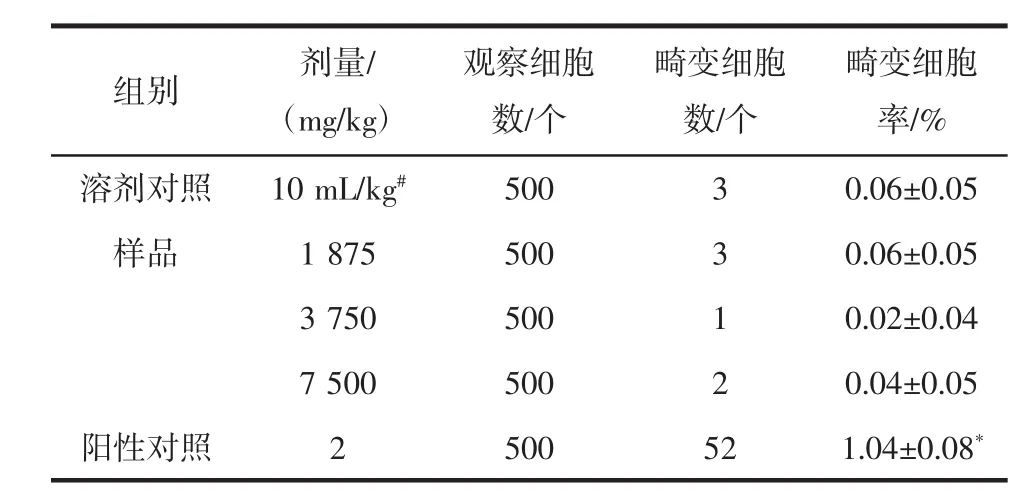
表2 番茄红素对小鼠睾丸染色体畸变细胞率的影响Table 2 Effect of lycopene on chromosome aberration rate of testis in mice
2.5 30 d喂养试验
番茄红素掺入基础饲料中喂养大鼠30 d,结果显示各剂量组动物活动、生长正常,无中毒症状,无死亡。
雌、雄大鼠各剂量组不同阶段的体重、增重、进食量和总增重、总进食量、总食物利用率,与对照组相比差异均无统计学意义(P>0.05),结果见表3、表4。
表3 番茄红素对大鼠体重的影响(±S)Table 3 Effect of lycopene on body weight in rats(±S)
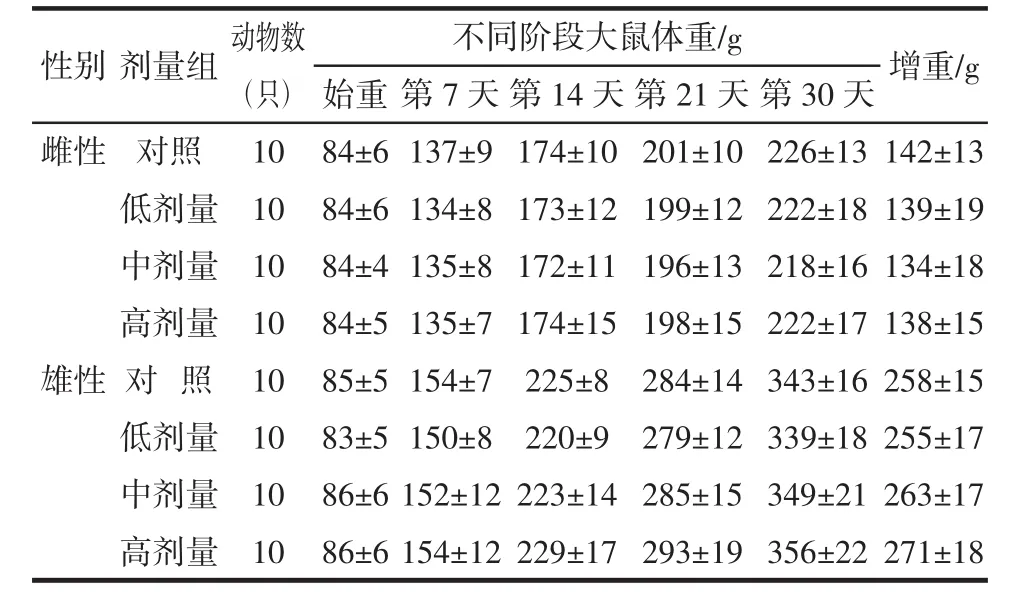
表3 番茄红素对大鼠体重的影响(±S)Table 3 Effect of lycopene on body weight in rats(±S)
不同阶段大鼠体重/g 增重/g始重第7天第14天第21天第30天雌性 对照 10 84±6 137±9 174±10 201±10 226±13 142±13低剂量 10 84±6 134±8 173±12 199±12 222±18 139±19中剂量 10 84±4 135±8 172±11 196±13 218±16 134±18高剂量 10 84±5 135±7 174±15 198±15 222±17 138±15雄性 对 照 10 85±5 154±7 225±8 284±14 343±16 258±15低剂量 10 83±5 150±8 220±9 279±12 339±18 255±17中剂量 10 86±6 152±12 223±14 285±15 349±21 263±17高剂量 10 86±6 154±12 229±17 293±19 356±22 271±18性别 剂量组 动物数(只)
表4 番茄红素对大鼠食物利用率的影响(±S)Table 4 Effect of lycopene on food utilization rate in rats(±S)
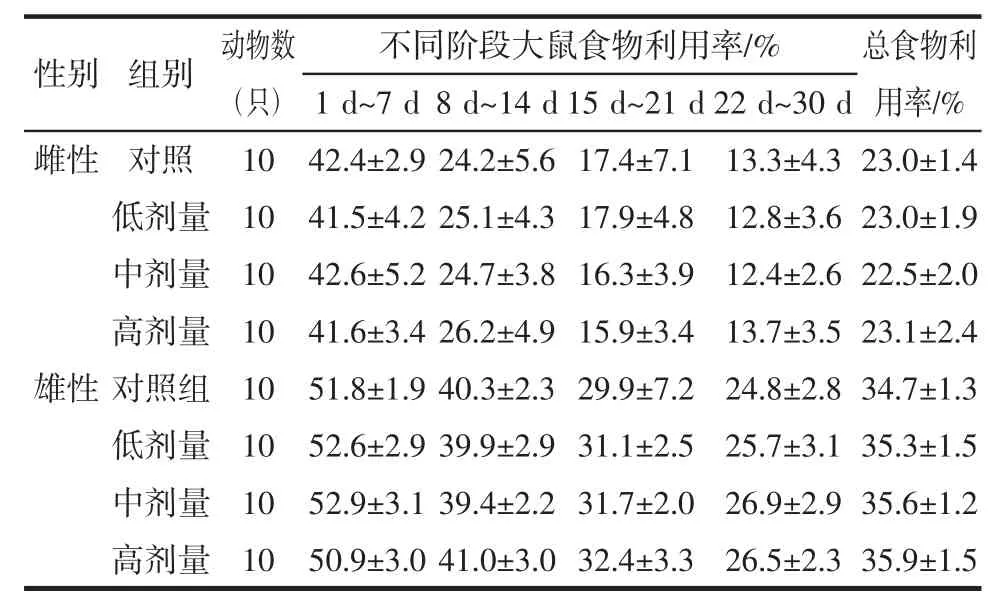
表4 番茄红素对大鼠食物利用率的影响(±S)Table 4 Effect of lycopene on food utilization rate in rats(±S)
性别 组别 动物数(只)1 d~7 d 8 d~14 d 15 d~21 d 22 d~30 d不同阶段大鼠食物利用率/% 总食物利用率/%雌性 对照 10 42.4±2.9 24.2±5.6 17.4±7.1 13.3±4.3 23.0±1.4低剂量 10 41.5±4.2 25.1±4.3 17.9±4.8 12.8±3.6 23.0±1.9中剂量 10 42.6±5.2 24.7±3.8 16.3±3.9 12.4±2.6 22.5±2.0高剂量 10 41.6±3.4 26.2±4.9 15.9±3.4 13.7±3.5 23.1±2.4雄性对照组 10 51.8±1.9 40.3±2.3 29.9±7.2 24.8±2.8 34.7±1.3低剂量 10 52.6±2.9 39.9±2.9 31.1±2.5 25.7±3.1 35.3±1.5中剂量 10 52.9±3.1 39.4±2.2 31.7±2.0 26.9±2.9 35.6±1.2高剂量 10 50.9±3.0 41.0±3.0 32.4±3.3 26.5±2.3 35.9±1.5
与对照组相比,雌、雄大鼠各剂量组肝、肾、脾、睾丸的脏器重量以及肝体比、肾体比、脾体比、睾丸体比差异均无统计学意义(P>0.05),结果见表5。
表5 番茄红素对大鼠脏体比的影响(±S)Table 5 Effect of lycopene on organ coefficients in rats(±S)
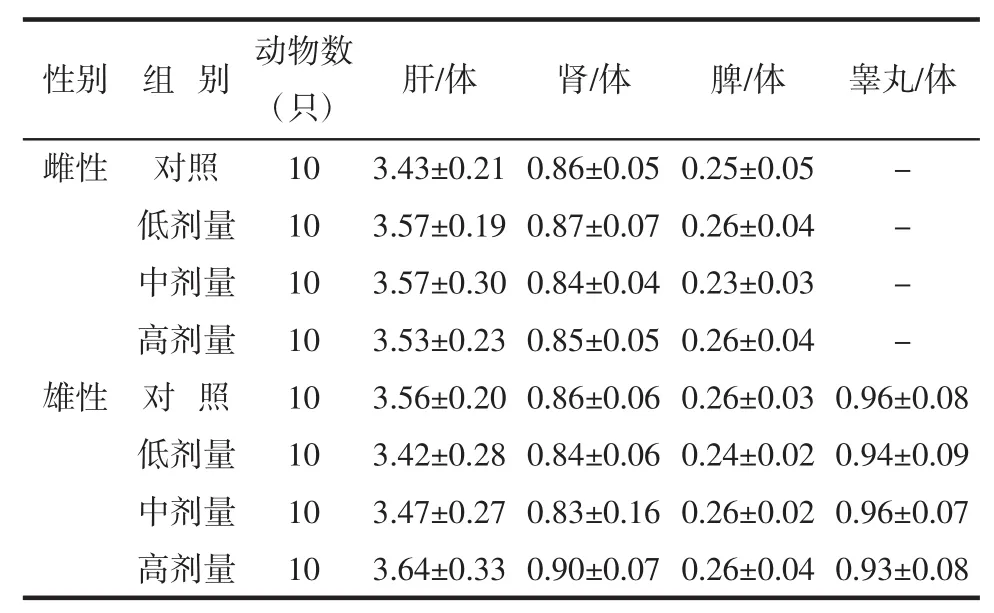
表5 番茄红素对大鼠脏体比的影响(±S)Table 5 Effect of lycopene on organ coefficients in rats(±S)
注:-表示雌性大鼠不需要测定睾丸/体。
性别 组 别 动物数(只) 肝/体 肾/体 脾/体 睾丸/体雌性 对照 10 3.43±0.21 0.86±0.05 0.25±0.05 -低剂量 10 3.57±0.19 0.87±0.07 0.26±0.04 -中剂量 10 3.57±0.30 0.84±0.04 0.23±0.03 -高剂量 10 3.53±0.23 0.85±0.05 0.26±0.04 -雄性 对 照 10 3.56±0.20 0.86±0.06 0.26±0.03 0.96±0.08低剂量 10 3.42±0.28 0.84±0.06 0.24±0.02 0.94±0.09中剂量 10 3.47±0.27 0.83±0.16 0.26±0.02 0.96±0.07高剂量 10 3.64±0.33 0.90±0.07 0.26±0.04 0.93±0.08
番茄红素高、中、低剂量组各血液学指标与阴性对照组比较,差异无统计学意义(P>0.05),各血生化指标与阴性对照组比较,差异无统计学意义(P>0.05),结果见表6、表7。
表6 番茄红素对大鼠血液学指标的影响(±S)Table 6 Effect of lycopene on hematological indexes in rats(±S)
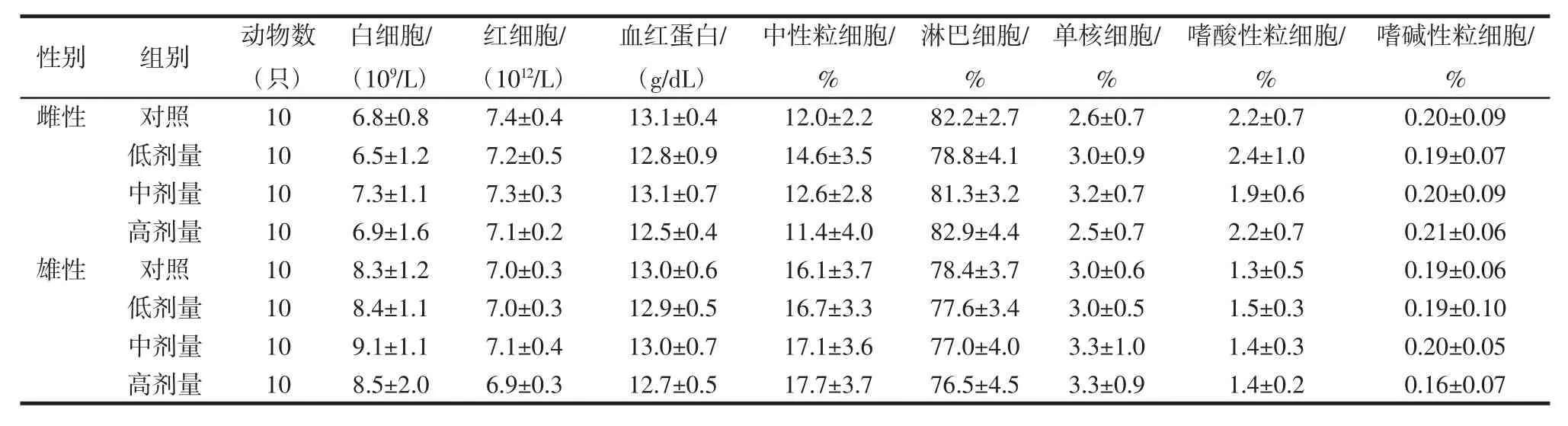
表6 番茄红素对大鼠血液学指标的影响(±S)Table 6 Effect of lycopene on hematological indexes in rats(±S)
性别 组别 动物数(只)嗜碱性粒细胞/ %雌性 对照 10 6.8±0.8 7.4±0.4 13.1±0.4 12.0±2.2 82.2±2.7 2.6±0.7 2.2±0.7 0.20±0.09低剂量 10 6.5±1.2 7.2±0.5 12.8±0.9 14.6±3.5 78.8±4.1 3.0±0.9 2.4±1.0 0.19±0.07中剂量 10 7.3±1.1 7.3±0.3 13.1±0.7 12.6±2.8 81.3±3.2 3.2±0.7 1.9±0.6 0.20±0.09高剂量 10 6.9±1.6 7.1±0.2 12.5±0.4 11.4±4.0 82.9±4.4 2.5±0.7 2.2±0.7 0.21±0.06雄性 对照 10 8.3±1.2 7.0±0.3 13.0±0.6 16.1±3.7 78.4±3.7 3.0±0.6 1.3±0.5 0.19±0.06低剂量 10 8.4±1.1 7.0±0.3 12.9±0.5 16.7±3.3 77.6±3.4 3.0±0.5 1.5±0.3 0.19±0.10中剂量 10 9.1±1.1 7.1±0.4 13.0±0.7 17.1±3.6 77.0±4.0 3.3±1.0 1.4±0.3 0.20±0.05高剂量 10 8.5±2.0 6.9±0.3 12.7±0.5 17.7±3.7 76.5±4.5 3.3±0.9 1.4±0.2 0.16±0.07白细胞/(109/L)红细胞/(1012/L)血红蛋白/(g/dL)中性粒细胞/ %淋巴细胞/ %单核细胞/ %嗜酸性粒细胞/ %
表7 番茄红素对大鼠血液生化指标的影响(±S)Table 7 Effect of lycopene on blood biochemical indexes in rats(±S)
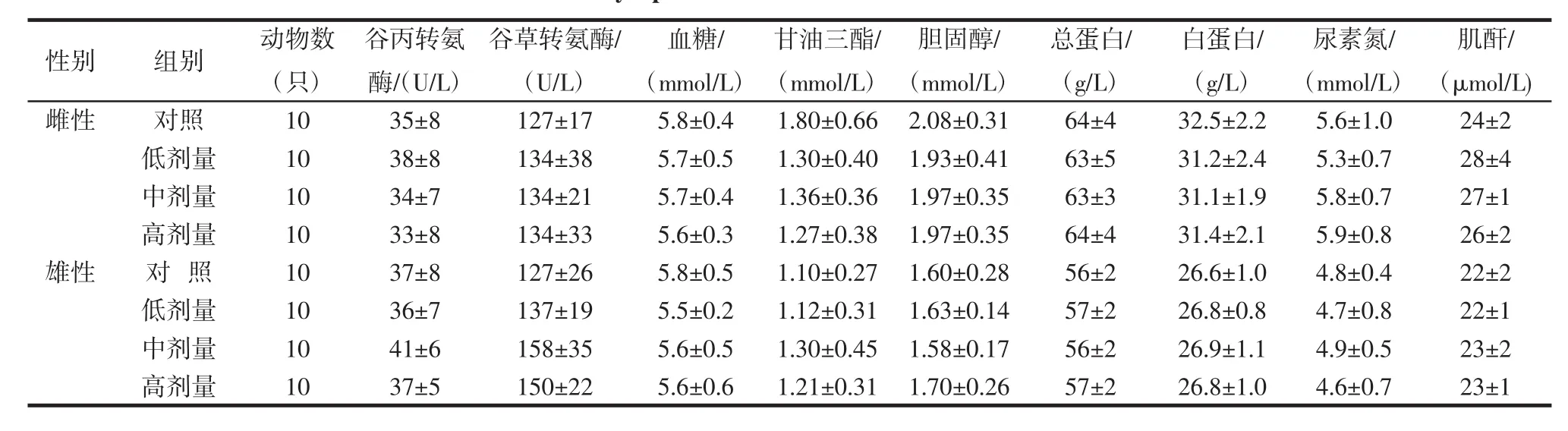
表7 番茄红素对大鼠血液生化指标的影响(±S)Table 7 Effect of lycopene on blood biochemical indexes in rats(±S)
性别 组别 动物数(只)白蛋白/(g/L)雌性 对照 10 35±8 127±17 5.8±0.4 1.80±0.66 2.08±0.31 64±4 32.5±2.2低剂量 10 38±8 134±38 5.7±0.5 1.30±0.40 1.93±0.41 63±5 31.2±2.4中剂量 10 34±7 134±21 5.7±0.4 1.36±0.36 1.97±0.35 63±3 31.1±1.9高剂量 10 33±8 134±33 5.6±0.3 1.27±0.38 1.97±0.35 64±4 31.4±2.1雄性 对 照 10 37±8 127±26 5.8±0.5 1.10±0.27 1.60±0.28 56±2 26.6±1.0低剂量 10 36±7 137±19 5.5±0.2 1.12±0.31 1.63±0.14 57±2 26.8±0.8中剂量 10 41±6 158±35 5.6±0.5 1.30±0.45 1.58±0.17 56±2 26.9±1.1高剂量 10 37±5 150±22 5.6±0.6 1.21±0.31 1.70±0.26 57±2 26.8±1.0谷丙转氨酶/(U/L)谷草转氨酶/(U/L)血糖/(mmol/L)甘油三酯/(mmol/L)胆固醇/(mmol/L)总蛋白/(g/L)尿素氮/(mmol/L)5.6±1.0 5.3±0.7 5.8±0.7 5.9±0.8 4.8±0.4 4.7±0.8 4.9±0.5 4.6±0.7肌酐/(μmol/L) 24±2 28±4 27±1 26±2 22±2 22±1 23±2 23±1
病理组织学检查包括大鼠肝、肾、胃、十二指肠以及睾丸(或卵巢)等脏器。各剂量组大鼠肝小叶未见充血、小灶状坏死、炎性细胞浸润、肝细胞脂肪变性、水样变性,肾脏皮质未见充血、钙化小体、炎性细胞浸润、水样变性,胃、十二指肠粘膜未见充血、坏死、炎性细胞浸润,睾丸、卵巢发育良好,未见充血、萎缩、色素沉着。
3 讨论
近年来,番茄红素与预防心血管疾病发生的关系成为研究热点[8-9],有文献报道高胆固醇血症伴有高血压的患者每天摄入15mg番茄红素有明显的降压作用[10],也有研究证实番茄红素浓度与心血管疾病的发生风险呈负相关[11]。此外,番茄红素被证实具有防辐射功能,其通过减少脂质过氧化,增加抗氧化酶活性对辐射诱导的肠毒性起保护作用[12]。多数微囊所用囊材为明胶,是一种无毒水溶性蛋白质,微囊表面较光滑,粒径分布均匀。王会娟等[13]对番茄红素微囊稳定性的研究证实番茄红素微囊的制备工艺可行,外观形态良好,微囊化是提高其稳定性和生物利用度的有效途径,这可能与微囊化后更易于透过小肠细胞壁水化层,从而促进机体吸收有关[14]。因为番茄红素具有的抑癌、预防心血管疾病、防辐射等功能,且其微囊化产品可增加稳定性,微囊化番茄红素的保健价值更加受到青睐,越来越多的开发为保健食品[15]。
本研究利用急性毒性试验、遗传毒性试验、亚急性毒性试验对微囊化番茄红素进行了安全性评价,遗传毒性试验结果显示番茄红素对小鼠基因、染色体和生殖细胞无损伤作用,亚慢性毒性试验结果证明其对动物生长发育、血液、血生化指标无影响,此结果与孙杰等报道相同[16-17]。上述结果表明微囊化番茄红素在本研究的剂量范围内作为保健食品是安全可靠的。
[1]Zhang Q,Wang J,Gu Z,et al.Effect of lycopene on the blood-spinal cord barrier after spinal cord injury in mice[J].Biosci Trends,2016, 10(4):288-293
[2]Shanbhag V K.Lycopene in cancer therapy[J].J Pharm Bioallied Sci,2016,8(2):170-171
[3]Gajowik A,Dobrzyńska M M.Lycopene-antioxidant with radioprotective and anticancer properties.A review[J].Rocz Panstw Zakl Hig,2014,65(4):263-271
[4]Yapaing Z,Suping Q,Weni Y,et al.Antioxidant activity of lycopeneextracted from tomato paste towards trichloromethyl peroxyl radical CCl3O2[J].Food Chem,2002,77(2):209-212
[5]Liu C,Russell R M,Wang X D.Lycopene supplementation prevents smoke-induced changes in p53,p53 phosphorylation,cell proliferation,and apoptosis in the gastric mucosa of ferrets[J].J Nutr,2006, 136(1):106-111
[6]龚秋翼,钱俊青,郭辉,等.番茄红素微囊生物利用度检测的实验研究[J].浙江工业大学学报,2012,40(2):129-131
[7]中华人民共和国卫生部.保健食品检验与评价技术规范[M].北京:人民卫生出版社,2003:223-224.
[8]Jain A K,Mehra N K,Swarnakar N K.Role of Antioxidants for the Treatment of Cardiovascular Diseases:Challenges and Opportunities[J].Curr Pharm Des,2015,21(30):4441-4455
[9]杨艳晖,王海,荣胜忠,等.番茄红素对大鼠急性心肌梗死所致心肌损伤的保护作用[J].营养学报,2013,35(5):471-474
[10]Engelhard Y N,Gazer B,Paran E.Natural antioxidants from tomato extract reduce blood pressure in patients with grade-1 hypertension:A double-blind,placebo-controlled pilot study[J].Am Heart J, 2006,151(1):100
[11]Ojha S,Goyal S,Sharma C,et al.Cardioprotective effect of lycopene against isoproterenol-induced myocardial infarction in rats[J].Hum Exp Toxicol,2013,32(5):492-503
[12]Andic F,Garipagaoglu M,Yurdakonar E,et al.Lycopene in the preventionofgastrointestinaltoxicityofradiotherapy[J].NutrCancer,2009, 61(6):784-788
[13]王会娟,李馨儒,袁泉,等.番茄红素微囊的制备及稳定性考察[J].中国新药杂志,2004,13(5):411-413
[14]叶海英,张忠,高申,等.法莫替丁微乳的研制及其质量评价[J].第一军医大学学报,2003,23(1):68-70
[15]王丽云,施伟庆,陈耿,等.番茄红素片的安全性研究[J].江苏预防医学,2013,24(2):62-64
[16]孙杰,胡奇,李世芬,等.番茄红素的安全性评价及对小鼠免疫功能的影响[J].食品科学,2015,36(9):170-175
[17]俞莉,杨明晶,陆罗定,等.微胶囊化番茄红素片对小鼠免疫功能的影响[J].江苏预防医学,2014,25(2):43-46
Study on Toxicological Security of Lycopene Microcapsule
WU Jun,LÜ Zhong-ming,YU Ping,SHI Wei-qing,ZHANG Ying*
(Jiangsu Provincial Center for Disease Control and Prevention,Nanjing 210009,Jiangsu,China)
To study toxicological security of lycopene microcapsule.Acute toxicity test,genetic toxicity test(Ames test,micronucleus test of born marrow,mice testicle cells chromosome aberration test)and thirty-day feeding test in rats were conducted in this study.Result:the oral MTD in both male and female mice were more than 15 000 mg/kg·bw,and it is non-toxic,the results of Ames test,micronucleus test of born marrow in mice,mice testicle cells chromosome aberration test were negative,the results of the thirty-day feeding test in rats demonstrated that it had no obvious toxic effects on growth and development,routine blood index,biochemical index and histopathological changes.Lycopene microcapsule has no significant acute and mutagenic effect and sub-acute toxicity,it is safe as a health food.
microcapsule;lycopene;security
2016-11-23
吴俊(1984—),男(汉),主管医师,硕士,从事卫生毒理学研究。
*通信作者:张颖(1979—),女(汉),副主任技师,硕士,从事卫生毒理学研究。
10.3969/j.issn.1005-6521.2017.16.040

