大孔吸附树脂法分离纯化葡萄籽中原花青素
马小琴,王晓敏,周凡
(新疆华世丹药物研究有限责任公司,新疆乌鲁木齐830011)
大孔吸附树脂法分离纯化葡萄籽中原花青素
马小琴,王晓敏,周凡*
(新疆华世丹药物研究有限责任公司,新疆乌鲁木齐830011)
研究大孔吸附树脂法纯化分离原花青素的工艺条件及参数。采用香草醛-硫酸方法进行分光光度法测定,考察AB-8大孔树脂对原花青素的吸附率、吸附量、解吸附率、纯度。结果表明:上样液中原花青素含量在4.5 mg/mL~6.5 mg/mL范围较为合适,当AB-8树脂与提取液的比例为1∶10(g/mL),上样流速为1.5 BV/h,吸附时间为8 h时,吸附率达到95%以上;以40%乙醇溶液为洗脱剂,洗脱剂用量为6 BV,解析率为99%,此条件下得到的固体纯度为94.7%,用AB-8型大孔树脂分离,纯化原花青素的方法可行。
大孔树脂;葡萄籽;原花青素;纯化
葡萄籽中含有大量原花青素,原花青素是由单体黄烷-3-醇以不同聚合度链接而成的多酚类化合物[1],研究表明,原花青素拥有显著的抗氧化和改善微循环功能,此外还具有护肝解毒、降血压、降血脂、消炎、抗癌、治疗心血管疾病等功效[2-3],广泛应用于保健品、化妆品、食品等行业。
AB-8大孔吸附树脂具有再生简便、解析条件温和、使用周期长、节省费用等诸多优点,是一种性能良好的原花青素吸附剂[4]。本文拟采用乙醇超声波辅助提取葡萄籽原花青素,研究AB-8大孔树脂对葡萄籽中原花青素提取液的纯化技术,考察最佳上样量、最佳上样浓度、最佳上洋流速、最佳洗脱剂及用量等对纯化效果的影响。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 材料与试剂
葡萄籽:新疆华世丹药业股份有限公司。
AB-8型大孔吸附树脂:天津市光复精细化工研究所;原花青素标品(纯度为98%):北京盈泽纳新化工技术研究院提供;氢氧化钠、甲醇:国药集团化学试剂有限公司;盐酸、硫酸:西安化学试剂厂;无水乙醇:天津市百世化工有限公司;香草醛:天津基准化学试剂有限公司。
1.1.2 仪器与设备
KQ-500DW型数控超声波清洗器:昆山市超声仪器有限公司;R-1010型旋转蒸发仪:郑州长城科工贸有限公司;TU-1950紫外-可见分光光度仪:北京普析通用仪器有限责任公司;十万分之一分析天平:余姚市金诺天平仪器有限公司;SHZ-82A水浴恒温震荡器:江苏省金坛市医疗仪器厂。
1.2 方法
1.2.1 标准曲线的绘制
精密称取原花青素标准品9.49 mg,用无水乙醇溶解并定容至10 mL配成标准储备液;用移液管分别移取标准储备液适量,配制浓度分别为0.047 45、0.094 90、0.118 75、0.142 35、0.189 8、0.237 5、0.287 5 mg/mL原花青素标准溶液。精密量取原花青素标准溶液1.0 mL,依次加入3%香草醛-甲醇溶液5 mL;30%硫酸-甲醇溶液5 mL;混合均匀后在水浴锅中恒温(30℃)避光反映15 min。以3%香草醛-甲醇溶液:30%硫酸-甲醇溶液:无水乙醇=5∶5∶1的混合溶液为空白对照,在502 nm波长处测定吸光度。以浓度为横坐标,吸光度为纵坐标,用二元回归法绘制标准曲线。回归方程为
Y=2.107 5X+0.006 4,R2=0.999 9
式中:Y是吸光度值;X是原花青素浓度,mg/mL。
1.2.2 葡萄籽原花青素的提取工艺
精确称取脱脂干燥并过2号筛的葡萄籽提取物适量,加入10倍量50%乙醇溶液,提取温度为60℃,置200 W超声水浴中回流提取40 min,提取2次,过滤、合并滤液,减压回收至无醇味,得葡萄籽原花青素浓缩液。然后选用AB-8型大孔树脂进一步纯化。
1.2.3 AB-8树脂对葡萄籽提取液中原花青素的吸附试验
1.2.3.1 AB-8型大孔吸附树脂的预处理
将AB-8用蒸馏水浸泡充分溶胀,再用5%HCl和2%NaOH酸碱重复处理2次后,然后用蒸馏水洗至中性。用95%乙醇浸泡12 h充分溶胀,滤去水及浮游物和破碎树脂后洗至澄清,再用NaOH(0.5 mol/L)浸泡8 h~10 h并不时搅拌,除去碱液水至中性,再经HCl(0.5 mol/L)浸泡8 h~10 h并不时搅拌以除去新树脂中的各种杂质,除去酸液水洗至中性,再用70%乙醇浸泡4 h~6 h并不时搅拌,除去溶剂后继续用70%乙醇洗至洗出液滴入水中不呈现乳白色浑浊为止,最后用蒸馏水洗去溶剂。
1.2.3.2 AB-8大孔树脂对葡萄籽提取液中原花青素静态吸附试验
准确称取经预处理的AB-8型树脂适量,置于250 mL锥形瓶中,精密加入葡萄籽提液液50 mL,置于恒温摇床中,25℃下振荡24 h,每隔一段时间进行取样一次,测其原花青素含量,绘制静态吸附动力学特征曲线。测定滤液的原花青素含量,并计算AB-8树脂对葡萄籽原花青素静态吸附量、吸附率。
吸附量/(mg/g)=(样品原花青素总量-吸附后滤液中原花青素总量)/树脂的重量
吸附率/%=(样液原花青素总量-吸附后滤液中原花青素总量)/样液原花青素总量×100
1.2.3.3 AB-8大孔树脂对葡萄籽提取液中原花青素动态吸附试验方法
量取葡萄籽提取物溶液适量,分别缓慢地加入装有AB-8树脂的层析柱中,控制流速分别为1、1.5、2.0、2.5 BV/h,收集流分,测定不同流速的原花青素含量。吸附饱和后的树脂用不同乙醇对其进行洗脱,收集洗脱液,依次测定原花青素含量,计算原花青素动态饱和吸附率、解析率和纯度。
解析率/%=洗脱液中原花青素的总量/(样品原花青素总量-吸附后滤液中原花青素总量)×100
纯度/%=产物中原花青素的质量/产物的质量×100
2 结果与分析
2.1 AB-8树脂对葡萄籽提取液中原花青素静态吸附效果
2.1.1 AB-8树脂的用量对静态吸附作用的影响
AB-8树脂与提取液按不同的比例混合,分析树脂对原花青素的吸附效果,树脂用量对静态吸附作用的影响如图1所示。
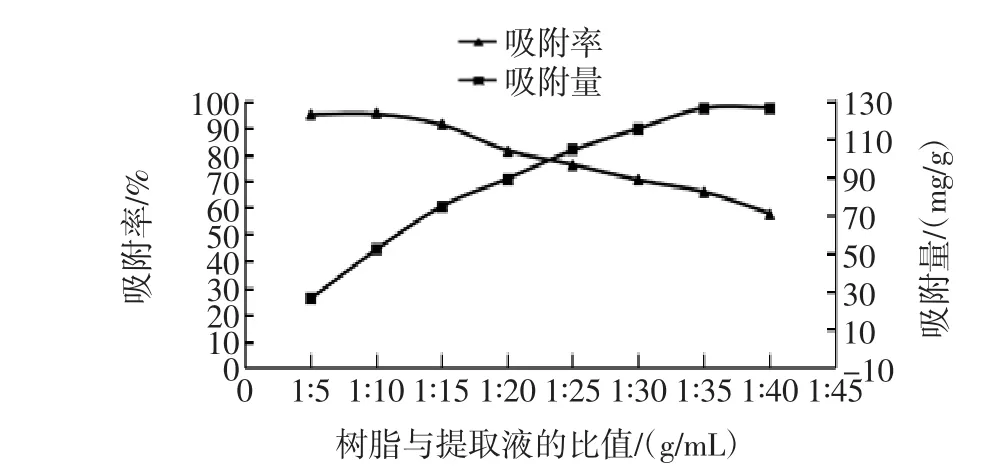
图1 树脂用量对静态吸附作用的影响Fig.1 The effect of resin dosage on static absorption
由图1结果表明,树脂与提取液的比值为1∶10(g/ mL)时,对原花青素是吸附率最高(95.58%);当树脂与提取液的比值在1∶35(g/mL)后,其吸附量基本无变化,达到平衡;本因素试验,以吸附率为考察指标,最终确定树脂与提取液的比值为1∶10(g/mL)。
2.1.2 提取液中原花青素浓度对吸附作用的影响
用不同原花青素含量的提取液进行静态吸附试验,提取液原花青素浓度对静态吸附效果的影响如图2所示。
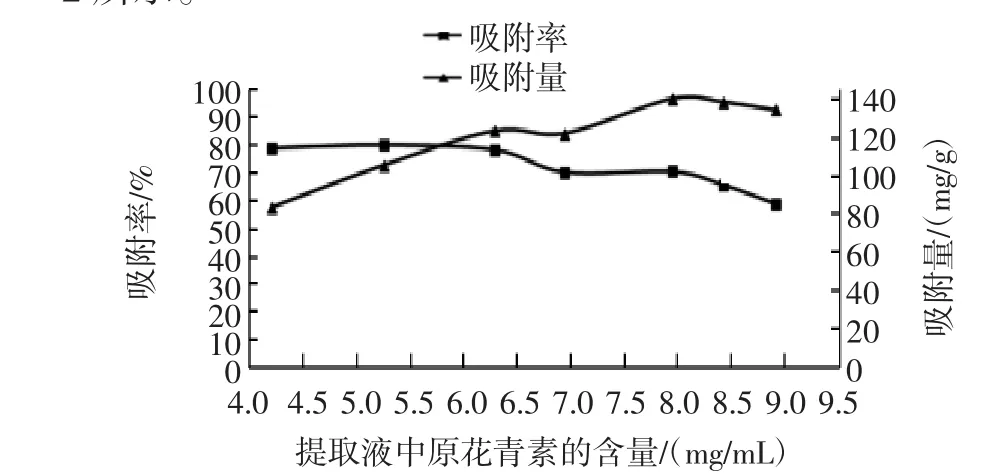
图2 提取液原花青素浓度对静态吸附效果的影响Fig.2 The effect of procyanidins concentration on static absorption efficiency
由图2可知,提取液的原花青素含量在4.0mg/mL~6.5 mg/mL时,吸附率较大且相近;提取液中原花青素含量在8 mg/mL时吸附量较高,但此时吸附率很低;因此综合考虑,以吸附率与吸附量为指标,最终确定上样液浓度为4.5 mg/mL~6.5 mg/mL。
2.1.3 作用时间对静态吸附作用的影响
AB-8树脂对葡萄籽原花青素的静态吸附进程如图3所示。
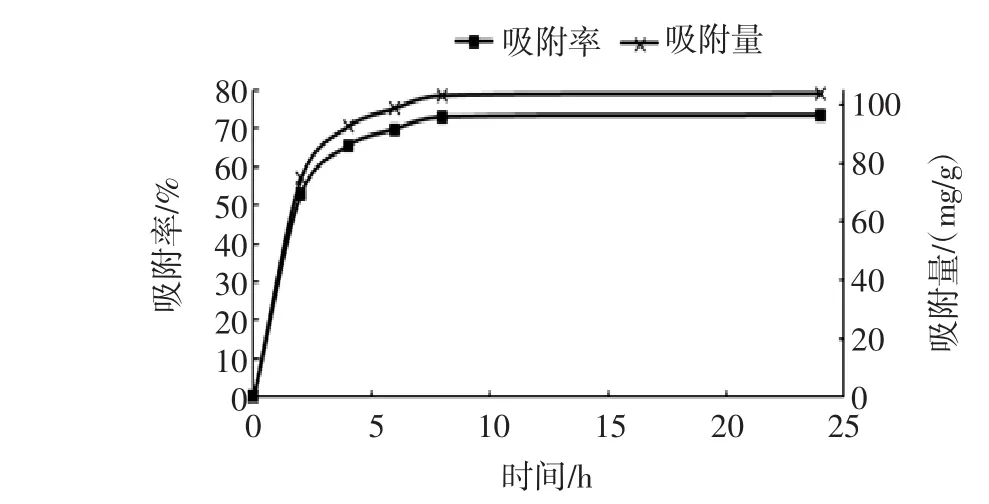
图3 AB-8树脂对葡萄籽原花青素的静态吸附进程Fig.3 The static absorption progress of AB-8 resin on procyanidins in grape seeds
由图3结果可知,树脂对葡萄籽原花青素的静态吸附时(AB-8树脂与提取液以1∶10(g/mL)的比例),在0~24 h内,随着时间的增加,树脂的吸附率与吸附量显著增加,在0~2 h内增加速度最快,当吸附时间达到8 h时,吸附率为72.95%、吸附量为103.104 mg/mL,随后树脂对原花青素的吸附效果变化不大。因此,确定一般为8 h。
2.2 AB-8树脂对葡萄籽提取液中原花青素动态吸附效果
2.2.1 流速对动态吸附作用的影响
上样流速是影响大孔树脂吸附效率的关键因素,若上样速度过快,会使得原花青素吸附量减少,导致原花青素样品的浪费;若上样流速太慢,虽然可以使大孔树脂充分吸附原花青素,但是耗时较长,影响效率。上样流速对葡萄籽原花青素吸附效果的影响如图4所示。
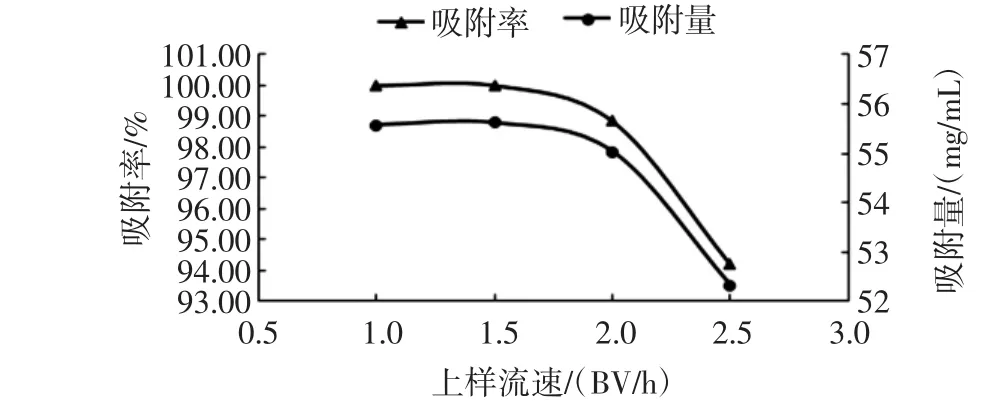
图4 上样流速对葡萄籽原花青素吸附效果的影响Fig.4 The effect of flow rate on procyanidins absorption
由图4可知,上样速度越慢,大孔树脂吸附率和吸附量越大;上样流速达到2 BV/h后,吸附率与吸附量明显下降,上样液在1.0 BV/h~1.5 BV/h间,吸附率与吸附量差别不大,考虑到时间成本,最终确定上样流速为1.5 BV/h。
2.2.2 洗脱液的浓度对动态洗脱效果的影响
采用不同浓度的乙醇溶液对吸附于树脂上的原花青素进行洗脱,确定洗脱液。不同浓度乙醇溶液的解吸效果如图5所示。

图5 不同浓度乙醇溶液的解吸效果Fig.5 The desorption of different concentration alcohol
图5结果表明,随着乙醇浓度的升高,解吸率与纯度均有一个先上升后下降的趋势。孙芸等研究认为,低浓度乙醇(低于40%)可洗脱原花青素的单体及低聚体(有活性部分),40%以上的乙醇可洗脱原花青素的高聚体[6]。同时,乙醇浓度越高,解吸液杂质含量也越多,纯度越低。因此综合考虑树脂解吸率、洗脱原花青素的种类及纯度,选择40%乙醇作为葡萄籽原花青素的解吸剂。
2.2.3 洗脱时的动态解吸分析
用40%乙醇溶液对吸附于树脂上的原花青素进行洗脱,分段对流出液进行分析,测定洗脱率。动态解吸附曲线如图6所示。

图6 动态解吸附曲线Fig.6 The dynamic desorption curve
图6结果表明,通过第1个100 mL时,原花青素开始被洗脱下来,然后在第2个100 mL迅速达到高峰;在第9个100 mL后,吸附在树脂上的原花青素就被完全洗脱下来,并且曲线出峰很快,无明显拖尾。最终换算成柱体积后,则40%乙醇溶液的使用量为6 BV。
2.3 验证试验
为了确认纯化条件组合生产条件的再现性,进行了验证试验。将预处理的AB-8型树脂100 g,进行湿法装柱,分别加入葡萄籽提取物溶液,树脂与提取液比例为1∶10(g/mL),以1.5 BV/h的流速进行动态吸附,纯化水洗至洗脱液中不含有原花青素,弃去流出液。最后以40%乙醇溶液为洗脱剂,洗脱剂用量为6 BV进行解吸附。洗脱下的溶液进行浓缩,烘干。称其固体含量,计算纯度,结果见表1。
3 结论
通过单因素试验,上样液中原花青素含量在4.5 mg/mL~6.5 mg/mL范围较为合适,当AB-8树脂与提取液的比例为1∶10(g/mL),上样流速为1.5 BV/h,吸附时间为8 h时,吸附率达到99%以上;以40%乙醇溶液为洗脱剂,洗脱剂用量为6 BV时,解析率为98%,此条件下得到的固体纯度为94.7%,说明用AB-8型大孔树脂纯化葡萄籽中原花青素的结果可行。

表1 验证试验结果Table 1 Results of confirmatory experiment
[1]王璐,郑茂强,王猛,等.葡萄籽原花青素的分离纯化研究[J].粮食与食品工业,2009,16(1):26-28
[2]赵文恩,韩桂花,焦凤云.葡萄籽原花青素提取工艺研究[J].食品科学,2002,23(8):108-110
[3]张瑜,张换换,李志洲,等.红毛丹果皮中原花青素提取及其抗氧化活性研究[J].食品研究与开发,2011,32(1):188-192
[4]丁利君.AB-8树脂对半边旗提取液中黄酮的吸附作用[J].食品科学,2007,28(10):241-244
[5]孙芸,徐宝才,谷文英,等.AB-8树脂对葡萄籽原花青素按聚合度分离特性的研究[J].食品科技,2007(6):60-63
Separation and Purification of Procyanidins in Grape Seed with Macroporous Adsorption Resin
MA Xiao-qin,WANG Xiao-min,ZHOU Fan*
(Xinjiang Hua Shidan Pharmaceutical Reaearch Co.,Ltd.,Urumqi 830011,Xinjiang,China)
To optimize the technical parameters of optimize the technical parameters of procyanidins separation and purification with macroporous resin.The vanillin-sulfuric acid spectrophotometry was used to investigate adsorption rate,adsorbtion capacity,eluting rate and purity of procyanidin.The results indicated that the optimum ranges of procyanidin in sample solution was 4.5 mg/mL to 6.5 mg/mL.The rate of AB-8 resin and reagent was 1∶10(g/mL),the flow rate was 1.5 BV/h and the adsorbtion time was 8 h,the adsorbtion capacity of procyanidin was more than 95%.The eluting rate of procyanidin and the purity of solid were 99%and 94.7%,respectively,by using 40%ethyl alcohol as eluent with 6 BV of dosage.The macroporous adsorption resin method is reliable and can be applied for separation and purification of procyanidin.
macroporous resin;grape seed;procyanidins;purification
2016-10-21
新疆生产建设兵团中青年科技创新领军人才(2015BC001)作者简介:马小琴(1988—),女(回),助理工程师,学士,主要从事药物制剂研究。
*通信作者:周凡(1984—),女(汉),工程师,硕士,主要从事药物制剂研究。
10.3969/j.issn.1005-6521.2017.16.012

