慢性肾脏病患者24 h尿蛋白定量与贫血的关系研究
熊扬眉,丁国华,石 明,陈星华
·论著·
慢性肾脏病患者24 h尿蛋白定量与贫血的关系研究
熊扬眉,丁国华*,石 明,陈星华
目的 探讨慢性肾脏病(CKD)患者24 h尿蛋白定量与贫血的关系。方法 选取2015年10月—2016年10月在武汉大学人民医院肾内科住院治疗的CKD患者866例。根据24 h尿蛋白定量将患者分为A1(24 h尿蛋白定量≤1.0 g)、A2(1.0 g<24 h尿蛋白定量≤3.0 g)、A3(24 h尿蛋白定量>3.0 g)3组,根据血红蛋白(Hb)判断患者是否贫血,根据估算肾小球滤过率确定患者CKD分期。采用Spearman秩相关分析24 h尿蛋白定量与Hb的相关性;采用单因素Logistic回归分析和多因素Logistic回归分析探讨CKD患者贫血的影响因素;根据CKD分期和24 h尿蛋白定量联合分组,以CKD 1期、A1组为参照,计算其他各组的贫血风险比。结果 866例CKD患者中,325例(37.5%)存在贫血。3组患者Hb水平、贫血发生率比较,差异有统计学意义(P<0.05);3组贫血患者贫血类型比较,差异无统计学意义(P>0.05)。Spearman秩相关结果显示,24 h尿蛋白定量与Hb呈负相关(P<0.05)。单因素Logistic回归分析结果显示,性别、年龄、收缩压、原发病、CKD分期、是否使用血管紧张素转换酶抑制剂(ACEI)/血管紧张素Ⅱ受体拮抗剂(ARB)、是否合并高血压/糖尿病/心血管疾病、清蛋白、钙离子、磷离子、转铁蛋白饱和度、铁蛋白、叶酸、维生素B12(VitB12)、24 h尿蛋白定量是CKD患者贫血的影响因素(P<0.05);多因素Logistic回归分析结果显示,性别、年龄、原发病、CKD分期、钙离子、转铁蛋白饱和度、铁蛋白、叶酸、VitB12、24 h尿蛋白定量是CKD患者、非糖尿病肾病患者贫血的影响因素(P<0.05)。以CKD 1、A1组为参照,随着CKD分期和24 h尿蛋白定量增高,贫血风险比逐渐增大(OR值为1.437~59.108)。结论 24 h尿蛋白定量与CKD患者贫血独立相关,是CKD患者贫血的影响因素,且尿蛋白越多、贫血风险越大。
肾疾病;贫血;蛋白尿
熊扬眉,丁国华,石明,等.慢性肾脏病患者24 h尿蛋白定量与贫血的关系研究[J].中国全科医学,2017,20(22):2739-2745.[www.chinagp.net]
XIONG Y M,DING G H,SHI M,et al.Association between 24-hour urinary protein level and anemia in CKD patients[J].Chinese General Practice,2017,20(22):2739-2745.
贫血是慢性肾脏病(CKD)最为常见的并发症,可降低患者的生活质量、诱发心血管事件、加速肾功能损伤进展[1-3],影响患者预后[4-5],因此明确病因、及时预防并纠正贫血至关重要。目前普遍认为,肾性贫血的主要原因为肾脏受损所致促红细胞生成素(erythropoietin,EPO)生成减少[6-7]。但有研究发现,在CKD早期,即肾功能明显减退之前〔肾小球滤过率(GFR)>60 ml·min-1·1.73 (m2)-1〕,贫血早已发生,且发生率明显高于普通人群[8-9]。STAUFFER等[8]对美国卫生统计中心2007—2010年的全国健康统计数据进行分析,发现CKD 1、2期患者的贫血患病率分别为8.4%、12.2%,同期非肾脏病患者的贫血患病率为6.3%;我国林攀等[9]的研究发现,CKD 1、2期患者的贫血患病率分别为22.00%、36.96%。由此,推测CKD贫血不仅与上述已知原因相关,或许还存在其他一些因素参与其中。ADETUNJI等[10]发现,在肾功能正常的糖尿病患者中,大量蛋白尿者贫血发生率明显高于微量蛋白尿和正常尿蛋白者;亦有研究发现,在肾移植后伴发微量清蛋白尿的患者中,贫血的发生率更高[11]。在这些研究中,贫血的发生难以用肾功能下降来解释,同时提示蛋白尿与贫血似乎存在一定的内在联系。本研究旨在对866例CKD患者的临床资料进行回顾性横断面分析,以探讨24 h尿蛋白定量与贫血的关系,从而为临床贫血的预防和治疗提供新的思路与方向。
1 对象与方法
1.1 研究对象 选取2015年10月—2016年10月在武汉大学人民医院肾内科住院治疗的CKD患者866例,CKD诊断标准参照2012年肾脏病预后质量倡议(Kidney Disease 0utcome Quality Initiative,KDOQI)指南中的定义[12]。纳入标准:(1)临床资料完整;(2)未接受透析治疗。排除标准:(1)CKD 5期〔估算肾小球滤过率(eGFR)<15 ml·min-1·1.73 (m2)-1〕[12];(2)伴慢性肾衰竭急性加重、再生障碍性贫血、溶血性贫血、白血病、骨髓增生异常综合征、恶性肿瘤、严重感染性疾病、泌尿系感染;(3)妊娠期或月经期女性;(4)近期存在活动性出血或输血;(5)伴肝硬化、脾功能亢进、系统性红斑狼疮等影响血液系统的自身免疫性疾病。本研究经武汉大学人民医院伦理委员会审核批准。
1.2 研究方法
1.2.1 一般资料收集 由1名本课题组成员通过本院病历管理系统查阅患者的病历资料,进行一般资料收集。内容包括:性别、年龄、BMI、血压、原发病、CKD分期、是否使用血管紧张素转换酶抑制剂(ACEI)/血管紧张素Ⅱ受体拮抗剂(ARB)、合并症(高血压、糖尿病、心血管疾病)等。其中,CKD分期参照2012年KDOQI指南,以eGFR≥90 ml·min-1·1.73 (m2)-1为1期,以60 ml·min-1·1.73 (m2)-1≤eGFR<90 ml·min-1·1.73 (m2)-1为2期,以30 ml·min-1·1.73 (m2)-1≤eGFR<60 ml·min-1·1.73 (m2)-1为3期,以15 ml·min-1·1.73 (m2)-1≤eGFR<30 ml·min-1·1.73 (m2)-1为4期[12]。合并症中,高血压的诊断标准为:安静休息坐位测量上臂肱动脉部位血压,非同日测量3次收缩压均≥140 mm Hg(1 mm Hg=0.133 kPa)和/或舒张压均≥90 mm Hg,或既往有高血压病史,正在服用降压药物[13];糖尿病的诊断参照2016年美国糖尿病协会(ADA)指南中糖尿病诊断标准:既往有糖尿病病史,正在口服降糖药物或皮下注射胰岛素治疗[14];心血管疾病的诊断标准为:有典型心绞痛、心力衰竭症状,发生急性心肌梗死,或既往有冠心病、心功能不全病史[15-16]。
1.2.2 实验室指标检测 采集患者空腹12 h后的静脉血,送至本院检验科进行检测。(1)采用德国西门子ADVIA2400全自动生化分析仪和上海西门子医学诊断产品有限公司生产的试剂盒,检测清蛋白(检测方法为溴甲酚绿法)、尿酸(UA,检测方法为尿酸酶法)、血肌酐(Scr,检测方法为肌氨酸氧化酶法)、钙离子(检测方法为离子选择性电极间接法)、磷离子(检测方法为离子选择性电极间接法),并计算eGFR。eGFR的计算采用简化MDRD公式:eGFR=186×Scr-1.154×年龄-0.203×0.742(女)[17]。(2)采用日本Sysmex公司XE-2100全自动血液分析仪及其配套试剂盒,检测血红蛋白(Hb)、红细胞平均体积(MCV)、红细胞平均血红蛋白浓度(MCHC),检测方法为十二烷基月桂酰硫酸钠血红蛋白(SLS-Hb)法。根据《内科学》(8版),我国贫血的诊断标准为:海平面地区,Hb,男<120 g/L,女<110 g/L。其中,大细胞性贫血:MCV>100 fl,32%≤MCHC≤35%;正常细胞性贫血:80 fl≤MCV≤100 fl,32%≤MCHC≤35%;小细胞低色素性贫血:MCV<80 fl,MCHC<32%[18]。(3)采用ADVIA Centaur全自动免疫化学发光仪及其配套试剂盒,检测转铁蛋白饱和度、铁蛋白、叶酸、维生素B12(VitB12),检测方法为化学发光免疫法。(4)留取患者24 h(清晨7:00~次日清晨7:00)尿液,采用德国罗氏C8000全自动生化分析仪及其配套试剂盒,检测24 h尿蛋白定量,检测方法为免疫透射比浊法。参照文献[19],尿蛋白定量>1.0 g、肾脏病范围内的蛋白尿(3.0~3.5 g/d)与CKD患者的不良预后密切相关。故本研究根据24 h尿蛋白定量将患者分为3组,以24 h尿蛋白定量≤1.0 g为A1组、以1.0 g<24 h尿蛋白定量≤3.0 g为A2组、以24 h尿蛋白定量>3.0 g为A3组。
2 结果
2.1 患者基本情况 866例CKD患者中,男514例(59.4%),女352例(40.6%);年龄17~93岁,平均年龄(51.4±18.7)岁;原发病为慢性肾小球肾炎432例(49.9%),高血压性肾损害108例(12.5%),糖尿病肾病122例(14.1%),不详105例(12.1%),未分类99例(11.4%);CKD分期为1期272例(31.4%),2期189例(21.8%),3期238例(27.5%),4期167例(19.3%);使用ACEI/ARB 254例(29.3%);合并高血压531例(61.3%),合并糖尿病186例(21.5%),合并心血管疾病93例(10.7%);平均Hb(124±22) g/L,325例(37.5%)存在贫血;24 h尿蛋白定量≤1.0 g 357例(41.2%),1.0 g<24 h尿蛋白定量≤3.0 g 296例(34.2%),24 h尿蛋白定量>3.0 g 213例(24.6%)。
2.2 3组患者贫血情况比较 3组患者Hb水平、贫血发生率比较,差异有统计学意义(P<0.05);3组贫血患者贫血类型比较,差异无统计学意义(P>0.05,见表1)。
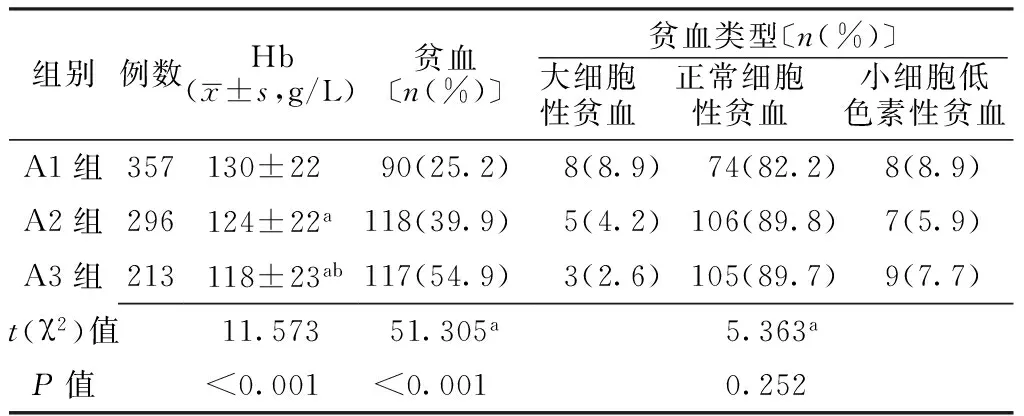
表1 3组患者贫血情况比较
注:Hb=血红蛋白;a为χ2值;与A1组比较,aP<0.05;与A2组比较,bP<0.05
2.3 CKD患者24 h尿蛋白定量与Hb的相关性分析 Spearman秩相关结果显示,24 h尿蛋白定量与Hb呈负相关(rs=-0.288,P<0.05)。
2.4 CKD患者贫血的影响因素分析
2.4.1 CKD患者贫血影响因素的单因素Logistic回归分析 以是否贫血为因变量(赋值:不贫血=0,贫血=1),以性别、年龄、BMI、收缩压、舒张压、原发病、CKD分期、是否使用ACEI/ARB、是否合并高血压/糖尿病/心血管疾病、清蛋白、UA、钙离子、磷离子、转铁蛋白饱和度、铁蛋白、叶酸、VitB12、24 h尿蛋白定量为自变量(赋值:性别,男=0,女=1;原发病,慢性肾小球肾炎=0,高血压性肾损害=1,糖尿病肾病=2,不详=3,未分类=4;CKD分期,1期=0,2期=1,3期=2,4期=3;是否使用ACEI/ARB,否=0,是=1;是否合并高血压/糖尿病/心血管疾病,否=0,是=1;24 h尿蛋白定量,A1组=0,A2组=1,A3组=2;其他指标均以实际值纳入),进行单因素Logistic回归分析。结果显示,性别、年龄、收缩压、原发病、CKD分期、是否使用ACEI/ARB、是否合并高血压/糖尿病/心血管疾病、清蛋白、钙离子、磷离子、转铁蛋白饱和度、铁蛋白、叶酸、VitB12、24 h尿蛋白定量是CKD患者贫血的影响因素(P<0.05,见表2)。
2.4.2 CKD患者贫血影响因素的多因素Logistic回归分析 以是否贫血为因变量,以单因素分析中差异有统计学意义的指标为自变量,进行多因素Logistic回归分析。结果显示,性别、年龄、原发病、CKD分期、钙离子、转铁蛋白饱和度、铁蛋白、叶酸、VitB12、24 h尿蛋白定量是CKD患者贫血的影响因素(P<0.05,见表3)。
表2 CKD患者贫血影响因素的单因素Logistic回归分析
Table 2 Univariate Logistic regression analysis of the possible associated factors for anemia in CKD patients
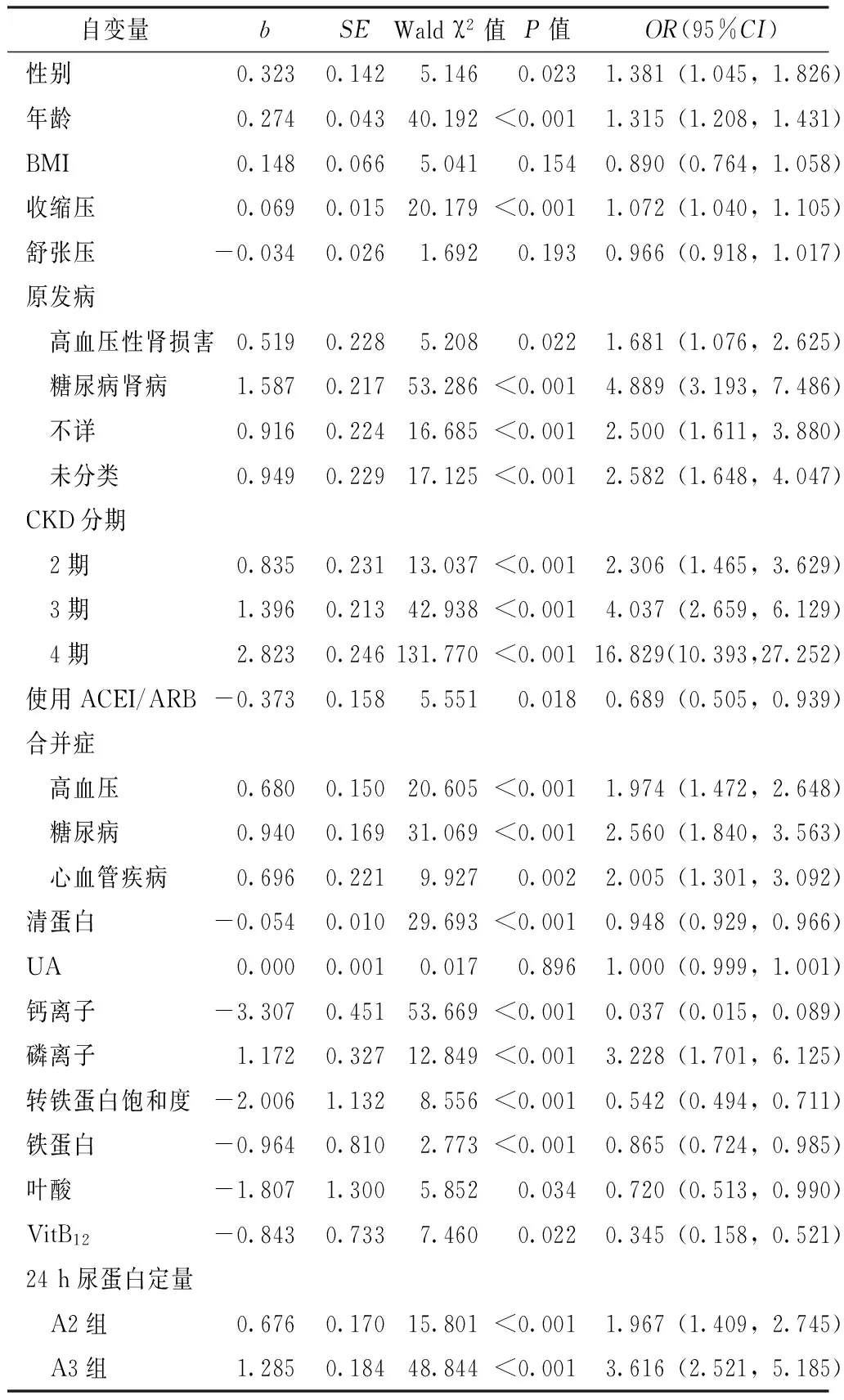
自变量bSEWaldχ2值P值OR(95%CI)性别0.3230.1425.1460.023 1.381(1.045,1.826)年龄0.2740.04340.192<0.0011.315(1.208,1.431)BMI0.1480.0665.0410.1540.890(0.764,1.058)收缩压0.0690.01520.179<0.0011.072(1.040,1.105)舒张压-0.0340.0261.6920.1930.966(0.918,1.017)原发病 高血压性肾损害0.5190.2285.2080.0221.681(1.076,2.625) 糖尿病肾病1.5870.21753.286<0.0014.889(3.193,7.486) 不详0.9160.22416.685<0.0012.500(1.611,3.880) 未分类0.9490.22917.125<0.0012.582(1.648,4.047)CKD分期 2期0.8350.23113.037<0.0012.306(1.465,3.629) 3期1.3960.21342.938<0.0014.037(2.659,6.129) 4期2.8230.246131.770<0.00116.829(10.393,27.252)使用ACEI/ARB-0.3730.1585.5510.0180.689(0.505,0.939)合并症 高血压0.6800.15020.605<0.0011.974(1.472,2.648) 糖尿病0.9400.16931.069<0.0012.560(1.840,3.563) 心血管疾病0.6960.2219.9270.0022.005(1.301,3.092)清蛋白-0.0540.01029.693<0.0010.948(0.929,0.966)UA0.0000.0010.0170.8961.000(0.999,1.001)钙离子-3.3070.45153.669<0.0010.037(0.015,0.089)磷离子1.1720.32712.849<0.0013.228(1.701,6.125)转铁蛋白饱和度-2.0061.1328.556<0.0010.542(0.494,0.711)铁蛋白-0.9640.8102.773<0.0010.865(0.724,0.985)叶酸-1.8071.3005.8520.0340.720(0.513,0.990)VitB12-0.8430.7337.4600.0220.345(0.158,0.521)24h尿蛋白定量 A2组0.6760.17015.801<0.0011.967(1.409,2.745) A3组1.2850.18448.844<0.0013.616(2.521,5.185)
注:CKD=慢性肾脏病,ACEI/ARB=血管紧张素转换酶抑制剂/血管紧张素Ⅱ受体拮抗剂,UA=尿酸,VitB12=维生素B12
2.4.3 非糖尿病肾病患者贫血影响因素的多因素Logistic回归分析 以是否贫血为因变量,以表2中差异有统计学意义的指标为自变量,进行多因素Logistic回归分析。结果显示,性别、年龄、原发病、CKD分期、钙离子、转铁蛋白饱和度、铁蛋白、叶酸、VitB12、24 h尿蛋白定量是非糖尿病肾病患者贫血的影响因素(P<0.05,见表4)。
2.5 CKD分期与24 h尿蛋白定量联合分组的贫血发生率比较 根据CKD分期(1~4期)和24 h尿蛋白定量(A1组、A2组、A3组),将CKD患者联合分为12组。以CKD1、A1组为参照,随着CKD分期和24 h尿蛋白定量增高,贫血风险比逐渐增大(OR值为1.437~59.108,见表5)。
3 讨论
蛋白尿是CKD患者疾病进展、心血管事件发生及高死亡率的独立影响因素[20-23]。2012年美国肾脏病基金会(KDIGO)指南已将清蛋白尿作为CKD的分类标准之一[24],但目前关于蛋白尿与贫血关系的研究较少。本研究就24 h尿蛋白定量与贫血的关系进行探讨,结果显示CKD患者24 h尿蛋白定量与贫血独立相关,且尿蛋白越多、贫血风险越大。
蛋白尿加重贫血的可能机制如下:蛋白从肾小球漏出的同时可诱导肾小管周围转化生长因子-β(TGF-β)、血小板衍生因子(PDGF)、内皮素-1(ET-1)、Ⅰ型纤溶酶原激活物抑制因子(PAI-1)等细胞生长因子大量释放,后者介导肾小管间质纤维化,分泌EPO的肾间质细胞受损,EPO绝对不足,红细胞生成减少[20]。MISE等[25]分析了113例经肾活检诊断为糖尿病肾病患者的病理资料,发现间质纤维化和小管萎缩与贫血密切相关,间质纤维化和小管萎缩评分越高,贫血越严重;其次尿中铁元素、转铁蛋白的流失也是贫血的成因。另外,经研究证实尿蛋白与体内微炎性状态密切相关[26-27],而炎性因子〔如白介素6(IL-6)、肿瘤坏死因子(TNF)、干扰素(INF)〕可以抑制红系细胞的增殖和分化,并通过一系列途径导致EPO低应答[28],从而加重贫血。
表3 CKD患者贫血影响因素的多因素Logistic回归分析
Table 3 Multivariate Logistic regression analysis of the possible associated factors for anemia in CKD patients
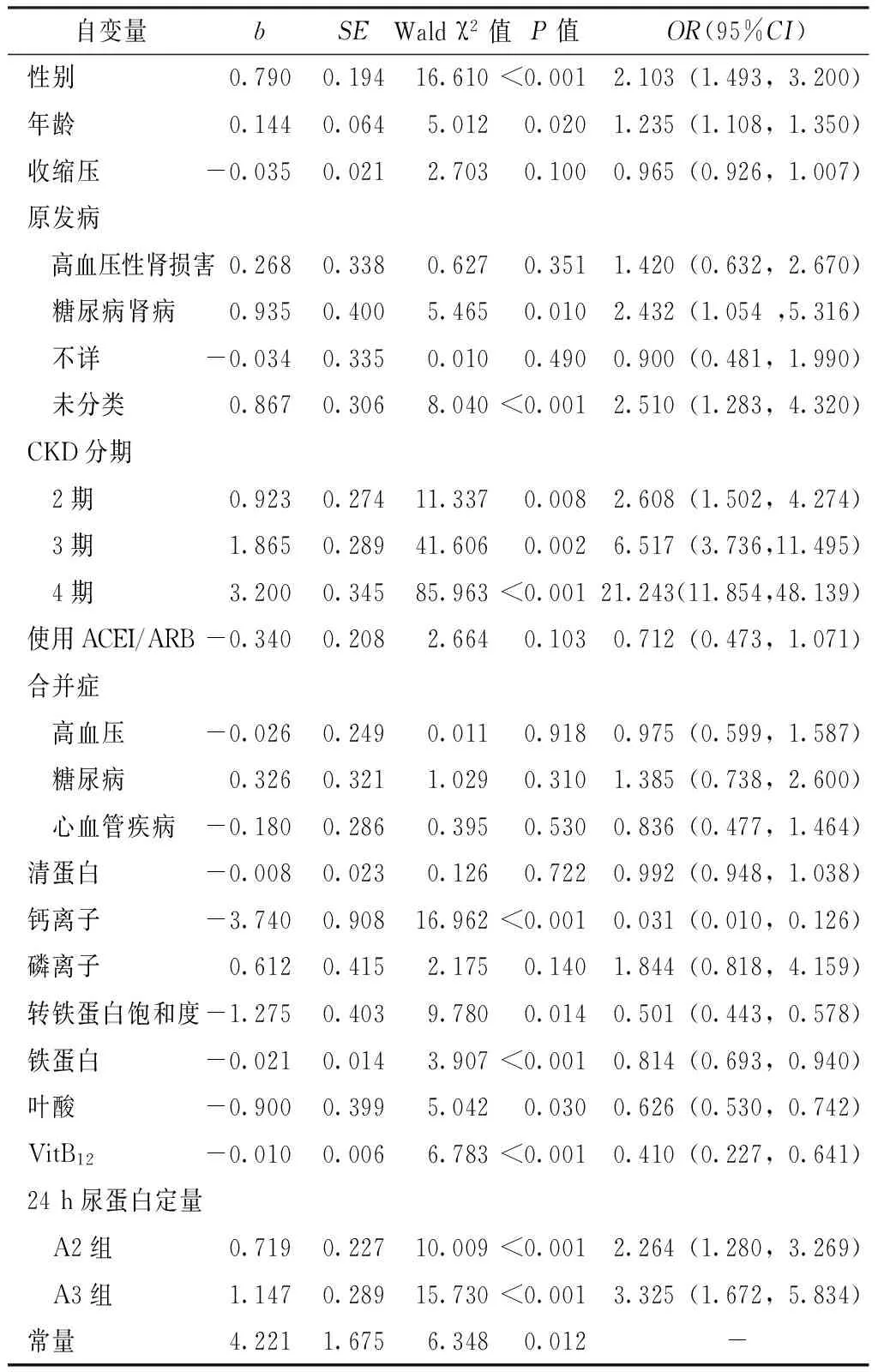
自变量bSEWaldχ2值P值OR(95%CI)性别0.7900.19416.610<0.001 2.103(1.493,3.200)年龄0.1440.0645.0120.0201.235(1.108,1.350)收缩压-0.0350.0212.7030.1000.965(0.926,1.007)原发病 高血压性肾损害0.2680.3380.6270.3511.420(0.632,2.670) 糖尿病肾病0.9350.4005.4650.0102.432(1.054,5.316) 不详-0.0340.3350.0100.4900.900(0.481,1.990) 未分类0.8670.3068.040<0.0012.510(1.283,4.320)CKD分期 2期0.9230.27411.3370.0082.608(1.502,4.274) 3期1.8650.28941.6060.0026.517(3.736,11.495) 4期3.2000.34585.963<0.00121.243(11.854,48.139)使用ACEI/ARB-0.3400.2082.6640.1030.712(0.473,1.071)合并症 高血压-0.0260.2490.0110.9180.975(0.599,1.587) 糖尿病0.3260.3211.0290.3101.385(0.738,2.600) 心血管疾病-0.1800.2860.3950.5300.836(0.477,1.464)清蛋白-0.0080.0230.1260.7220.992(0.948,1.038)钙离子-3.7400.90816.962<0.0010.031(0.010,0.126)磷离子0.6120.4152.1750.1401.844(0.818,4.159)转铁蛋白饱和度-1.2750.4039.7800.0140.501(0.443,0.578)铁蛋白-0.0210.0143.907<0.0010.814(0.693,0.940)叶酸-0.9000.3995.0420.0300.626(0.530,0.742)VitB12-0.0100.0066.783<0.0010.410(0.227,0.641)24h尿蛋白定量 A2组0.7190.22710.009<0.0012.264(1.280,3.269) A3组1.1470.28915.730<0.0013.325(1.672,5.834)常量4.2211.6756.3480.012-
注:-代表无此数据
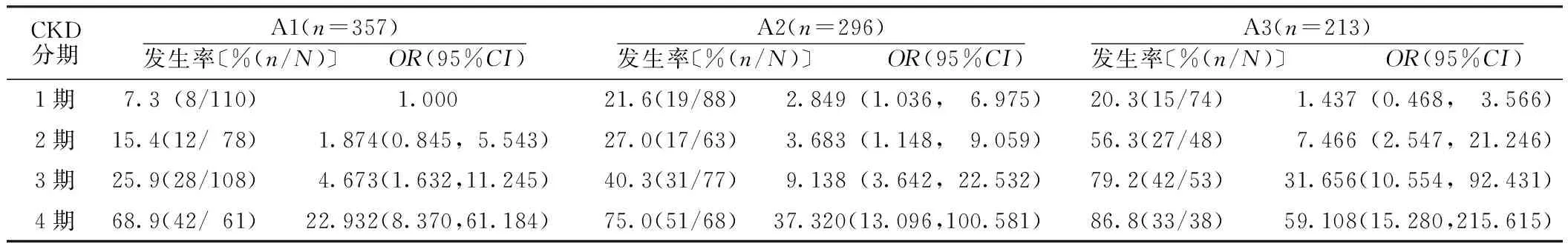
表5 CKD分期与24 h尿蛋白定量联合分组的贫血发生率比较
表4 非糖尿病肾病患者贫血影响因素的多因素Logistic回归分析
Table 4 Multivariate Logistic regression analysis of the possible associated factors for anemia in non-diabetic nephropathy patients
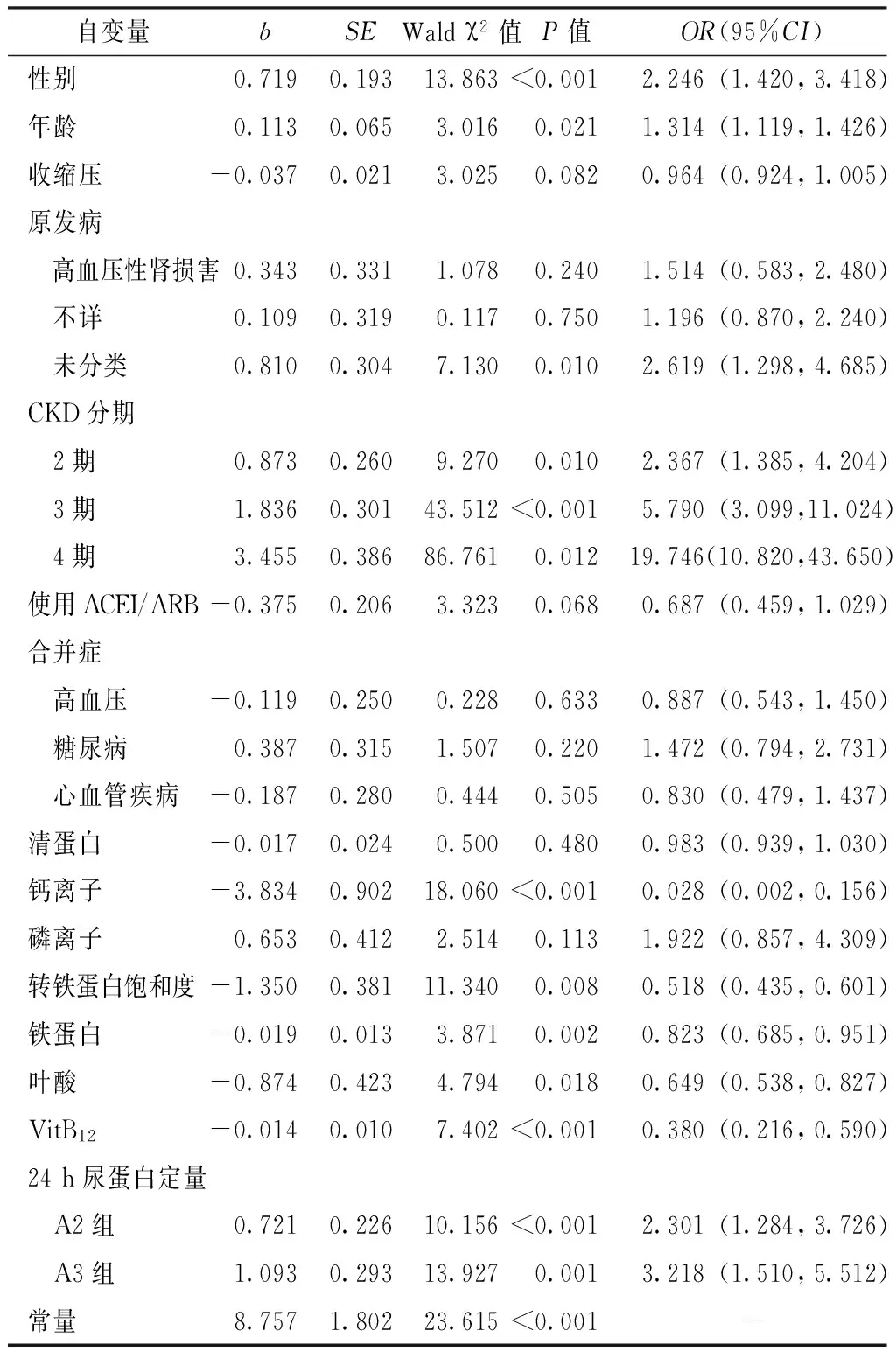
自变量bSEWaldχ2值P值OR(95%CI)性别0.7190.19313.863<0.001 2.246(1.420,3.418)年龄0.1130.0653.0160.0211.314(1.119,1.426)收缩压-0.0370.0213.0250.0820.964(0.924,1.005)原发病 高血压性肾损害0.3430.3311.0780.2401.514(0.583,2.480) 不详0.1090.3190.1170.7501.196(0.870,2.240) 未分类0.8100.3047.1300.0102.619(1.298,4.685)CKD分期 2期0.8730.2609.2700.0102.367(1.385,4.204) 3期1.8360.30143.512<0.0015.790(3.099,11.024) 4期3.4550.38686.7610.01219.746(10.820,43.650)使用ACEI/ARB-0.3750.2063.3230.0680.687(0.459,1.029)合并症 高血压-0.1190.2500.2280.6330.887(0.543,1.450) 糖尿病0.3870.3151.5070.2201.472(0.794,2.731) 心血管疾病-0.1870.2800.4440.5050.830(0.479,1.437)清蛋白-0.0170.0240.5000.4800.983(0.939,1.030)钙离子-3.8340.90218.060<0.0010.028(0.002,0.156)磷离子0.6530.4122.5140.1131.922(0.857,4.309)转铁蛋白饱和度-1.3500.38111.3400.0080.518(0.435,0.601)铁蛋白-0.0190.0133.8710.0020.823(0.685,0.951)叶酸-0.8740.4234.7940.0180.649(0.538,0.827)VitB12-0.0140.0107.402<0.0010.380(0.216,0.590)24h尿蛋白定量 A2组0.7210.22610.156<0.0012.301(1.284,3.726) A3组1.0930.29313.9270.0013.218(1.510,5.512)常量8.7571.80223.615<0.001-
注:-代表无此数据
贫血也可以促进蛋白尿的进展。OKADA等[29]对470例正常清蛋白尿的2型糖尿病患者进行平均3年的随访分析,发现校正了多种混杂因素影响后,贫血患者发生清蛋白尿的风险是非贫血者的4.78倍(男)和4.62倍(女),认为低Hb水平可以预示2型糖尿病患者的蛋白尿进展。目前贫血促进蛋白尿的具体机制尚不明确,结合既往研究分析有以下可能:贫血加重肾脏慢性低氧,肾小管间质对低氧刺激极其敏感,在氧化应激和炎性因子的作用下,小管间质细胞增生并细胞外基质沉积,逐渐出现纤维化[30-31]。而小管损伤后通过“管球反馈”作用和蛋白重吸收减少,导致尿中蛋白大量流失[32-33]。
目前临床研究中,关于蛋白尿与CKD贫血的相关性尚存在争议。FISHER等[34]进行的美国慢性肾功能不全队列研究(chronic renal insufficiency cohort study,CRIC)中纳入轻度到重度慢性肾衰竭患者共3 481例,结果显示高尿清蛋白肌酐比值(urine albumin-creatinine ratio,ACR)或高尿蛋白肌酐比值(urine protein-creatinine ratio,PCR)与Hb水平降低相关,且该相关性在高PCR水平(PCR>5 mg/g)时格外显著。INKER等[35]对美国国家健康与营养调查(national health and nutrition examination survey,NHANES)中30 528例成年人进行了数据统计,分析ACR与CKD并发症间的相关性,结果显示仅在eGFR≥120 ml·min-1·1.73 (m2)-1或40~59 ml·min-1·1.73 (m2)-1时,ACR与贫血相关且相关性较弱。VISWANATHAN等[36]对美国肾脏疾病饮食改进研究(modification of diet in renal disease study,MDRD)中1 665例CKD患者进行分析发现,校正eGFR的影响后,尿蛋白与贫血的相关性无统计学意义。本研究与后两项研究结果不一致的原因可能为:本研究纳入患者中大量蛋白尿者(24 h尿蛋白定量>3.0 g)较多(24.6%),而大量蛋白尿者更容易出现贫血[37]。这可能是因为大量蛋白尿更能反映肾小球滤过屏障的破坏和分泌EPO细胞的受损,同时也意味着转铁蛋白的大量丢失[38]。经众多研究证实,糖尿病肾病患者的贫血发生率较其他类型肾病患者明显升高,这可能与EPO低应答、胰岛素抵抗、自主神经病变、微循环障碍等密切相关[39-41]。因此,本研究特针对非糖尿病肾病患者的贫血影响因素进行单独的多因素Logistic回归分析,结果未发生改变。
另外,本研究也存在一定的不足之处:(1)与其他研究相比,本研究样本量偏少,但纳入人群中CKD分期为1~4期的患者比例较为均衡,A3组患者比例较高,或许能更好地反映尿蛋白与贫血间的相关性。FISHER等[34]的研究纳入了3 481例患者,几乎均为肾功能减退者〔平均eGFR为(43.1±13.4)ml·min-1·1.73 (m2)-1〕;INKER等[35]的研究中共纳入30 528例患者,其中大部分为肾功能正常者〔eGFR≥60 ml·min-1·1.73 (m2)-1〕和正常/微量蛋白尿者(ACR≤300 mg/g),分别占94.50%和97.90%;VISWANATHAN等[36]研究的纳入者为非糖尿病肾病且eGFR<70 ml·min-1·1.73 (m2)-1。(2)KDIGO指南已推荐ACR为CKD的分类标准,但本研究仍采用24 h尿蛋白定量这一指标进行分析。清蛋白为中分子量蛋白,可较好地反映肾小球血管内皮早期损伤。24 h尿蛋白定量不仅包括尿清蛋白,还包括IgG、转铁蛋白等大分子量蛋白和β2-微球蛋白、溶菌酶等反映肾小管功能损伤的小分子量蛋白,或许更能反映肾脏的受损程度[42]。(3)由于纳入患者的铁剂和EPO使用情况缺失,本研究未能将生血药物的使用情况纳入分析。但考虑到本研究所纳入患者主要为下级医院转诊和首次发现肾脏病的患者,入院前生血药物使用率和Hb达标率不高,故该部分信息的缺失对本研究结果影响不大。(4)本文为横断面研究,无法探讨尿蛋白与贫血间的因果关系,两者之间的分子机制尚有待进一步研究。
综上所述,CKD患者24 h尿蛋白定量与贫血独立相关,尿蛋白越多,贫血风险越大。两者之间的分子机制尚有待进一步研究。在临床工作中,对于尿蛋白较多的CKD患者,应积极采取措施减少蛋白尿,同时密切随访,检查血常规,及早发现并纠正贫血,以提高患者生活质量,延缓肾功能进展。
作者贡献:熊扬眉进行课题设计与实施、资料收集与整理、撰写论文,成文并对文章负责;石明、陈星华进行课题评估及论文修改;丁国华进行质量控制及审校。
本文无利益冲突。
[1]ERIKSSON D,GOLDSMITH D,TEITSSON S,et al.Cross-sectional survey in CKD patients across Europe describing the association between quality of life and anaemia[J].BMC Nephrol,2016,17(1):97.DOI:10.1186/s12882-016-0312-9.
[2]PORTOLES J,GORRIZ J L,RUBIO E,et al.The development of anemia is associated to poor prognosis in NKF/KDOQI stage 3 chronic kidney disease[J].BMC Nephrol,2013,14(1):2.DOI:10.1186/1471-2369-14-2.
[3]张书通,卢文,钱浩,等.狼疮性肾炎患者肾功能快速进展的相关危险因素探讨[J].安徽医学,2016,37(4):441-444.DOI:10.3969/j.issn.1000-0399.2016.04.018. ZHANG S T,LU W,QIAN H,et al.Risk factors for rapid progression of renal function in patients with lupus nephritis[J].Anhui Medical Journal,2016,37(4):441-444.DOI:10.3969/j.issn.1000-0399.2016.04.018.
[4]WEINER D E,TIGHIOUART H,VLAGOPOULOS P T,et al.Effects of anemia and left ventricular hypertrophy on cardiovascular disease in patients with chronic kidney disease[J].J Am Soc Nephrol,2005,16(6):1803-1810.DOI:10.1681/ASN.2004070597.
[5]ZOPPINI G,TARGHER G,CHONCHOL M,et al.Anaemia,independent of chronic kidney disease,predicts all-cause and cardiovascular mortality in type 2 diabetic patients[J].Atherosclerosis,2010,210(2):575-580.DOI:10.1016/j.atherosclerosis.2009.12.008.
[6]KUTUBY F,WANG S,DESAI C,et al.Anemia of chronic kidney disease[J].Dis Mon,2015,61(10):421-424.DOI:10.1016/j.disamonth.2015.08.002.
[7]SATO Y,YANAGITA M.Renal anemia:from incurable to curable[J].Am J Physiol Renal Physiol,2013,305(9):1239-1248.DOI:10.1152/ajprenal.00233.2013.
[8]STAUFFER M E,FAN T.Prevalence of anemia in chronic kidney disease in the United States[J].PLoS One,2014,9(1):e84943.DOI:10.1371/journal.pone.0084943.
[9]林攀,丁小强,袁敏,等.慢性肾脏病患者贫血患病现况调查[J].复旦学报(医学版),2009,36(5):562-565.DOI:10.3969/j.issn.1672-8467.2009.05.013. LIN P,DING X Q,YUAN M,et al.A cross-sectional study on anemia and its risk factors in chronic kidney disease[J].Fudan University Journal of Medical Sciences,2009,36(5):562-565.DOI:10.3969/j.issn.1672-8467.2009.05.013.
[10]ADETUNJI O R,MANI H,OLUJOHUNGBE A,et al."Microalbuminuric anaemia"——the relationship between haemoglobin levels and albuminuria in diabetes[J].Diabetes Res Clin Pract,2009,85(2):179-182.DOI:10.1016/j.diabres.2009.04.028.
[11]UNAL A,KOCYIGIT I,ARIKAN T,et al.Microalbuminuria is associated with high prevalence of anemia in renal transplant recipients[J].Transplant Proc,2013,45(3):949-952.DOI:10.1016/j.transproceed.2013.02.066.
[12]INKER L A,ASTOR B C,FOX C H,et al.KDOQI US commentary on the 2012 KDIGO clinical practice guideline for the evaluation and management of CKD[J].Am J Kidney Dis,2014,63(5):713-735.DOI:10.1053/j.ajkd.2014.01.416.
[13]SHROUT T,RUDY D W,PIASCIK M T.Hypertension update,JNC8 and beyond[J].Curr Opin Pharmacol,2017,33:41-46.DOI:10.1016/j.coph.2017.03.004.
[14]CHAMBERLAIN J J,RHINEHART A S,SHAEFER C J,et al.Diagnosis and management of diabetes:synopsis of the 2016 American Diabetes Association standards of medical care in diabetes[J].Ann Intern Med,2016,164(8):542-552.DOI:10.7326/M15-3016.
[15]JESSUP M,MARWICK T H,PONIKOWSKI P,et al.2016 ESC and ACC/AHA/HFSA heart failure guideline update——what is new and why is it important?[J].Nat Rev Cardiol,2016,13(10):623-628.DOI:10.1038/nrcardio.2016.134.
[16]MARTIN S S,SPERLING L S,BLAHA M J,et al.Clinician-patient risk discussion for atherosclerotic cardiovascular disease prevention:importance to implementation of the 2013 ACC/AHA Guidelines[J].J Am Coll Cardiol,2015,65(13):1361-1368.DOI:10.1016/j.jacc.2015.01.043.
[17]葛均波,徐永健.内科学[M].8版.北京:人民卫生出版社,2008:543. GE J B,XU Y J.Internal medicine[M].8th ed.Beijing:People′s Medical Publishing House,2008:543.
[18]LEVEY A S,CORESH J,BALK E,et al.National Kidney Foundation practice guidelines for chronic kidney disease:evaluation,classification,and stratification[J].Ann Intern Med,2003,139(2):137-147.
[19]乐伟波,梁少珊,邓康平,等.1 126例中国汉族成人IgA肾病患者的长期预后及危险因素分析[J].肾脏病与透析肾移植杂志,2011,20(2):101-108.DOI:10.3969/j.issn.1006-298X.2011.02.001. LE W B,LIANG S S,DENG K P,et al.Long-term renal survival and related risk factors of patients with IgA nephropathy:results from a cohort of 1 126 cases in a Chinese adult population[J].Chinese Journal of Nephrology,Dialysis & Transplantation,2011,20(2):101-108.DOI:10.3969/j.issn.1006-298X.2011.02.001.
[20]ABBATE M,ZOJA C,REMUZZI G.How does proteinuria cause progressive renal damage?[J].J Am Soc Nephrol,2006,17(11):2974-2984.DOI:10.1681/ASN.2006040377.
[21]LAMBERS H H,GANSEVOORT R T.Albuminuria is an appropriate therapeutic target in patients with CKD:the proview[J].Clin J Am Soc Nephrol,2015,10(6):1079-1088.DOI:10.2215/CJN.11511114.
[22]LIM C C,TEO B W,ONG P G,et al.Chronic kidney disease,cardiovascular disease and mortality:a prospective cohort study in a multi-ethnic Asian population[J].Eur J Prev Cardiol,2015,22(8):1018-1026.DOI:10.1177/2047487314536873.
[23]TANAKA F,KOMI R,MAKITA S,et al.Low-grade albuminuria and incidence of cardiovascular disease and all-cause mortality in nondiabetic and normotensive individuals[J].J Hypertens,2016,34(3):506-512.DOI:10.1097/HJH.0000000000000809.
[24]ANDRASSY K M.Comments on ′KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease′[J].Kidney Int,2013,84(3):622-623.DOI:10.1038/ki.2013.243.
[25]MISE K,HOSHINO J,UENO T,et al.Impact of tubulointerstitial lesions on anaemia in patients with biopsy-proven diabetic nephropathy[J].Diabet Med,2015,32(4):546-555.DOI:10.1111/dme.12633.
[26]NERPIN E,HELMERSSON-KARLQVIST J,RISERUS U,et al.Inflammation,oxidative stress,glomerular filtration rate,and albuminuria in elderly men:a cross-sectional study[J].BMC Res Notes,2012,5(1):537.DOI:10.1186/1756-0500-5-537.
[27]GUPTA J,MITRA N,KANETSKY P A,et al.Association between albuminuria,kidney function,and inflammatory biomarker profile in CKD in CRIC[J].Clin J Am Soc Nephrol,2012,7(12):1938-1946.DOI:10.2215/CJN.03500412.
[28]ICARDI A,PAOLETTI E,DE NICOLA L,et al.Renal anaemia and EPO hyporesponsiveness associated with vitamin D deficiency:the potential role of inflammation[J].Nephrol Dial Transplant,2013,28(7):1672-1679.DOI:10.1093/ndt/gft021.
[29]OKADA H,HASEGAWA G,TANAKA M,et al.Association between hemoglobin concentration and the progression or development of albuminuria in diabetic kidney disease[J].PLoS One,2015,10(5):e129192.DOI:10.1371/journal.pone.0129192.
[30]NORMAN J T,CLARK I M,GARCIA P L.Hypoxia promotes fibrogenesis in human renal fibroblasts[J].Kidney Int,2000,58(6):2351-2366.DOI:10.1046/j.1523-1755.2000.00419.x.
[31]NANGAKU M.Chronic hypoxia and tubulointerstitial injury:a final common pathway to end-stage renal failure[J].J Am Soc Nephrol,2006,17(1):17-25.DOI:10.1681/ASN.2005070757.
[32]THOMAS M C,BURNS W C,COOPER M E.Tubular changes in early diabetic nephropathy[J].Adv Chronic Kidney Dis,2005,12(2):177-186.
[33]HASHIMOTO Y,YAMAGISHI S,MIZUKAMI H,et al.Polyol pathway and diabetic nephropathy revisited:early tubular cell changes and glomerulopathy in diabetic mice overexpressing human aldose reductase[J].J Diabetes Investig,2011,2(2):111-122.DOI:10.1111/j.2040-1124.2010.00071.x.
[34]FISHER H,HSU C Y,VITTINGHOFF E,et al.Comparison of associations of urine protein-creatinine ratio versus albumin-creatinine ratio with complications of CKD:a cross-sectional analysis[J].Am J Kidney Dis,2013,62(6):1102-1108.DOI:10.1053/j.ajkd.2013.07.013.
[35]INKER L A,CORESH J,LEVEY A S,et al.Estimated GFR,albuminuria,and complications of chronic kidney disease[J].J Am Soc Nephrol,2011,22(12):2322-2331.DOI:10.1681/ASN.2010111181.
[36]VISWANATHAN G,SARNAK M J,TIGHIOUART H,et al.The association of chronic kidney disease complications by albuminuria and glomerular filtration rate:a cross-sectional analysis[J].Clin Nephrol,2013,80(1):29-39.
[37]THOMAS M C,MACISAAC R J,TSALAMANDRIS C,et al.Unrecognized anemia in patients with diabetes:a cross-sectional survey[J].Diabetes Care,2003,26(4):1164-1169.
[38]VAZIRI N D.Erythropoietin and transferrin metabolism in nephrotic syndrome[J].Am J Kidney Dis,2001,38(1):1-8.DOI:10.1053/ajkd.2001.25174.
[39]GROSSMAN C,DOVRISH Z,KOREN-MORAG N,et al.Diabetes mellitus with normal renal function is associated with anaemia[J].Diabetes Metab Res Rev,2014,30(4):291-296.DOI:10.1002/dmrr.2491.
[40]BONAKDARAN S,GHAREBAGHI M,VAHEDIAN M.Prevalence of anemia in type 2 diabetes and role of renal involvement[J].Saudi J Kidney Dis Transpl,2011,22(2):286-290.
[41]PAPPA M,DOUNOUSI E,DUNI A,et al.Less known pathophysiological mechanisms of anemia in patients with diabetic nephropathy[J].Int Urol Nephrol,2015,47(8):1365-1372.DOI:10.1007/s11255-015-1012-2.
[42]METHVEN S,TRAYNOR J P,HAIR M D,et al.Stratifying risk in chronic kidney disease:an observational study of UK guidelines for measuring total proteinuria and albuminuria[J].QJM,2011,104(8):663-670.DOI:10.1093/qjmed/hcr026.
(本文编辑:王凤微)
Association between 24-hour Urinary Protein Level and Anemia in CKD Patients
XIONGYang-mei,DINGGuo-hua*,SHIMing,CHENXing-hua
DepartmentofNephrology,RenminHospitalofWuhanUniversity,Wuhan430060,China
*Correspondingauthor:DINGGuo-hua,Chiefphysician,Doctoralsupervisor;E-mail:ghxding@gmail.com
Objective To evaluate the association between 24-hour urinary protein level and anemia in chronic kidney disease(CKD) patients.Methods Eight hundred and sixty-six CKD inpatients who
treatment in Department of Nephrology,Renmin Hospital of Wuhan University from October 2015 to October 2016 were enrolled.Based on the 24-hour urinary protein level,they were divided into three groups:group A1(24-hour urinary protein level≤1.0 g),group A2(1.0 g<24-hour urinary protein level≤3.0 g),group A3(24-hour urinary protein level>3.0 g).The diagnosis of anemia was based on hemoglobin(Hb).CKD stage was determined by eGFR.Spearman′s rank correlation analysis was performed to find the association between 24-hour urinary protein level and Hb.Univariate Logistic regression analysis and multivariate Logistic regression analysis were performed to determine the factors which have associations with anemia.ORs for anemia stratified by the joint distribution of 24-hour urinary protein level and CKD stage were calculated,when groups CKD 1 and A1 as the reference groups.Results Of the participants,there were 325(37.5%) with anemia.Hb level and incidence of anemia differed significantly between the groups(P<0.05),while anemia type did not(P>0.05).Spearman′s rank correlation analysis demonstrated that 24-hour urinary protein level was negatively correlated with Hb level(P<0.05).Univariate Logistic regression analysis showed that sex,age,systolic blood pressure and primary disease,CKD stage,treatment with ACEI/ARB agents,hypertension prevalence,diabetes prevalence,cardiovascular disease prevalence,serum albumin,calcium,phosphorus,transferrin saturation,ferritin,folic acid,vitamin B12(VitB12),and 24-hour urinary protein level were associated factors for anemia in CKD patients(P<0.05).Multivariate Logistic regression analysis showed that sex,age,primary disease,CKD stage,serum calcium,transferrin saturation,ferritin,folic acid,VitB12,and 24-hour urinary protein level were significantly associated with anemia in CKD patients or non-diabetic nephropathy patients(P<0.05).IncreasedORswere observed in joint-distributed groups with higher 24-hour urinary protein level and CKD stage compared with the reference groups A1 and CKD 1(ORswere 1.437~59.108).Conclusion The present study showed that the 24-hour urinary protein level was independently associated with anemia in patients with CKD,and increased urinary protein level indicated higher risk of anemia.
Kidney diseases;Anemia;Proteinuria
国家自然科学基金资助项目(81570617、81500516)
R 692 R 552
A
10.3969/j.issn.1007-9572.2017.22.011
2017-03-09;
2017-06-19)
430060 湖北省武汉市,武汉大学人民医院肾内科
*通信作者:丁国华,主任医师,博士生导师;E-mail:ghxding@gmail.com

