诱导化疗联合同步放化疗与单纯同步放化疗分别治疗局部晚期头颈部肿瘤的系统评价Δ
魏 佳,化怡纯,尚 昆,戴 岩,俞 静
(首都医科大学附属北京友谊医院肿瘤中心,北京 100050)
诱导化疗联合同步放化疗与单纯同步放化疗分别治疗局部晚期头颈部肿瘤的系统评价Δ
魏 佳*,化怡纯,尚 昆,戴 岩,俞 静#
(首都医科大学附属北京友谊医院肿瘤中心,北京 100050)
目的:系统评价诱导化疗(induction chemotherapy,IC)联合同步放化疗(concurrent chemoradiotherapy,CCRT)与单纯CCRT分别治疗局部晚期头颈部肿瘤的疗效与安全性。方法:计算机检索PubMed、Embase、维普数据库、中国期刊全文数据库、万方资源数据库中相关文献,纳入符合标准的随机对照研究,采用Revman 5.0软件进行文献荟萃(Meta)分析。结果:共纳入8篇文献,共1 376例头颈部肿瘤患者。Meta分析结果显示,疗效方面,IC+CCRT组与CCRT组患者的中位无进展生存期(HR=0.90,95%CI=0.75~1.09,P=0.27)、中位总生存期(HR=1.01,95%CI=0.82~1.24,P=0.95)、客观缓解率(OR=1.03,P=0.89)、疾病控制率(OR=1.12,P=0.63)的差异均无统计学意义。安全性方面,IC+CCRT组患者Ⅲ级及以上不良反应发生率明显高于CCRT组,差异有统计学意义(P<0.05)。结论:与单纯CCRT相比,IC联合CCRT在延长晚期头颈部恶性肿瘤患者的生存期和提高总缓解率方面均未显示出足够的优势,反而增加了Ⅲ级及以上不良反应的发生。
头颈部肿瘤; 诱导化疗; 同步放化疗; Meta分析
头颈部恶性肿瘤是全球范围内第6大最常见的恶性肿瘤之一,其患者数约占恶性肿瘤患者数的8%,包括从颅底到锁骨上、颈椎前这一解剖范围内的所有恶性肿瘤。头颈部解剖结构复杂,包含重要器官,其恶性肿瘤组织类型繁多,90%的病理类型为鳞癌,对放射线敏感。随着治疗方式的不断改进,手术及放疗对早期头颈部鳞癌的疗效显著,但70%~80%的患者在就诊时已处于局部晚期或发生远处转移,失去手术机会,对于这部分患者目前的标准治疗为同步放化疗(concurrent chemoradiotherapy,CCRT),但其无病生存及总生存并未得到较大改善[1]。20世纪80年代,美国提出诱导化疗(induction chemotherapy,IC)的概念,即放疗前使用化疗,其优点是可在短时间内减少肿瘤负荷,并减轻由肿瘤导致的各种临床症状,改善局部组织血供,从而提高放疗敏感性,同时,对亚临床转移灶也有一定的抑制作用。因此,IC能提高局部晚期恶性肿瘤患者的局部缓解率并减少远处转移的发生。但是否能将IC与CCRT联合应用以改善头颈部恶性肿瘤患者的预后,目前尚存在争议。因此,本研究收集国内外相关的临床随机对照试验(randomized controlled trial,RCT)进行文献荟萃(Meta)分析,系统比较IC联合CCRT与单纯CCRT等两种治疗方法对局部晚期头颈部肿瘤的疗效与安全性,为临床治疗提供数据支持。
1 资料与方法
1.1 检索策略
检索以中文或英文发表的含有IC+CCRT/CCRT治疗方案的RCT。计算机全面检索PubMed、Embase、Cochrane 图书馆、中国期刊全文数据库(CNKI)、维普数据库(VIP)及万方数据库等,检索时间范围均为建库至2017年1月31日;同时手工检索纳入文献的参考文献作为补充。英文检索式为“[(head and neck cancer)OR(head and neck carcinoma)OR(nasopharyngeal cancer)OR(oral cancer)OR(hypopharyngeal cancer)OR(laryngeal cancer)]AND[(induction chemotherapy)OR(neoadjuvant chemotherapy)OR(concurrent chemora-diotherapy)]AND [(Randomized Controlled Trials)OR(Random*)]”;中文检索式为“(头颈部肿瘤or鼻咽癌or下咽癌or喉癌or口腔癌)and(新辅助化疗or诱导化疗or同步放化疗)”。
1.2 文献纳入与排除标准
纳入标准:结局变量,包括晚期头颈部肿瘤总生存期(overall survival,OS)、无进展生存期(progression-free survival,PFS)、客观缓解率(objective response rate,ORR)、疾病控制率(disease control rate,DCR);文献中OS及PFS通过风险比(hazard ratio,HR)及其95%可信区间(confidence interval,CI)提取,ORR及DCR通过相对危险度(odds ratio,OR)及其95%CI提取;文献均为已发表的临床RCT,排除非RCT及主要观察指标不全或缺失的文献。
1.3 纳入文献的质量评价
采用Jadad质量计分法对纳入文献进行评价。(1)随机分组序列的产生方法:正确的随机分配方法为2分;试验提到随机但未交待具体方法为1分;半随机或准随机试验为0分。(2)双盲法:描述具体的双盲实施方法为2分;仅提及采用双盲法为1分;未使用或双盲方法不当为0分。(3)退出与失访:详细描述随访过程中失访或退出研究的病例数、时间及原因为1分;无上述失访的相关记录为0分。总评分1~5分,≥3分为高质量研究,1~2分为低质量研究。
1.4 统计学方法
对采集的数据采用RevMan 5.3软件进行系统评价分析,采用HR及其95%CI作为OS及PFS的效应分析统计量,部分文献通过Engauge Digitizer 4.1软件提取出HR;OR及其95%CI作为ORR及DCR的效应分析统计量。纳入文献的数据采用Q检验进行异质性检验,以I2评价异质性大小,检验水准α=0.05。若I2<50%,说明各研究间无统计学异质性,采用固定效应模型计算合并效应量;若I2≥50%,则说明各研究间有统计学异质性,采用随机效应模型进行Meta分析。最终系统评价的结果以森林图阐述。
2 结果
2.1 纳入文献的基本特征与质量评价
共检索出605篇文献,通过阅读文献题目及摘要排除明显不相关的文献后,对剩余54篇文献进行全文阅读。排除非RCT、综述性文献及主要观察指标不全或缺失等文献,最终纳入8篇RCT,共1 376例患者。所有纳入的研究均为RCT,8篇文献[2-9]提及随机分组;0篇文献提及采用双盲法;8篇文献[2-9]报道了失访数及全部试验结果,并详细描述了纳入对象的基本信息、干预措施、主要结局指标及相关统计学方法。4篇文献为高质量研究[2,4,7-8],4篇文献[3,5-6,9]为低质量研究。文献检索流程见图1;纳入文献的基本特征见表1。
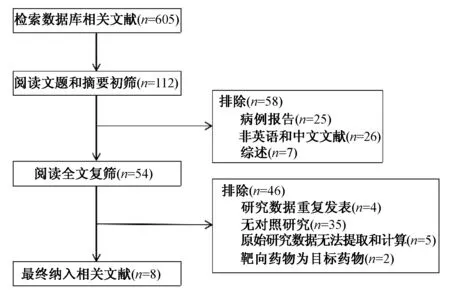
图1 文献检索流程Fig 1 General characteristics of included literatures
2.2 Meta分析结果
2.2.1 PFS及OS:(1)2篇文献[5-6]报道了中位PFS(P>0.05,I2=0%),3篇文献[2,7,9]报道了3年PFS(P>0.05,I2=30%),各研究间无统计学异质性,故采用固定效应模型进行Meta分析。结果显示,IC联合CCRT组与单纯CCRT组患者中位PFS(HR=0.90,95%CI=0.75~1.09,P=0.27)、3年PFS(HR=0.97,95%CI=0.68~1.39,P=0.88)的差异均无统计学意义,见图2。(2)3篇文献[3,5-6]报道了中位OS,3篇文献[2,7,9]报道了3年OS,各研究间无统计学异质性(P>0.05,I2=0%),故采用固定效应模型进行Meta分析。结果显示,IC联合CCRT组与单纯CCRT组患者中位OS(HR=1.01,95%CI=0.82~1.24,P=0.95)、3年OS(HR=0.94,95%CI=0.65~1.35,P=0.72)的差异均无统计学意义,见图2。提示IC联合CCRT方案并不能降低局部晚期头颈部恶性肿瘤患者的疾病进展风险,不能使患者获得生存获益。
2.2.2 ORR及DCR:4篇文献[2-3,6,9]报道了ORR以及DCR,各研究间无统计学异质性,故采用固定效应模型进行Meta分析。结果显示,IC联合CCRT组与单纯CCRT组患者ORR(OR=1.03,95%CI=0.69~1.53,P=0.89)、DCR(OR=1.12,95%CI=0.70~1.80,P=0.63)的差异均无统计学意义;两组患者部分缓解(partial remission,PR)率(OR=0.503,95%CI=0.21~1.37,P=0.19)、完全缓解(complete remission,CR)率(OR=1.87,95%CI=0.69~5.06,P=0.22)的差异均无统计学意义,见图3。
2.2.3 安全性:本研究仅对各文献报道的Ⅲ级及以上不良反应进行Meta分析,包括呕吐、中性粒细胞减少症、血小板减少症等。结果显示,比单纯CCRT组患者比较,IC+CCRT组患者的呕吐发生率明显降低(OR=0.35,95%CI=0.15~0.81,P=0.01),但中性粒细胞减少症发生率(OR=1.53,95%CI=1.04~2.25,P=0.03)、血小板减少症发生率(OR=4.07,95%CI=2.08~7.96,P<0.000 1)明显升高;两组患者恶心(OR=1.05,95%CI=0.51~2.16,P=0.90)、口腔黏膜炎(OR=1.66,95%CI=0.98~2.64,P=0.06]、白细胞减少症(OR=0.85,95%CI=0.55-1.31,P=0.46)、乏力(OR=1.76,95%CI=0.37~8.48,P=0.48)、肾功能不全(OR=0.64,95%CI=0.28~1.48,P=0.30)、贫血(OR=1.64,95%CI=0.83~3.23,P=0.15)、皮疹(OR=1.29,95%CI=0.79~2.11,P=0.31)等不良反应发生率的差异均无统计学意义,见表2。

表1 纳入文献的基本特征

A. 中位PFS;B.3年PFS;C.中位OS;D.3年OSA.median PFS;B.three-year PFS;C.median OS;D.three-year OS图2 两组患者PFS、OS比较的Meta分析森林图Fig 2 Comparison of Meta-analysis forest of PFS, OS between two groups
2.3 发表偏倚
采取总缓解率指标相关数据绘制漏斗图。结果显示,样本量小的数据位于漏斗图底部,但各散点基本对称分布于中线两侧,提示本Meta分析的结果偏倚可能性较小,见图4。
3 讨论
头颈部集中了许多重要器官,管理着视觉、听觉、嗅觉、思维、呼吸、发声与进食等重要的生理功能,在相当狭小的空间内集中着较多的肌肉、骨骼、血管和神经,各器官部位交错,一旦发现肿瘤,很难达到根治性切除[10]。CCRT因能保留器官功能而成为局部晚期头颈部恶性肿瘤常选择的治疗方案。近年来,越来越多的学者尝试在CCRT方案基础上联合IC来进一步改善局部晚期头颈部恶性肿瘤患者的局部控制率和生存存情况[6,11-12]。目前,国际上公认的标准治疗为CCRT,而与单纯CCRT相比,IC联合CCRT是否能改善患者的生存、选用何种化疗药为最优,则是临床亟待解决的重要问题。
DECIDE研究[13]结果显示,IC联合CCRT治疗后,头颈部恶性肿瘤患者的CR率为8.8%,PR率为55.3%,有改善患者总生存情况的趋势,但差异无统计学意义。谢亚琳等[14]对59例IC联合CCRT治疗的局部中晚期鼻咽癌患者进行研究,结果显示,ORR为76.7%~79.3%,中位OS可达到39.4个月,中位PFS可达到12.7个月,不良反应主要包括血液学毒性、消化道反应、脱发、外周神经毒性及肾毒性,大多数患者的不良反应为Ⅰ/Ⅱ级,经对症处理后,患者均能耐受且能按期完成治疗,提示局部中晚期鼻咽癌患者能从IC联合CCRT治疗中获益。本次Meta分析结果显示,IC+CCRT组与单纯CCRT组患者在OS、PFS及DCR、ORR等结局指标方面的差异均无统计学意义(P>0.05)。在不良反应方面,与单纯CCRT组比较,IC+CCRT组患者Ⅲ级及以上血小板减少症和中性粒细胞减少症的发生率明显升高(P<0.05),但Ⅲ级及以上呕吐的发生率明显降低(P<0.05);两组患者其余不良反应发生率的差异均无统计学意义(P>0.05)。提示与单纯CCRT比较,IC联合CCRT治疗并不能使局部晚期头颈部恶性肿瘤患者获得生存获益,并且增加了Ⅲ级及以上不良反应的发生概率,临床上应谨慎选择。

A.总缓解率;B.部分缓解率;C.完全缓解率;D.疾病控制率A.overall remission rate;B.partial remission rate;C.complete remission rate;D.disease control rate图3 两组患者缓解率、疾病控制率比较的Meta分析森林图Fig 3 Comparison of Meta-analysis forest of remission rate and disease control rate between two groups

不良反应文献数/篇IC+CCRT组(n/N)CCRT组(n/N)效应模型OR(95%CI)P恶心319/34414/240固定效应1.05(0.51~2.16)0.90呕吐29/30615/204固定效应0.35(0.15~0.81)0.01中性粒细胞减少症593/43948/344固定效应1.53(1.04~2.25)0.03口腔黏膜炎6212/461118/369随机效应1.66(0.98~2.64)0.06白细胞减少症469/23075/229固定效应0.85(0.55~1.31)0.46血小板减少症540/32511/340固定效应4.07(2.08~7.96)<0.0001乏力327/35210/251随机效应1.76(0.37~8.48)0.48肾功能不全311/28514/187固定效应0.64(0.28~1.48)0.30贫血626/47713/380固定效应1.64(0.83~3.23)0.15皮疹548/44230/336固定效应1.29(0.79~2.11)0.31

图4 总缓解率的倒漏斗图Fig 4 Funnel plot of overall remission rate
但本研究存在一定的局限性:(1)入组的部分临床试验未提供HR,本研究通过Engauge Digitizer软件提取的HR可能存在偏倚;(2)头颈部恶性肿瘤的类型较多,某些类型对于IC的反应可能较差,从而影响最终的临床结局指标;(3)本研究纳入的文献所采用的IC与CCRT中的化疗方案有所不同,各研究间存在统计学异质性,但因纳入的文献有限,无法进行分层及亚组分析,从而影响最终结果。因此,还需要临床进一步开展大规模、高质量的RCT,以进一步验证两种治疗模式的疗效差异及安全性。
[1]Bourhis J,Le Matre A,Baujat B,et al.Individual patients’ data meta-analyses in head and neck cancer[J].Curr Opin Oncol,2007,19(3):188-194.
[2]Takácsi-Nagy Z,Hitre E,Remenár É,et al.Docetaxel,cisplatin and 5-fluorouracil induction chemotherapy followed by chemoradio-therapy or chemoradiotherapy alone in stage Ⅲ-Ⅳ unresectable head and neck cancer:Results of a randomized phase Ⅱ study[J].Strah-lenther Onkol,2015,191(8):635-641.
[3]Cohen EE,Karrison TG,Kocherginsky M,et al.Phase Ⅲ andomized trial of iduction chemotherapy in patients with N2 or N3 locally advanced head and neck cancer[J].J Clin Oncol,2014,32(25):2735-2743.
[4]Tan T,Lim WT,Fong KW,et al.Concurrent chemo-radiation with or without induction gemcitabine, Carboplatin, and Paclitaxel: a randomized, phase 2/3 trial in locally advanced nasopharyngeal carcinoma[J].Int J Radiat Oncol Biol Phys,2015,91(5):952-960.
[5]Hitt R,Grau JJ,López-Pousa A,et al.A randomized phase Ⅲ trial comparing induction chemotherapy followed by chemoradiotherapy versus chemoradiotherapy alone as treatment of unresectable head and neck cancer[J].Ann Oncol,2014,25(1):216-225.
[6]Paccagnella A,Ghi MG,Loreggian L,et al.Concomitant chemor-adiotherapy versus induction docetaxel,cisplatin and 5 fluoro-uracil(TPF)followed by concomitant chemoradiotherapy in locally advanced head and neck cancer:a phase Ⅱ randomized study[J].Ann Oncol,2010,21(7):1515-1522.
[7]Haddad R,O’Neill A,Rabinowits G,et al.Induction chemotherapy followed by concurrent chemoradiotherapy(sequential chemoradio-therapy)versus concurrent chemoradiotherapy alone in locally adva-nced head and neck cancer(PARADIGM):a rando-mised phase 3 trial[J].Lancet Oncol,2013,14(3):257-264.
[8]贺秋冬,杨立,聂跃华,等.新辅助化疗加同步放化疗治疗局部晚期鼻咽癌的Ⅱ期临床研究[J].临床肿瘤学杂志,2009,14(11):1011-1014.
[9]陈建武,张幸平,郑建清,等.诱导化疗联合同步放化疗治疗局部晚期头颈部鳞癌的随机对照研究[J].重庆医科大学学报,2011,36(9):1103-1106.
[10] Jemal A,Siegel R,Ward E,et al.Cancer Statistics,2006[J].CA Cancer J Clin,2006,56(2):106-130.
[11] Paccagnella A,Mastromauro C,D’Amanzo P,et al.Induction chemo-therapy before chemoradiotherapy in locally advanced head and neck cancer:the future?[J].Oncologist,2010,15(suppl 3):8-12.
[12] Fountzilas G,Bamias A,Kalogera-Fountzila A,et al.Induction chem-otherapy with docetaxel and cisplatin followed by concomitant chem-oradiotherapy in patients with inoperable non-nasopharyngeal carcin-oma of the head and neck[J].Anticancer Res,2009,29(2):529-538.
[13] Cohen EEW,Karrison T,Kocherginsky M,et al.DeCIDE:a phase Ⅱ randomized trial of docetaxel(D),cisplatin(P),5-fluorouracil(F)(TPF) induction chemotherapy(IC) in patients with N2/N3 locally advanced squamous cell carcinoma of the head and neck(SCCHN)[J].J Clin Oncol,2012,30(15 Suppl):5500.
[14] 谢亚琳,谢剑明.TP方案诱导化疗序贯同期放化疗治疗局部晚期鼻咽癌的临床观察[J].临床肿瘤学杂志,2015,20(2):160-163.
Meta-analysis on Induction Chemotherapy Combined with Concurrent Chemotherapy and Concurrent Chemoradiotherapy Alone in Treatment of Locally Advanced Head and Neck CancerΔ
WEI Jia, HUA Yichun, SHANG Kun, DAI Yan, YU Jing
(Cancer Center, Beijing Friendship Hospital,Capital Medical University,Beijing 100050, China)
OBJECTIVE:To systematically evaluate the efficacy and safety of induction chemotherapy (IC) combined with concurrent chemotherapy(CCRT) and CCRT alone in treatment of locally advanced head and neck cancer. METHODS: Relevant randomized controlled trials from Pubmed, Embase, VIP, CNKI, Wanfang data base were retrieved by computers, RevMan 5.0 software was adopted to conducted on Meta-analysis. RESULTS: Totally 8 literatures were involved, including 1 376 cases of head and neck cancer patients. According to Meta-analysis, for efficacy, there was no statistically significant difference between IC+CCRT group and CCRT group in median progression free survival (HR=0.90,95%CI=0.75-1.09,P=0.27), median overall survival (HR=1.01,95%CI=0.82-1.24,P=0.95), objective remission rate(OR=1.03,P=0.89)and disease control rate(OR=1.12,P=0.63). In terms of safety, the incidence of adverse drug reactions in IC+CCRT group was higher than that in CCRT group, with statistically significant difference (P<0.05). CONCLUSIONS: Compared with CCRT alone, IC combined with CCRT shows sufficient advantages in prolong survival time and increase total remission rate of advanced head and neck cancer, and increases the incidence of adverse drug reactions of third-level or above.
Head and neck cancer; Induction chemotherapy; Concurrent chemoradiotherapy; Meta analysis
国家自然科学基金(No.81101737);北京市“215”高层次卫生人才资助项目(No.2014-3-004)
R979.1
A
1672-2124(2017)07-0872-05
2017-04-05)
*硕士研究生。研究方向:恶性肿瘤的综合治疗。E-mail:1760131992@qq.com
#通信作者:副主任医师。研究方向:恶性肿瘤的综合治疗。E-mail:yujing026@ccmu.edu.cn
DOI 10.14009/j.issn.1672-2124.2017.07.003

