羊奇异变形杆菌的分离鉴定及药敏试验
谢秀兰,黎 帅,马小明,康晓冬,高海慧,李颖康*
(1.宁夏农林科学院动物科学研究所,宁夏银川 750002;2.宁夏大学新华学院,宁夏银川 750021)
羊奇异变形杆菌的分离鉴定及药敏试验
谢秀兰1,黎 帅2,马小明1,康晓冬1,高海慧1,李颖康1*
(1.宁夏农林科学院动物科学研究所,宁夏银川 750002;2.宁夏大学新华学院,宁夏银川 750021)
为查明宁夏地区某羊场羔羊腹泻的发病原因并选择敏感药物用于治疗,从患病羔羊粪便中分离出4 株细菌,进行形态特征、培养特性、16 S rRNA测序、VITEK微生物鉴定系统鉴定、致病性试验及药敏试验。结果显示,分离菌为奇异变形杆菌。动物试验表明,4 株奇异变形杆菌对小鼠具有很强的致病性。药敏试验表明,4 株奇异变形杆菌对氨基糖甙类抗生素(阿米卡星、卡那霉素、链霉素)、氟苯尼考及头孢菌素类抗生素敏感,而对大环内酯类(红霉素和克林霉素)、复方新诺明、恩诺沙星全部耐药。对青霉素类(哌拉西林、氨苄西林、阿莫西林)、喹诺酮类(环丙沙星、氧氟沙星、诺氟沙星)、四环素、万古霉素、庆大霉素呈现不同程度的耐药。结果表明,该4 株奇异变形杆菌具有较强的致病力和多重耐药性,可能是此次羔羊腹泻的致病菌,治疗首选氨基糖甙类、氟苯尼考及头孢菌素类抗生素。
羔羊腹泻;奇异变形杆菌;分离鉴定;药敏试验
奇异变形杆菌(Proteusmirabilis,PM)是营腐生的人畜共患病原菌,也是一种引起多种动物患病的条件致病菌,广泛存在于自然环境及人和动物的肠道中,在人类可引起食物中毒、腹泻、菌血症、尿道炎及呼吸道感染等[1-5]。在动物上,近年来不断有奇异变形杆菌感染畜禽和水生动物,引起消化道、呼吸道、泌尿生殖道及体表溃烂等并致死的报道,给畜禽养殖带来巨大的经济损失[5-13]。奇异变形杆菌作为人畜共患传染病病原,在肉羊养殖过程中引起的疫情频频发生[14-20],在给养殖场带来巨大的经济损失的同时也存在感染人的风险,应引起足够的重视。2015年初,宁夏盐池、平罗两家规模化养羊场的羔羊发生腹泻为主要症状的疾病,经对粪便中的细菌进行分离培养、微生物鉴定、致病性及药敏性试验,以指导临床生产,具体报道如下。
1 材料与方法
1.1 材料
1.1.1 样本 发生腹泻的4只羔羊的粪便肛拭子,采自宁夏盐池、平罗两地羊场。
1.1.2 实验动物 SPF级ISR小鼠14只,体重18 g~22 g,购自宁夏医科大学实验动物中心。
1.1.3 试剂与仪器 药敏纸片,杭州天和微生物试剂有限公司产品;2×TaqPCR MasterMix、DNA Marker DL 2 000、细菌基因组DNA提取试剂盒,天根生化科技(北京)有限公司产品;营养琼脂、SS培养基、伊红美蓝、LB肉汤培养基等培养基,青岛海博生物技术有限公司产品;VITEK 2革兰阴性细菌鉴定卡、梅里埃VITEK 2 Compact 全自动细菌鉴定、药敏分析系统,法国梅里埃公司产品;电子比浊仪(DensiCHEK Plus),美国BioMerieux公司产品。
1.2 方法
1.2.1 病原分离 无菌操作,将肛拭子分别分区划线接种营养琼脂、SS琼脂、伊红美蓝琼脂平板,37 ℃培养18 h~24 h,观察菌落形态特征,挑取典型菌菌,接种营养琼脂、SS琼脂、伊红美蓝琼脂平板,纯化培养,并进一步进行细菌鉴定。取纯培养物涂片,革兰染色,观察细菌形态。
1.2.2 VITEK2 Compact的细菌鉴定 在灭菌的4.5 g/L 生理盐水中,加入菌液,电子比浊仪调整其浓度为0.5麦氏单位,插入革兰阴性细菌鉴定卡,应用VITEK2 Compact全自动微生物鉴定系统进行细菌鉴定。
1.2.3 细菌16 S rRNA鉴定 16 S rRNA基因扩增采用细菌通用引物,序列为:27F:AGAGTTTGATCMTGGCTCAG;1492R:GGTTACCTTGTTACGACTT;引物由上海生工生物工程技术服务有限公司合成。
提取纯化培养物DNA进行PCR扩增,PCR反应体系为25 μL,2×TaqPCR MasterMix 12.5 μL,上、下游引物(10 μmol/L)各1.0 μL,模板1.0 μL,ddH2O补足25 μL。PCR反应条件:95 ℃ 4 min;94℃ 30 s、56℃ 30 s、72℃ 30 s,35 个循环;72℃ 10 min。PCR产物送上海生工生物工程技术服务有限公司测序,将序列进行BLAST 比对分析,并与GenBank中PM 16S rRNA基因核苷酸序列进行同源性分析。
1.2.4 致病性试验 取健康小鼠14只,试验组每株3只,对照2只。取分离菌12 h肉汤培养物腹腔接种试验给小鼠,0.5 mL/只(约1.0×109CFU/mL),对照组腹腔注射0.5 mL生理盐水,隔离饲养,观察小鼠发病情况,并分离细菌。
1.2.5 药敏试验 用KB纸片扩散法进行药敏试验,吸取30 μL菌液,置于普通琼脂培养基中央,用涂布棒将菌液均匀涂于培养基表面,至菌液被完全吸收后,将不同的药敏片贴在培养基的适当位置。置于37℃培养箱中18 h~24 h,观察抑菌情况,判定依照NCCLS标准。
2 结果
2.1 病原分离
2015年12年~2016月1月,宁夏盐池、平罗两地羊场发生羔羊腹泻病,发病率低,约为5%,未发生死亡。病羊均为20日龄以内的羔羊,肛门周围沾染大量粪便,粪便呈黑色,质稀,无气泡,无出血,病羊精神较好。从患病羊粪便中分离出4株疑似奇异变形杆菌,分别命名为Q1、Q2、Q3及Q4。该4株菌在普通琼脂上长成圆形,中等大小,具明显的“迁徙生长”现象(图1A)。SS平板上为圆形,中等大小、无色半透明,菌落中央呈黑色(图1B)。革兰染色后检测可见革兰阴性,短小杆状细菌(图1C)。
2.2 VITEK2 Compact的细菌鉴定
经VITEK2 Compact全自动细菌鉴定仪鉴定,该4株细菌鉴定为奇异变形杆菌,置信度均为99%。
2.3 PCR扩增结果
以提取的分离菌基因为模板,用合成的通用引物扩增分离菌16 S rRNA基因,结果扩增出大小约为1 504 bp目的片段,与预期大小相符(图2)。同源性最高的序列均为PM各株系的16 S rRNA,其同源性均高达100%,证明P1~P4均为奇异变形杆菌。
2.4 动物试验
试验组小鼠在接种后1.5 h出现精神沉郁,食欲不振,接种后7 h,Q1、Q2及Q3均全部死亡,Q4有2只死亡,1只精神不振。对照组小鼠未见异常。剖检可见各脏器充血、出血、肿大,肝脏表面有弥漫性出血点,肠腔有气泡,肠腔内充盈黄色液体(图3)。从死亡小鼠的肝脏回收细菌经染色镜检并进行细菌培养和生化试验,结果与接种菌一致。
2.5 药敏试验
对22种常见抗生素药物中,4株奇异变形杆菌均对阿米卡星、氟苯尼考、卡那霉素、链霉素和头孢曲松、头孢拉定、头孢唑林、头孢噻肟、头孢氨苄抗生素敏感,而对红霉素和克林霉素、复方新诺明、恩诺沙星全部耐药。哌拉西林(2/4)、庆大霉素(3/4)、氨苄西林(3/4)、阿莫西林(3/4)、环丙沙星(3/4)、氧氟沙星(3/4)、诺氟沙星(3/4)、四环素(1/4)、万古霉素(1/4)为敏感,结果见表1。从表中可以看出,奇异变形杆菌具有多重耐药性,其中Q3对22种抗生素中的13种耐药,耐药性最为严重。

A.普通琼脂上生长现象;B.SS平板上生长现象;C.革兰染色后镜检(100×)A.Culturing on ordinary agar medium; B.Culturing on SS medium; C.Gram staining microscopy(100×)
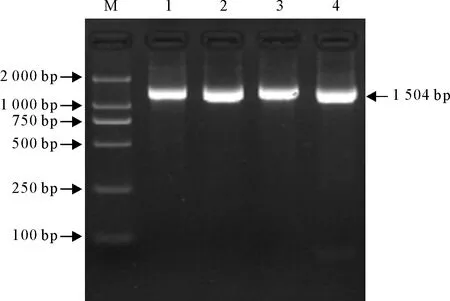
M.DNA标准DL 2 000;1~4.分离菌的16 S rRNA PCR产物
M.DNA Marker DL 2 000;1-4.16 S rRNA PCR products of isolates
图2 16 S rRNA PCR扩增结果
Fig.2 PCR amplification results of 16 S rRNA

A.肾脏出血,肿大;B.消化系统产气A.Hemorrhage and swelling of kidney; B.Aerogenesis of digestive system
图3 小鼠脏器病变
Fig.3 Pathological lesions of mouse organs
3 讨论
羊奇异变形杆菌病的报道较少,自黄炳坤等[14]1992年首次报道了该病以来,陆续有羊患奇异变形杆菌病的报道。该病目前发现可造成绵羊或山羊各年龄段(尤其是羔羊)的消化道、呼吸道疾病,既可单独感染发病[15-17],也可混合感染[14,18-20]。本项目从发生腹泻的羔羊粪便中分离到了奇异变形杆菌,经动物试验证实,PM是引起此次羔羊腹泻的病因。
奇形变异杆菌对临床常用的抗菌素极易产生耐药性[21-23],且耐药机制复杂,其中产β内酰胺酶是其耐药主要机制,其至少可以产生3种不同的β内酰胺酶,分别为超广谱β内酰胺酶、AmpC酶和金属β内酰胺酶,并且其耐药性存在一定的地域差异。黄炳坤等[14]从发病羊脏器中分离到21株PM,药敏试验发现,所分离菌株对多数药物的敏感性极低,16种药物中高度或中度敏感药物仅3种,12种药物为不敏感。汤继顺等[15]对腹泻羔羊粪便中分离的PM进行药敏试验,结果发现,PM对青霉素、链霉素、克拉霉素及强力霉素等基本无效。王豪举等[17]从发病山羊分离的PM药敏试验结果,PM对11种抗生素不敏感。在本试验中,4株PM对青霉素类(哌拉西林、氨苄西林、阿莫西林)、喹诺酮类(环丙沙星、氧氟沙星、诺氟沙星)、四环素、万古霉素及庆大霉素不同程度的耐药。4株奇异变形杆菌对磺胺等多种药物产生抗药性,显示出多重耐药性。其中Q3对22种抗生素中的13种表现耐药,表明耐药性已经很严重。在本试验中,4 株PM对阿米卡星、卡那霉素和氟苯尼考、头孢菌素类抗生素敏感,根据药敏试验结果,给发病羊用阿米卡星治疗,病羊很快痊愈。因此,在宁夏地区的生产实践中,我们推荐羊在发生变形杆菌性腹泻时,应优先使用大环内酯类、氟苯尼考及头孢菌素类抗生素治疗。

表1 药敏试验结果
注:R为耐药;I为中介;S为敏感。
Note:R.Resistant;I.Intermediate;S.Sensitive.
[1] 汪永禄,陶 勇,石志峰,等.安徽省马鞍山市腹泻患者变形杆菌感染状况的初步探讨[J].疾病监测,2009,24(5):337-339.
[2] 吴晓茹,周 华,杨 青,等.奇异变形杆菌耐药性及亚胺培南不敏感株感染的临床特点研究[J].中国微生态学杂志,2014,26(9):1035-1039.
[3] 林 靓,胡丽庆.尿液中奇异变形杆菌耐药性变迁及监测分析[J].中国微生态学杂志,2013,25(10):1192-1194.
[4] Trapman M,Van Ingen J,Keijman J,et al.Urinary tract infection caused by a capnophilicProteusmirabilisstrain[J].J Clin Microbiol,2015,53(6):1959-1960.
[5] Cabral A B,Maciel M A,Barros J F,et al.Detection of bla KPC-2 inProteusmirabilisin Brazil[J].Rev Soc Bras Med Trop,2015,48(1):94-95.
[6] 赵成坚,黄 勇,谷颖乐,等.银环蛇奇异变形杆菌的分离鉴定与药敏试验[J].动物医学进展,2013,34(12):213-217.
[7] 王旭荣,常瑞祥,王国庆,等.一株与奶牛关节脓肿相关的致病性奇异变形杆菌的分离与鉴定[J].动物医学进展,2013,34(9):118-121.
[8] 陈 武,陈足金,王建荣.奇异变形杆菌引发猕猴腹泻暴发流行的调查研究[J].动物医学进展,2004,25(2):115-116.
[9] 仝品芬,年朝琴,彭 超,等.致树鼩腹泻的奇异变形杆菌分离鉴定及药敏试验[J].实验动物科学,2014,31(1):41-44.
[10] 杨炳杰,苏伟桐,苏惠龙.断奶仔猪奇异变形杆菌病的诊治[J].中国兽药杂志,2008,42(7):57-58.
[11] 肖定汉,杨通广,李兰华,等.犊牛变形杆菌病[J].中国奶牛,2009(1):31-32.
[12] 段二珍,夏平安,张凤华,等.狐狸奇异变形杆菌的分离与鉴定[J].中国兽医科学,2008,38(12):1050-1054
[13] 周 芳,冉丹丹,刘 飞,等.鸡源奇异变形杆菌的分离鉴定与系统进化分析[J].动物医学进展,2015,36(7):29-32.
[14] 黄炳坤,谢德生,欧阳洪璧,等.绵羊变形杆菌病的研究[J].中国畜禽传染病,1992(5):15-18.
[15] 汤继顺,苏世广,朱德建,等.奇异变形杆菌性羊腹泻病原学分析及耐药性探讨[A]//2013中国羊业进展[C].2013:305-309.
[16] 崔国林,钟世勋,杨世发,等.山羊奇异变形杆菌分离鉴定及其16S-23S rRNA ISR序列RFLP分析[J].畜牧兽医学报,2013,44(6):919-924.
[17] 王豪举,倪 莉,杨红军,等.山羊奇异变形杆菌的分离鉴定及16S rDNA和ZapA基因的PCR-RFLP分析[J].中国兽医学报,2011,31(11):1594-1598.
[18] 刘国华,韩梅英,杨永信,等.小尾寒羊链球菌和变形杆菌混合感染的诊治[J].中国兽医杂志,2004,40(9):34-35.
[19] 陶 立,蓝显利,闭炳芬,等.羔羊奇异变形杆菌与支原体混合感染的诊断[J].中国畜禽种业,2014(12):104-106.
[20] 陈 曦,王远微,王 永,等.山羊腹泻粪便中奇异变形杆菌的分离鉴定及系统发育分析[J].中国畜牧兽医,2014,41(8):215-218.
[21] Yu W,He Z,Huang F,Multidrug-resistantProteusmirabilisisolated from newly weaned infant rhesus monkeys and ferrets[J].Jundishapur J Microbiol,2015,8(6):e16822. doi: 10.5812/jjm.
[22] Chen L,Laham N,Chavda K D,et al.First report of an OXA-48-producing multidrug-resistantProteusmirabilisstrain from Gaza,Palestine[J].Antimicrob agent Chemother,2015,59(7):4305-4307.
[23] Ryou S H,Bae J W,Baek H J,et al.Pulmonary pneumatocele in a pneumonia patient infected with extended-spectrum β-lactamase producingProteusmirabilis[J].Tuberc Respir Dis,2015,78(4):371-374.
Isolation,Identification and Drug Sensitivity Test ofProteusmirabilisfrom Lambs
XIE Xiu-lan1,LI Shuai2,MA Xiao-ming1,KANG Xiao-dong1,GAO Hai-hui1,LI Ying-kang1
(1.InstituteofAnimalScience,NingxiaAcademyofAgricultureandForestrySciences,Yinchuan,Ningxia,750002,China; 2.XinhuaCollege,NingxiaUniversity,Yinchuan,Ningxia,750021,China)
In order to identify the cause of diarrhea of lambs occurred in Ningxia area and choose sensitive drugs for treatment.4 strains of bacteria isolated from anal swabs,and then morphological characteristics,cultivation characteristics were observed,16S rRNA were sequenced,VITEK microbe identification and drug susceptibility were tested.The tests showed that 4 isolates wereP.mirabilis;Animal test indicated that 4P.mirabilishad high virulent;Drug susceptibility test showed that 4 isolates ofP.mirabiliswere sensitive to aminoglycosides antibiotics (amikacin,kanamycin,streptomycin),florfenicol and cephalosporin antibiotics;resistant to macrolide antibiotics (erythromycin and clindamycin),and CO-trimoxazole,enrofloxacin.Different degree of drug resistances presented in penicillins (piperacillin,ampicillin,amoxicillin),quinolones(ciprofloxacin,ofloxacin,norfloxacin),tetracycline,vancomycin and gentamicin.The results showed thatP.mirabiliswas the cause of lamb diarrhea and had high virulent and multiple drug resistance.Treatment preferred aminoglycosides antibiotics,florfenicol and cephalosporin antibiotics.
lamb diarrhea;Proteusmirabilis; isolation and identification; drug sensitivity test
2016-03-25
宁夏农林科学院先导基金项目(NKYJ-14-10)
谢秀兰(1980-),女,回族,宁夏平罗人,副研究员,硕士,主要从事动物病原分子生物学研究。*通讯作者
R378.99;S858.26
B
1007-5038(2017)07-0115-05

