初情期母牦牛下丘脑kiss-1/GPR54系统基因克隆
王志强,张洪波,张 君*,徐尚荣,彭 巍,杨启林
(1.青海大学农牧学院,青海西宁 810016,2.青海大学畜牧兽医科学院,青海西宁 810016)
初情期母牦牛下丘脑kiss-1/GPR54系统基因克隆
王志强1,张洪波2,张 君2*,徐尚荣2,彭 巍2,杨启林2
(1.青海大学农牧学院,青海西宁 810016,2.青海大学畜牧兽医科学院,青海西宁 810016)
应用聚合酶链反应和基因克隆技术,对10头初情期母牦牛下丘脑kiss-1/GPR54系统基因进行扩增和基因克隆。结果表明,kiss-1基因拼接后序列全长为291 bp,其中CDS序列长为282 bp,序列中碱基组分为腺嘌呤20.62%,鸟嘌呤27.14%,胸腺嘧啶23.37%,胞嘧啶28.87%。共编码95个氨基酸,其中丙氨酸占总氨基酸残基的11.58%,亮氨酸占10.52%,丝氨酸、甘氨酸、脯氨酸各占9.47%。GPR54基因拼接后序列全长为202 bp,其中CDS序列长为196 bp,序列中碱基组分为腺嘌呤16.34%,鸟嘌呤30.69%,胸腺嘧啶17.82%,胞嘧啶35.15%。GPR54基因共编码66个氨基酸,其中脯氨酸占总氨基酸残基的13.63%,甘氨酸、丝氨酸、丙氨酸各占10.60%,半胱氨酸占9.09%。
初情期母牦牛;kiss-1/GPR54系统;基因克隆
亲吻素(kisspeptins)是由kiss-1基因编码的一组多肽激素,与其受体GPR54一起组成kiss-1/GPR54系统[1],参与下丘脑-垂体-性腺(hypothalamic-pituitary-gonadal,HPG)的功能调控,并在动物初情期启动和促性腺激素释放过程中发挥作用。已有研究表明,下丘脑的kisspeptin与受体GPR54结合后,激活促性腺激素释放素(gonadotropin-releasing hormone,GnRH)神经元,刺激GnRH释放,进而促进促卵泡素(follicle-stimulating hormone,FSH)和促黄体素(luteotropic hormone,LH)的释放,调节生殖活动[2-3]。对大鼠的研究发现,kiss-1基因表达量随发情周期的不同阶段发生变化,其在排卵前显著升高,注射GnRH拮抗剂可抑制卵巢Kiss-1基因表达,而注射孕马血清(pregnant mare serum gonadotropin,PMSG)则可恢复Kiss-1 基因表达;此外,未成年大鼠卵巢上Kiss-1基因表达量极低,而给其注射PMSG和人体绒膜促性腺激素(human chorionic gonadotropin,HCG)后在诱导排卵的同时,显著提高了卵巢上Kiss-1基因的表达量[4],该结果说明kiss-1/GPR54系统对在动物发情周期中起到了调控作用。而作为哺乳动物初情期启动的诱导因子,许多动物kiss-1基因和GPR54基因的cDNA序列均被报道,但同源性相差较大,其中,人、鱼及牛蛙之间kiss-1基因同源性大于45%,人和刺猬的同源性大于20%。灵长类动物GPR54基因比啮齿类动物同源性大于80%[5]。说明了kiss-1/GPR54系统在进化过程中序列具有高度的保守性。牦牛属于季节性发情动物,由于受环境、管理等因素的影响,牦牛群体中普遍存在交配时间短、青年牦牛初情期延迟以及繁殖年龄推迟等现象。之前的研究中大部分针对牦牛的饲养管理、营养状况来研究影响牦牛发情的主要因素,而很少有从基因角度对牦牛繁殖进行探究,本试验基于kiss-1/GPR54系统在动物生殖过程中的启动作用,利用PCR、基因克隆技术,从基因同源性、氨基酸含量的角度分析牦牛kiss-1/GPR54系统基因差异,为解决牦牛繁殖率低的问题积累基础资料。
1 材料与方法
1.1 材料
1.1.1 试验用动物和材料 通过直肠检查和称量体重,于2015年9月在海晏县家庭牧场中采集初情期母牦牛10头。母牦牛宰杀后,立即采集下丘脑组织,经生理盐水、750 mL/L酒精、DEPC水冲洗后,液氮保存备用。
1.1.2 主要仪器 微波炉,广东格兰仕微波生活电器制造有限公司产品,型号:G70F20N3P-N3P(WO);高压蒸汽灭菌器,松下健康医疗器械株式会社产品,型号:MLS-3751L-PC;PS300B电泳仪,Hoefer公司产品,型号:DYY-8D;普通PCR仪,Biosystem产品;超纯水仪,德国默克集团 Milli-Q产品;凝胶成像仪,天美(中国)科学仪器有限公司产品,型号P/N97-0490-02;核酸蛋白仪,Thermo公司产品,型号Nanodrop 2000c;电冰箱,海尔公司产品,型号BCD-192KAZMD;振荡器,SciLOGEX产品,型号MX-F;电子天平,梅特勒-托利多仪器(上海)有限公司产品,型号:LE204E102;离心机,Eppendorf产品,型号5424R。
1.1.3 主要试剂 总RNA提取试剂盒、反转录试剂盒、PCR欲混试剂、胶回收试剂盒、DNA Marker、DH5α感受态细胞,北京天根生物有限公司产品;QX Separation buffer、QX DNA Dilution buffer、QX Wash buffer、QX mineral Oil、QX Ailgnment Marker (15 bp/1 kb)、QX Intensity Calibration Marker、QX size Marker(50 bp~80 bp),凯杰生物有限公司产品;pMDTM19-T Vector Cloning Kit,TaKaRa(日本)产品;TBE缓冲液,庄盟生物产品;琼脂糖,Biowest Agarose公司产品。
1.2 方法
1.2.1 总RNA提取及cDNA第1链合成
1.2.1.1 总RNA提取 根据试剂盒说明书进行,将提取后的RNA取5 μL经10 g/L琼脂糖凝胶电泳检测,电压:110V,时间:20 min。
1.2.1.2 cDNA第1链合成根据试剂盒说明书进行操作 其中cDNA第1链合成中gDNA去除反应体系为:5×g DNA buffer:2 μL,Total RNA:2 μL,RNase-Free ddH2O:6 μL。反转录反应体系:10×Fast RT buffer:2 μL,RT Enzyme Mix:1 μL,FQ-RT Primer Mix:2 μL,RNase-Free ddH2O:5 μL。将反转录反应中的Mix,加到gDNA去除步骤的反应液中,充分混匀后置于PCR仪中42℃,孵育15 min。95℃,孵育3 min之后放于冰上,得到的cDNA可用于后续试验,或低温保存。
1.2.2 PCR扩增与胶回收
1.2.2.1 PCR扩增引物 根据美国国家生物技术信息中心(national center for biotechnology information,NCBI)查询绵羊kiss-1及普通牛GPR54基因的mRNA序列(EU272411.1、XM 867473.4)设计PCR扩增引物,引物由上海生工生物工程技术服务有限公司合成,引物序列见表1。
1.2.2.2 PCR反应体系 反应体系为25 μL,其中:模板:3 μL,上、下游引物各1 μL,2×TapMix:13 μL,ddH2O:7 μL;PCR扩增反应条件:95℃ 3 min;95℃ 30 s,59.8℃ 30 s,72℃ 30 s,72℃ 5 min,4℃保存,反应为35个循环。
1.2.2.3 PCR产物检测 取5 μL PCR产物经10 g/ L琼脂糖凝胶电泳检测,电压:110 V,时间:20 min。

表1 PCR扩增引物序列
1.2.3 胶回收 根据试剂盒说明书进行操作,将胶回收产物进行10 g/L琼脂糖凝胶电泳检测。
1.2.4 连接、转化 (1)将Vector、InsertDNA、SolutionI冰上解冻。
(2)分别取Insert DNA 2 μL,Solution Ⅰ 2.5 μL,Vector 0.5 μL,加到微量离心管中。
(3)将微量离心管放在PCR仪中,16℃孵育1 h。
(4)将感受态细胞取出,冰上解冻至半溶化状态,立即将感受态细胞滴加到离心管中,每管滴加60 μL后冰上放置30 min。
(5)立即取出放置42℃水浴锅中放置90 s后取出冰上放置30 min。
(6)42℃水浴锅中水浴90 s后冰上放置2.5 min。
(7)将微量离心管内容物全部转移至1.5 mL无菌离心管中的690 μL液体培养基中。
(8)将离心管固定在摇床上,37℃振荡培养1 h。
(9)在含AMP的固体培养基上,分别涂布40 μL X-gal溶液和8 μL IPTG溶液,通风干燥5 min后将离心管在冷冻离心机中4℃、12 000 r/min离心3 min。
(10)弃上清液,将菌液均匀涂布到对应的平板上,通风干燥5 min。
(11)封口膜封口平板,37℃温箱中过夜。
(12)准备几管LB液体培养基,每管各1 mL(每mL液体培养基中加入2 μL 50 mg/mL的AMP)。
(13)用无菌枪头挑取单个阳性菌落(白斑),加入液体培养基中,37℃摇床振荡培养12 h,然后室温保存。
1.2.5 数据统计分析 Primer5.0用于PCR扩增引物设计,DNA Man用于同源性对比以及氨基酸序列翻译。
2 结果
2.1 发情期母牦牛下丘脑总RNA提取
结果显示,在28 s和18 s处有两条明显的条带,并且利用核酸蛋白仪检测OD 260 nm/OD 280 nm,结果在1.7~2.0之间,在正常范围内,结果可用(图1)。

M.DNA标准DL 2 000;1~3.总RNA提取
M.DNA Marker DL 2 000;1-3.The repeat for total RNA extracts
图1 总RNA提取结果
Fig.1 The results for total RNA extraction
2.2 PCR扩增结果
结果显示,kiss-1基因目的条带大小在301 bp,与引物设计结果相似。结果显示,GPR基因目的条带大小在230 bp,与引物设计结果一致(图2和图3)。
2.3 连接、转化结果
结果显示kiss-1基因片段大小约为300 bp左右,GPR54基因片段约为225 bp左右,该结果与PCR扩增结果基本一致(图4)。
2.4 kiss-1基因CDS序列及其编码的氨基酸序列
拼接kiss-1基因5′端及3′端测序结果,拼接后序列全长为291 bp,其中CDS序列长为282 bp,CDS序列中碱基组分为:腺嘌呤20.62%,鸟嘌呤27.14%,胸腺嘧啶23.37%,胞嘧啶28.87%。Kiss-1基因共编码95个氨基酸,其中丙氨酸占总氨基酸残基的11.58%,亮氨酸占10.52%,丝氨酸、甘氨酸、脯氨酸各占9.47%(图5)。
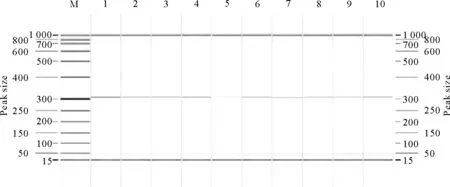
M.DNA标准DL 1 000;1~10.10头牦牛kiss-1基因M.DNA Marker DL 1 000;1-10.Ten female yak kiss-1 gene

M.DNA标准DL 1 000;1~10.10头牦牛GPR54基因M.DNA Marker DL 1 000;1-10.Ten female yak GPR54 gene

M.DNA标准DL 500;1~3.牦牛kiss-1基因; 4~6.牦牛GPR54基因
M.DNA Marker DL 500;1-3. Yak kiss-1 gene; 4-6.Yak kiss-1 gene
图4 初情期母牦牛kiss-1和GPR54基因克隆电泳图
Fig.4 The gene clone electrophoresis result of estrus female yak kiss-1 and GPR54 genes
2.5 GPR54基因CDS序列及其编码的氨基酸序列
拼接GPR54基因5′端及3′端测序结果,拼接后序列全长为202 bp,其中CDS序列长为196 bp,CDS序列中碱基组分为:腺嘌呤16.34%,鸟嘌呤30.69%,胸腺嘧啶17.82%,胞嘧啶35.15%。GPR54基因共编码66个氨基酸,其中脯氨酸占总氨基酸残基的13.63%,甘氨酸、丝氨酸、丙氨酸各占10.60%,半胱氨酸占9.09%(图6)。
3 讨论
3.1 初情期母牦牛kiss-1/GPR54基因同源性比较
荀文娟等[6]在Kiss-1/GPR54系统在不同发育阶段五指山猪下丘脑中的表达中发现五指山猪Kiss-1基因序列长度为179 bp、GPR54基因序列长度为115 bp。王雪松等[7]在Kiss-1/GPR54系统在雄性大鼠生殖轴系功能研究中发现Kiss-1基因长度为151 bp、GPR54为371 bp。研究结果与本研究获得的PCR产物大小相似。而张强等[8]在研究黑线仓鼠Kiss-1/GPR54系统在季节性繁殖与光周期调控中的作用中测出优化后的PCR策略拼接得到的Kiss-1序列为558 bp 。李卓昭[9]对梅山猪和LY母猪Kiss-1基因测序发现,Kiss-1基因序列总长为478 bp,GPR54基因为115 bp。而本试验中kiss-1基因测序总长度为299 bp,GPR54基因序列总长度为225 bp,上述结果均与本试验存在差异可能是不同动物种间存在差异所引起的。通过对同源性比较发现,本研究kiss-1序列与牛属、羊属动物的同源性均为100%(XM-867473.4、CP01187.1),而GPR54序列与牛属动物的同源性为98%(GO289736.1),与羊属动物的同源性为94%(GO142846.1),该结果与刘兴延等[10]对kisspeptin/GPR54系统与脊椎动物生殖的研究综述对比发现,牦牛、牛、羊的GPR54基因同源性与啮齿类、灵长类动物同源性较高,在80%左右,而与kiss-1基因同源性较低,该结果既表明GPR54基因在动物进化过程中高度的保守性,同时也推测影响青年牦牛初情期启动主要是由GPR54基因介导完成的。
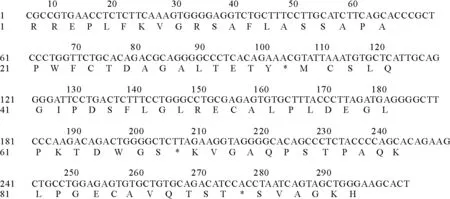
图5 kiss-1基因核苷酸序列及其编码的蛋白氨基酸序列
3.2 初情期母牦牛kiss-1基因编码氨基酸序列比较
人类的kiss-1基因位于染色体lq32-41区域由4个外显子和3个内含子组成,前2个外显子不翻译,第3个外显子是由38个非编码碱基对构成,后接转录起始位点和其余103个编码碱基对,第4个外显子中包含332 个编码碱基对、终止子和多腺苷酸化信号[11]。李卓昭[9]研究发现猪kiss-1基因全序列长度为860 bp,编码区长为417 bp(302-318),CDS区长度为478 bp,而本试验结果显示牦牛kiss-1基因序列全长为291 bp,其中CDS序列长为282 bp,CDS序列中碱基组分为:腺嘌呤20.62%,鸟嘌呤27.14%,胸腺嘧啶23.37%,胞嘧啶28.87%。共编码95个氨基酸,其中丙氨酸占总氨基酸残基的11.58%,亮氨酸占10.52%,丝氨酸、甘氨酸、脯氨酸各占9.47%。产生差异的主要原因是由于物种之间的差异所引起。Kiss-1的主要作用为,根据其水解后氨基酸链长度的不同可以分为Kisspeptin-54、Kisspeptin-14、Kisspeptin-13、Kisspeptin-10,统称为Kisspeptins,且这些片段的生物学功能和活性相似,结合受体后能发挥的主要生物学作用包括激活凝脂酶C,促进磷脂酰肌醇二磷酸水解,钙离子的动员,释放花生四烯酸,活化细胞外信号调节激酶1/2和p38激酶,形成张力丝,抑制细胞增殖等[12]。已有研究表明,给大鼠和人注射不同的 Kisspeptins 后均能提高LH和睾酮的分泌水平。因此推断,kiss-1基因可以明显促进动物生殖激素的分泌,从而调节后续的生殖过程。

图6 GPR54基因核苷酸序列及其编码的蛋白氨基酸序列
3.3 初情期母牦牛GPR54基因编码序列比较
GPR54(G protein-coupled receptor 54)是Kiss-1蛋白的受体,即GPR54的正常配体是由Kiss-1基因编码的[13]。直到发现它与Kisspeptin具有非常高的亲和力时才被重视和研究[1]。在2001年,人类GPR54基因被克隆,它包括1 197 bp的开放阅读框,编码含398个氨基酸残基的蛋白,Ishwar S P[14]克隆出罗比鱼的GPR54cDNA包含1个开放的阅读框,包含1 131个碱基对,编码377个氨基酸。本试验结果为GPR54基因序列全长为202 bp,其中CDS序列长为196 bp,CDS序列中碱基组分为腺嘌呤16.34%,鸟嘌呤30.69%,胸腺嘧啶17.82%,胞嘧啶35.15%。共编码66个氨基酸,其中脯氨酸占总氨基酸残基的13.63%,甘氨酸、丝氨酸、丙氨酸各占10.60%,半胱氨酸占9.09%。该结果与之前研究差异主要原因是由于物种之间的差异所引起的。GPR54作为kisspeptin的特异性受体,对kisspeptin功能的维持起着关键作用。研究表明,GPR54基因敲除会导致kisspeptin不能促进LH的分泌[15],这说明kisspeptin必须与GPR54结合后才能发挥其生物学作用、并且直接与LH的分泌有关。GPR54基因突变也可造成人或小鼠的特发性性腺激素分泌不足引起的兴县机能减退症(idiopathic hypogonadotropic hypogonadism,IHH),Cerrato F等[16]在研究沙特阿拉伯的一个工HH患者的家庭时发现,GPR54基因纯合子在第3外显子由C突变为T,导致从丝氨酸到亮氨酸的替(L1485);在一个有非洲和美洲血统的工HH患者身上发现第331个氨基酸上由C突变为T,导致一个提前出现的终止密码子(R331X,无义突变),以及第1 195个核普酸上出现由T到A的突变,导致精氨酸取代了1个终止密码(X399R,终止密码突变)。说明,GPR54基因,对于动物发情调控起到决定性作用。
Kiss-1/GPR54系统作为哺乳动物初情期启动的关键,它的分泌直接刺激下丘脑GnRH神经元,引起GnRH的分泌及后续HPG轴的调控,因此研究Kiss-1/GPR54系统对解决牦牛繁殖率低有积极的作用。本次试验发现初情期母牦牛下丘脑kiss-1序列与牛属、羊属动物的相似度均为100%(XM-867473.4、CP01187.1)。而GPR54序列与牛属动物的同源性为98%(GO289736.1)与羊属动物的同源性为94%(GO142846.1),由此结果可以推测,kiss-1/GPR54系统中影响青年动物初情期启动的关键基因是GPR54基因,因为kiss-1基因在亲缘性较近的动物中序列相同,而GPR54基因则有一些变化。氨基酸之间的差异目前研究较少,但主要还是与基因序列的差异有明显的关系。关于氨基酸所占比例及基因表达量是否参与激素调控,有待进一步研究。
[1] 冯 涛,储明星,张英杰.kiss-1/GPR54基因及其在生殖中的作用[J],遗传,2008,30(4):419-425.
[2] Jiang Tao,Zhang Shulan.Progress in research on correlation between kiss-1 and metastasis of cancer[J].Chinese J Maternal Child Health Res,2003,14(6):437-439.
[3] Gan Xiaohong,Hong Huazhu,Xiao Junhua.The role of GPR54 and its ligand in human puberty[J].Int J Endocr Metab,2006,26(6):424-426.
[4] 赵 静,王 军.kiss-1/GPR54系统在卵巢中的表达及功能研究进展[J].中国畜牧杂志,2014,50(21):82-84.
[5] Juan R,Manuel T S.KISS-1 system and reproduction:comparative aspects and roles in the control of female gonadotropic axis in mammals[J].Gen Comp Endocrinol,2007,539(1):132-140.
[6] 荀文娟,侯冠彧,周汉林,等.Kiss-1/GPR54系统在不同发育阶段五指山猪下丘脑中的表达[J].家畜生态学报,2014,35(2):11-14.
[7] 王雪松.Kiss-1/GPR54系统在雄性生殖轴系功能研究[D].江苏江苏:南京医科大学,2007:25-30.
[8] 张 强.黑线仓鼠Kiss-1/GPR54系统在季节性繁殖与光周期调控中的作用[D].山东曲阜:曲阜师范大学,2013:30-34.
[9] 李卓昭.不同品种猪繁殖轴Kiss-1/GPR54表达差异及能量水平对母猪初情日龄的影响[D].四川成都::四川农业大学,2010:27-32.
[10] 刘兴延,李 昂,连森阳.kisspeptin/GPR54系统与脊椎动物生殖[J].中国畜牧杂志,2013,49(13):86-90.
[11] 贺 明.kisspeptin在牛卵巢卵母细胞体外成熟过程中的表达和功能研究[D].吉林长春:吉林农业大学,2015.
[12] Heather M D,Donald K C,Robert A S.Kisspeptin neurons as central processors in the regulation of gonadotropin releasing hormone secretion[J].Endocrinology,2006,147(3):1154-1158.
[13] Cerrato F,Seminara S B.Human genetics of GPR54[J].Rev Endocr Metab Disord,2007,8:47-55.
[14] Ishwar S P.GnRH and gpcr:laser-captured single cell gene profiling[J].Fish Physiol Biochem,2005,31:153-156.
[15] Tena-Sempere M.GPR54 and kisspeptin in reproduction [J].Human Reproduction Update,2006,12(5):631-639.
[16] Cerrato F,Seminara S B.Human genetics of GPR54[J].Rev Endocr Metab Disord,2007,8:47-55.
Hypothalamus Kiss-1/GPR54 System Gene Clone For Purberal Female Yaks
WANG Zhi-qiang1,ZHANG Hong-bo2,ZHANG Jun2, XU Shang-rong2,PENG Wei2,YANG Qi-lin2
(1.AcademyofAgricultureandAnimalHuabandry,QinghaiUniversity,Xining,Qinghai,810016,China; 2.QinghaiAcademyofAnimalScienceandVeterinaryMedicine,QinghaiUniversity,Xining,Qinghai,810016,China)
The aim of the study was to detect hypothalamus kiss-1/GPR54 gene in ten purberal female yaks by using PCR and gene cloning techniques.The result indicated that,kiss-1 gene sequence was 291 bp,CDS was 282 bp,CDS base components were adenine 20.62%,guanine 27.14%,thymine 23.37%,cytosine 28.87%.95 amino acids were coded,alanine accounted 11.58% for total amino acids,leucine 10.52%,serine,glycine and proline 9.47%.GPR54 gene was 202 bp,CDS was 196 bp,CDS base components were adenine 16.34%,guanine30.69%,thymine 17.82%,cytosine 35.15%. 66 amino acids were coded,proline accounted 13.63% for total amino acids,glycine,serine and adenine 10.60%,serine,cysteine 9.09%.
purberal female yak; kiss-1/GPR54 system; gene clone
2016-11-14
青海省科技厅项目(2012-N-A5)
王志强(1991-),男, 青海西宁人,硕士研究生,主要从事高原畜禽生理研究。*通讯作者
R363;S823.85
A
1007-5038(2017)07-0031-06

