猪源大肠埃希菌磺胺类药物主要耐药基因的检测与分析
曹明慧,赵凤菊
(1.中国兽医药品监察所,北京 100000;2.辽宁省动物疫病预防控制中心,辽宁沈阳 110164)
猪源大肠埃希菌磺胺类药物主要耐药基因的检测与分析
曹明慧1,赵凤菊2*
(1.中国兽医药品监察所,北京 100000;2.辽宁省动物疫病预防控制中心,辽宁沈阳 110164)
为查明辽宁地区猪源大肠埃希菌磺胺类耐药菌株中sul1、sul2及dfrA1 3种基因型的流行及分布情况,科学指导兽医临床合理用药,为猪大肠埃希菌病的防控提供科学依据,利用PCR技术对磺胺类耐药菌株进行了3种耐药基因型的检测。通过对耐药基因的检测发现,27株磺胺类耐药菌株中sul2的检出率最高,为74.07%(20/27);其次为sul1、dfrA1,检出率分别为33.33%(9/27)、22.22%(6/27),同时携带sul1、sul2和sul2、dfrA1两种基因型的菌株均占11.11%(3/27),同时携带sul1、sul2及dfrA1 3种基因型的菌株占14.81%(4/27)。表明辽宁地区猪源大肠埃希菌磺胺类耐药菌株中sul2为主要流行的基因型,并且在辽宁不同地区普遍存在,是介导猪源大肠埃希菌对磺胺类药物耐药性的主要基因型,其次为sul1、dfrA1。
猪;大肠埃希菌;磺胺类药物;耐药基因;聚合酶链反应
磺胺类药物是广谱抗菌药,对革兰阴性和革兰阳性细菌具有抑菌活性[1],从20世纪30年代开始,磺胺类药物已经被广泛应用于人类和动物细菌病及原虫感染的治疗[2]。近年来,由于临床抗生素的不合理使用导致细菌耐药现象普遍存在,尤其是多重耐药现象越来越严重。目前,抗生素抗性已经成一个严重的健康问题,微生物感染率和抗微生物药物耐药性的增加导致需要开发新型、有效的广谱抗菌药[3],但新型抗生素及新疗法的研发速度却远远落后于耐药菌株的产生速度,从而给人类和动物的临床治疗带来巨大挑战,减少或延缓耐药菌株的出现对于有效的临床治疗具有重要的现实意义。
从人和动物分离的革兰阴性菌包括大肠埃希菌对磺胺类药物耐药性的高发生率已经被广泛报道[4]。在对辽宁地区猪源大肠埃希菌耐药性调查中发现,在辽宁地区猪源大肠埃希菌对磺胺类药物的耐药率高达41.54%(27/65)。因此,为查明辽宁地区磺胺类药物主要耐药基因的流行及分布情况,本研究对27株磺胺类药物耐药的猪源大肠埃希菌用PCR方法对sul1、sul2及dfrA1基因进行了检测分析,为辽宁地区猪大肠埃希菌病的科学防控提供理论依据,也为兽医临床磺胺类药物的合理应用提供科学依据,从而减少或降低抗生素抗性对人类及动物健康造成的影响。
1 材料与方法
1.1 材料
1.1.1 菌株 27株对磺胺类药物耐药的猪源大肠埃希菌由辽宁不同地区病死猪或患病猪的组织脏器、活猪粪便中分离得到,由辽宁省动物疫病预防控制中心实验室鉴定并保存。
1.1.2 培养基及试剂 营养琼脂培养基、麦康凯培养基,北京奥博星生物技术有限公司产品,生产批号分别为20130608、20130708;水解酪蛋白琼脂培养基(MH)、药敏纸片,杭州市天和微生物试剂有限公司产品,生产批号分别为140506、140506;DNAzol提取试剂,Invitrogen产品;PrimeSTAR○RHS DNA Polymerase with GD buffer、ExTaqDNA聚合酶、10×Ex-Taqbuffer、2.5 mmol/L dNTPs、DNA Marker 2 000、溴化乙锭,宝生物工程(大连)有限公司产品;其他为实验室常规试剂。
1.1.3 PCR扩增引物 根据GenBank上登录的sul1(AY655485.1)、sul2(CP010373.2)及dfrA1(JQ690541.1)基因序列,利用Primer Premier5.0软件设计并合成了3对特异性引物,引物由上海生工生物工程技术服务有限公司合成(表1)。
1.2 方法
1.2.1 细菌DNA模板的制备 挑取18 h~24 h培养的培养物,用1 mL无菌生理盐水制备成一定浓度的菌悬液。吸取200 μL菌悬液至1.5 mL Eppendorf管中,加入800 μL DNAzol提取试剂,混匀后4℃、12 000 r/min离心10 min。吸取900 μL上清,置于另一1.5 mL Eppendorf管中,加入500 μL无水乙醇,混匀后4℃、12 000 r/min离心5 min。弃上清,无菌水配制的750 mL/L乙醇洗涤2次,干燥后用40 μL无菌水溶解沉淀,置-20℃保存备用。

表1 引物序列
1.2.2 耐药基因检测体系 采用25 μL反应体系,10×PCR buffer 2.5 μL,2.5 mmol/L dNTPs 2 μL,上、下游引物(20 μmol/L)各1 μL,ExTaq酶0.125 μL ,灭菌水16.375 μL,模板 2 μL。
1.2.3 基因测序检测体系 采用50 μL反应体系,PrimeSTAR HS DNA Polymerase 0.5 μL,2×PrimeSTAR GD buffer(Mg2+plus)25 μL, dNTP Mixture(2.5 mmol/L each)8 μL,上、下游引物各1 μL(引物浓度为20 μmol/L),模板5 μL,灭菌水补至50 μL。
1.2.4 PCR反应条件 94℃ 5 min;94℃ 45 s,退火温度(根据引物选择合适退火温度) 45 s,72℃ 50 s,35个循环;72℃ 10 min。10 g/L琼脂糖凝胶电泳检查PCR产物。
1.2.5 扩增产物的序列测定 选取7株sul1基因阳性样品、15株sul2基因阳性样品,将其PCR产物送上海生工生物工程技术服务有限公司进行序列测定,并与NCBI基因库进行序列同源性比较。
2 结果
2.1 耐药基因检测结果
27株磺胺类耐药菌株通过PCR方法进行sul1、sul2及dfrA1基因检测(表2),试验结果显示,有4株磺胺类耐药菌未检测出sul1、sul2及dfrA1基因。sul1总的检出率为33.33%(9/27),sul2总的检出率为74.07%(20/27),dfrA1总的检出率为22.22%(6/27);只携带1种基因型的菌株占48.15%(13/27),同时携带sul1、sul2 两种基因型和同时携带sul2、dfrA1两种基因型的菌株均占11.11%(3/27),同时携带sul1、sul2及dfrA1 3种基因型的菌株占14.81%(4/27)。基因型sul2在辽宁不同地区的耐磺胺类耐药菌株中普遍存在,以辽西和辽北地区检出率最高,为100%。其次为基因型sul1,虽然在辽宁不同地区的磺胺耐药菌株中均有检出,但检出较低。基因型dfrA1在辽北地区未检出,辽西地区检出率最高,为50%(表3)。
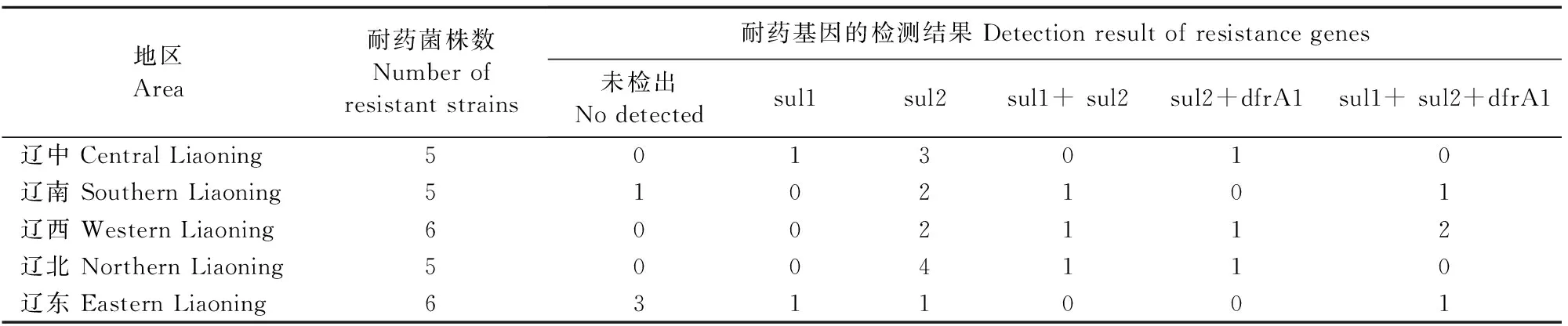
表3 不同地区大肠埃希菌磺胺类药物主要耐药基因携带情况
2.2 耐药基因的测序结果
将7份sul1基因阳性样品测序结果与NCBI基因库中sul1基因的同源性分析发现,7份样品的同源性均为100%。16份sul2基因阳性样品测序结果与NCBI基因库中sul2基因的同源性分析发现,11份样品的同源性为99%,5份样品的同源性为100%。
3 讨论
当前,全球细菌耐药性问题仍以惊人的速度在加剧,但几乎没有成功用于治疗的新药物产生,很多曾经可以用一种药物治疗的传染病目前已经成为严重的公共卫生安全问题[5]。细菌耐药性特别是多重耐药性的出现,不仅严重威胁着人类和动物疾病的治疗,同时也导致巨大的经济损失。
磺胺类药物具有与对氨苯甲酸(para-amino-benzoic acid,PABA)相类似的分子结构,二者竞争性抑制二氢叶酸合成酶的活性[6],从而抑制细菌的生长与繁殖。sul基因在不同临床和环境分离菌株中存在,具有携带和传播磺胺抗性的作用[7]。sul1、sul2及sul3是已知的质粒编码的磺胺耐药基因,可产生二氢叶酸合成酶并诱导磺胺类药物的抗性[8]。二氢叶酸还原酶利用NADPH还原二氢叶酸产生四氢叶酸,从而影响细菌核蛋白合成,dfrA1是二氢叶酸还原酶的一种。根据以往的研究,sul1、sul2基因在磺胺类耐药分离株中同时存在,在丹麦从人类分离的大肠埃希菌中sul2基因的流行比sul1高[9]。在对辽宁地区sul1、sul2及dfrA1 3种基因型的调查发现,不同地区存在的基因型略有差异。sul2的检出率最高,其次是sul1和dfrA1,这与以往的研究结果一致。在辽宁地区sul2分布广泛,是介导猪源大肠埃希菌对磺胺类药物产生耐药性的主要基因型。虽然sul1和dfrA1两种基因型的检出率较低,但在辽宁地区猪源大肠埃希菌对磺胺类药物耐药性方面仍起着重要作用。
[1] Byrne-Bailey K G,Gaze W H,Kay P,et al.Prevalence of sulfonamide resistance genes in bacterial isolates from manured agricultural soils and pig slurry in the United Kingdom[J].Antimicrob Agents Chemother,2009,53(2):696-702.
[2] Iqbal M S,Rahman M,Islam R,et al.Plasmid-mediated sulfamethoxazole resistance encoded by the sul2 gene in the multidrug-resistantShigellaflexneri2a isolated from patients with acute diarrhea in Dhaka,Bangladesh[J].PLoS One,2014,9(1):e85338.
[3] Hafez H N,EI-Gazzar A R.Synthesis and biological evaluation of N- pyrazolyl derivatives and pyrazolopyrimidine bearing a biologically active sulfonamide moiety as potential antimicrobial agent[J].Molecules,2016,21(9):pii:E1156.
[4] Labar A S,Millman J S,Ruebush E,et al.Regional dissemination of a trimethoprim-resistance gene cassette via a successful transposable element[J].PLoS One,2012,7(5):e19961.
[5] 李 秀,强 斌,徐正中,等.全基因组测序在细菌耐药性分析中的应用[J].中国人兽共患病学报,2016,32(8):696-99.
[6] Wu S,Dalsgaard A,Hammerum A M,et al.Prevalence and characterization of plasmids carrying sulfonamide resistance genes amongEscherichiacolifrom pigs,pig carcasses and human[J].Acta Vet Scand,2010,52:47.
[7] Trobos M,Christensen H,Sunde M,et al.Characterization of sulphonamide-resistantEscherichiacoliusing comparison of sul2 gene sequences and multilocus sequence typing[J].Microbiology,2009,155(Pt 3):831-836.
[8] Arabi H,Pakzad I,Nasrollahi A,et al.Sulfonamide resistance genes (sul) M in extended spectrum beta lactamase (ESBL) and non-ESBL producingEscherichiacoliisolated from iranian hospitals[J].Jundishapur J Microbiol,2015,8(7):e19961.
[9] Trobos M,Jakobsen L,Olsen K E,et al.Prevalence of sulphonamide resistance and class 1 integron genes inEscherichiacoliisolates obtained from broilers,broiler meat,healthy humans and urinary infections in Denmark[J].Int J Antimicrob Agents,2008,32(4):367-369.
Detection and Analysis of Sulfonamides Resistance Genes inEscherichiacolifrom Swine
CAO Ming-hui1,ZHAO Feng-ju2
(1.InstituteofChineseVeterinaryDrugSupervision,Beijing,100000,China; 2.LiaoningPreventionandControlCenterofAnimalEpidemicDiseases,Shenyang,Liaoning,110164,China)
To find out the prevalence and distribution of sul1,sul2 and dfrA1 three genotypes ofEscherichiacolifrom swine in Liaoning area,and to guide the clinical rational use of drugs,and to provide scientific basis for prevention and treatment of swineE.coliinfections,three resistance genetypes of the drug resistant strains were detected by PCR technology.Through the detection of drug resistance genes,the detection rate of sul2 was the highest,which was 74.07% (20/27); Followed by sul1,dfrA1,the detection rates were 33.33% (9/27),22.22% (6/27); Simultaneously carrying the two genotypes of sul1,sul2 and sul2,dfrA1 for 11.11% (3/27); Simultaneously carrying three genotypes of sul1,sul2 and dfrA1 for 14.81% (4/27).Therefore,sul2 was main genotype,and commonly existed in different areas of Liaoning,it is the main genotype ofE.coliisolated from pigs to the drug resistance,followed by sul2,dfrA1 in Liaoning area.
swine;Escherichiacoli; sulfonamides; drug resistance gene; polymerase chain reaction
2016-11-04
辽宁省自然科学基金项目项目(201402573)
曹明慧(1991-),女,吉林人,硕士研究生,主要从事微生物检测研究。*通讯作者
S852.612;S858.28
A
1007-5038(2017)07-0046-03

