蛋鸡心包积水综合征病原鉴定及组织灭活疫苗紧急免疫试验
刘吉山,肖跃强,褚仁忠,于 雪,姚春阳,苗立中,杨 慧,柳增善,沈志强*
(1.吉林大学动物医学学院,吉林长春 130062;2.山东省滨州畜牧兽医研究院,山东滨州 256600;3.山东绿都生物科技有限公司,山东滨州 256600;4.阳信县畜牧兽医局,山东阳信 251800)
蛋鸡心包积水综合征病原鉴定及组织灭活疫苗紧急免疫试验
刘吉山1,2,肖跃强2,褚仁忠4,于 雪3,姚春阳2,苗立中2,杨 慧3,柳增善1*,沈志强2*
(1.吉林大学动物医学学院,吉林长春 130062;2.山东省滨州畜牧兽医研究院,山东滨州 256600;3.山东绿都生物科技有限公司,山东滨州 256600;4.阳信县畜牧兽医局,山东阳信 251800)
2016年4月,山东蛋鸡养殖规模25 000余只的鸡场发生了一种高致死率传染病,病死率15%以上。通过临床症状观察、病理剖检、血凝试验、动物回归试验、PCR检测及血清型分析,确诊该病为禽腺病毒Ⅰ群4型感染所致。无菌采集该养殖场病死鸡肝脏,制备组织灭活疫苗,对鸡群进行紧急注射免疫,免疫接种后7 d,病死鸡数量开始逐渐下降,12 d后完全停止发病死亡,最终成功控制了该病。应用制备的同源组织灭活疫苗紧急免疫鸡群有效控制了禽腺病毒Ⅰ群4型的感染,为该病提供了一种可靠的防控措施。
心包积水综合征;蛋鸡;禽腺病毒Ⅰ群4型;组织灭活疫苗;紧急免疫
禽腺病毒(Fowl adenovirus,FAdV)属于腺病毒科禽腺病毒属,根据其群特异性抗原的不同,可将其可分为Ⅰ、Ⅱ及Ⅲ 3个群[1]。禽腺病毒Ⅰ群4型(FAdV-4)引起的心包积水综合征疫情首先于 1987年3月在巴基斯坦的安卡拉地区发生。因此,该病又被称为“安卡拉病”[2],其主要症状和病理症候群为心包积水综合征,随后在印度、日本、澳大利亚、智利及加拿大等很多国家均有发生[3-8]。我国于2015年上半年首先在山东地区养殖的“817杂交肉鸡”中大规模发生该病,病死率10%~80%不等,引起了较大恐慌;随后在蛋鸡、麻鸡等其他品种中也相继发生了类似疫情[9-11]。蛋鸡上该病的表现为急性死亡,病死率15%以上,病鸡排黄绿色粪便、随后转为亚临床病变,表现为零星死亡,病程很长,有时长达3个月以上。本试验通过对急性死亡期的病死蛋鸡进行临床症状、病理剖检、病毒血凝试验、动物回归试验、PCR检测及血清型分析,确诊该病为禽腺病毒Ⅰ群4型感染所致。通过制备病死鸡肝脏组织灭活苗,对发病鸡群及受威胁鸡群注射组织灭活疫苗进行紧急防疫,取得了理想的防控效果。
1 材料与方法
1.1 材料
1.1.1 病料来源 山东某养殖蛋鸡25 000余只的鸡场,该鸡场共2栋鸡舍,每栋12 500只,其中1栋鸡舍发生了疾病且死亡鸡只约1 900只,鸡群发病时60日龄。采集病死鸡肝脏置-20℃备用。
1.1.2 试验用动物 SPF鸡胚、30日龄SPF鸡,济南斯帕法斯家禽有限公司产品。
1.1.3 主要试剂 Gene JET Viral DNA/RNA Purification Kit、Gene JET PCR Purification Kit、DreamTaqGreen PCR Master Mix,Thermo Scientific公司产品。
1.1.4 引物设计合成 采用文献[12]发表的 FAdVⅠ亚群的hexon基因血清型分型引物,上游引物FAdV-F:CAARTTCAGRCAGACGGT,下游引物FAdV-R:TAGTGATGMCGSGACATCAT。引物由上海生工生物工程技术服务有限公司合成。
1.2 方法
1.2.1 临床症状与剖检病变观察 观察发病鸡群临床症状表现,并对病死及临死鸡进行剖检,观察病理学变化。
1.2.2 病料采集与处理 无菌采集病死鸡肝脏组织,与灭菌生理盐水以1∶5比例混合,用灭菌研磨器研磨成组织匀浆,反复冻融3次,12 000 r/min离心15 min,吸取上清液,经0.45 μm滤膜过滤后,置-20℃保存备用。
1.2.3 病毒分离及血凝试验 取1.2.2中处理的病料经卵黄囊途径接种6日龄SPF鸡胚,弃去24 h内死亡鸡胚,之后收取直至168 h死亡鸡胚并观察病变,收集尿囊液;经鸡胚继续传至第3代,采用1.1.4所述引物PCR检测病毒分离结果,并进行鸡红细胞凝集试验。
1.2.4 动物回归试验 取1.2.3中收集的第3代尿囊液,接种30日龄SPF鸡10只,胸部肌肉注射0.2 mL/只,连续观察7 d,同时设5只鸡注射生理盐水作为对照,记录结果。
1.2.5 病毒DNA提取 取1.1.1肝脏1 g,置于研钵内研磨捣碎加入PBS 反复冻融3次,5 000 r/min离心10 min,取上清提取 DNA,提取方法按照试剂盒说明书进行。
1.2.6 PCR扩增及产物鉴定 以提取的 DNA为模板, 扩增目的基因。PCR反应体系:PCR Mix 12.5 μL、上、下游引物各1 μL、DNA 模板1.5 μL,最后加灭菌 ddH2O 补至 25 μL。PCR反应条件: 95 ℃ 3 min; 95 ℃ 30 s,55 ℃ 30 s,72 ℃ 50 s,35个循环;72 ℃ 10 min。经10 g/L琼脂糖凝胶电泳验证PCR产物,回收PCR产物,送上海生工生物工程技术服务有限公司测序,分析酶切位点以确定病毒血清型。
1.2.7 组织灭活苗的制备 无菌采集养殖场病死鸡肝脏,按照组织∶盐水1∶5 (w/v)比例高速匀浆后过滤,滤液中加入终浓度3 mL/L的甲醛溶液,置于37℃温箱内灭活24 h,并进行无菌检验。同时接种10只1月龄鸡,2 mL/只,观察7 d后接种鸡均健活为合格。加入等量生理盐水混匀后分装备用。
1.2.8 紧急免疫与治疗 对发病和尚未发病的鸡群分别胸部肌肉注射接种制备的组织灭活疫苗1 mL/只,同时给予鸡群电解多维及维生素C等抗应激药物,连续观察15 d,记录结果。
2 结果
2.1 临床症状与剖检病变
该病表现为急性发病,死亡约1 900只,病死率15%以上,病鸡羽毛蓬乱、排黄绿色粪便,鸡群呈现以病死鸡为中心扩散发病死亡,随后转为亚临床症状,零星死亡,病程很长,长者达3个月以上。病死鸡剖检呈现明显的心包积液,积液清亮淡黄色,有些病鸡心包积液量达10 mL,肝脏肿大坏死,肾脏肿大,肌胃与腺胃交界处带状或点状出血,腺胃乳头出血。部分发病鸡剖检病变见图1。
2.2 病毒分离结果
病料接种鸡胚后鸡胚在3 d~7 d内死亡,个别鸡胚7 d后仍未死亡。死亡鸡胚胚体水肿、出血,肝脏出血、坏死,心脏心包有积液(图2)。

A.心包积液;B.腺胃出血;C.肝脏病变A.Hydropericardium; B.Hemorrhage in glandular stomach; C.Gross lesions in liver
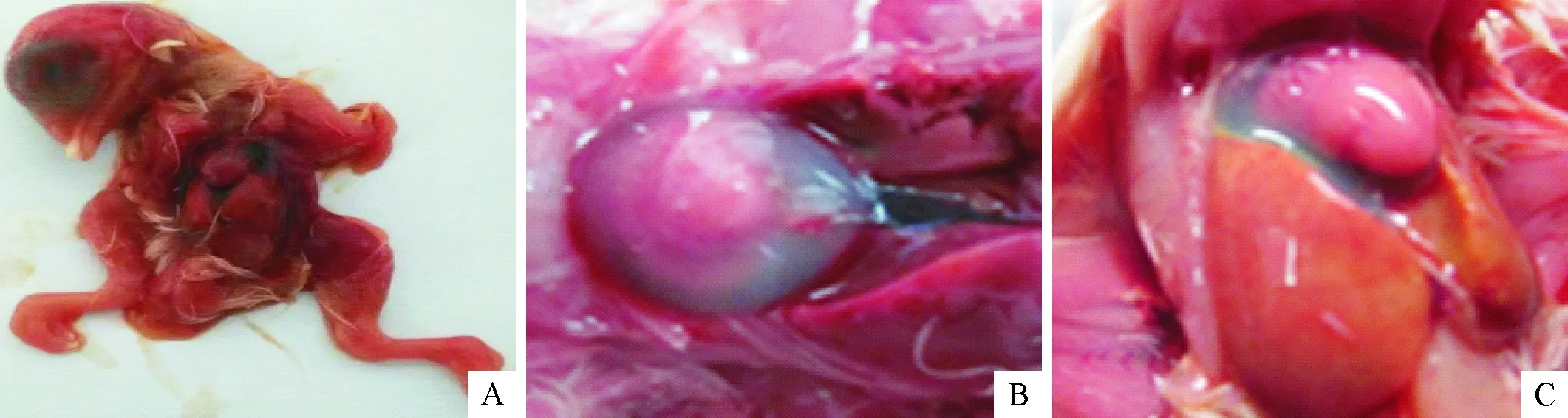
A.鸡胚出血水肿;B.鸡胚心包积液;C.鸡胚肝脏病变A.Hemorrhage and edema in lethal embryo; B.Hydropericardium; C.Gross lesions in liver
2.3 血凝试验结果
收集死亡鸡胚尿囊液,针对hexon基因的PCR检测结果为阳性,用1%鸡红细胞检测病毒血凝性,不能凝红细胞,提示排除了新城疫病毒、禽流感病毒等有血凝性的病毒感染的可能性。
2.4 动物回归试验
30日龄SPF鸡注射收集的尿囊液后急性发病,2 d~4 d全部死亡,与鸡场发病鸡呈现高度相似的临床症状与剖检病变,表现为排黄绿色稀便,急性死亡,死前仍能吃料;死亡鸡心包积液,腺胃与肌胃交界处有出血条带。说明采集的病料内含有毒力强的
病原,经鸡胚传代成功分离到病原。试验鸡死亡情况如表1所示。
2.5 PCR扩增与测序结果
扩增结果如图3所示,产物大小为885 bp,经测序分析,扩增序列中含有与FAdV-4型病毒一致的StyⅠ与MluⅠ酶切位点,且切割位置与切割产物大小与文献报道一致,不含有BsiWⅠ、ScaⅠ、BglⅠ与AspⅠ等确定其他血清型病毒的酶切位点,BLAST序列比对,与已公布的FAdV-4型病毒序列同源性在99%以上。以上结果表明,所分离到的病原是1株FAdV-4型病毒。
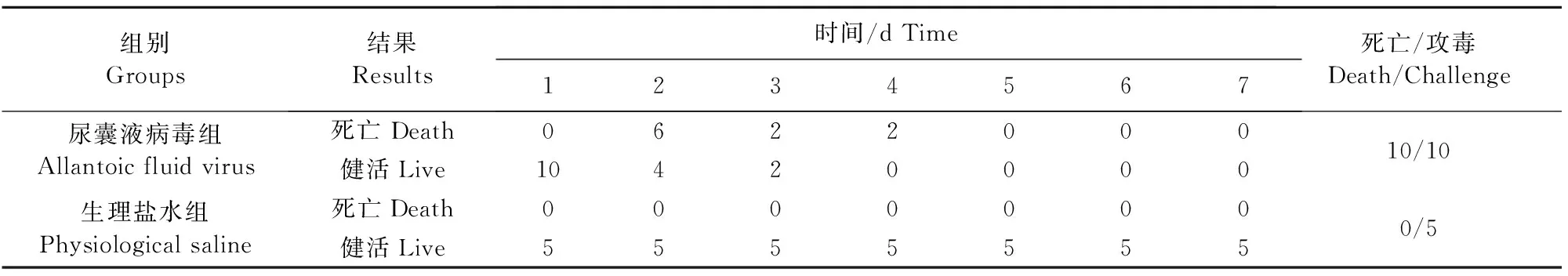
表1 动物回归试验SPF鸡死亡情况
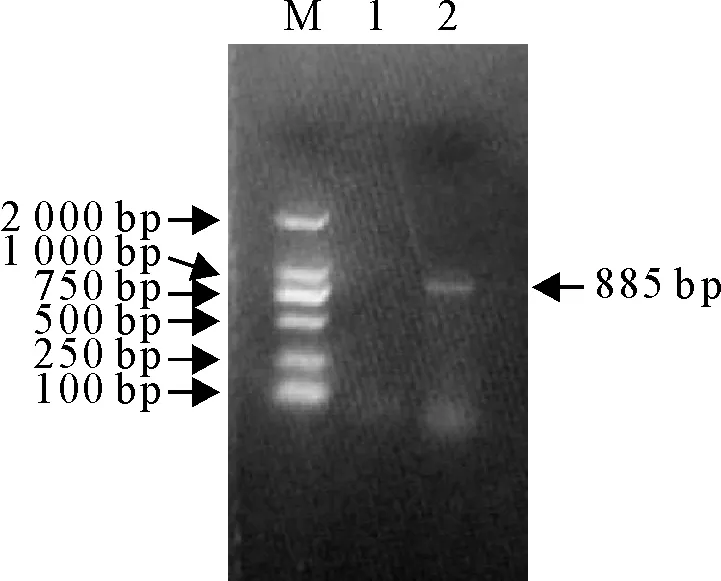
M.DNA标准DL 2 000;1.阴性对照;2.病料样品扩增产物
M.DNA Marker DL 2 000; 1.Negative control; 2.Amplification products liver sample
图3 PCR检测电泳结果
Fig.3 PCR detection results of the infected laying hens
2.6 紧急免疫试验
紧急免疫之前发病鸡舍(1号舍)已发病15 d,急性死亡期已经过去,共死亡827只,目前每天死亡30余只,未发病舍(2号舍)已出现零星死亡,每天死亡3只~5只,死亡鸡只剖检后病变与1号舍的高度相似。紧急免疫治疗结果显示,刚注射后由于受到应激刺激导致死亡率有所升高,1号舍由原来每天死亡30多只上升到40多只,2号舍由3只~5只升高到10多只,随后死亡数逐渐下降,10多天后两舍鸡群均停止死亡,鸡群逐渐恢复健康。紧急免疫后死亡情况统计结果见表2。

表2 紧急免疫后鸡群发病死亡情况
3 讨论
Ⅰ群禽腺病毒目前已鉴定5个病毒种、12个血清型及鸭腺病毒、火鸡腺病毒等暂定种[12],可引起心包积水综合征、包涵体肝炎及肌胃糜烂等临床症状。心包积水综合征又被称为“安卡拉病”,引起该病的毒株除了1例与FAdV-12共感染以外,绝大多数为FAdV-4血清型[13-14]。研究表明,FAdV-4毒株之间存在毒力差异,有的FAdV-4毒株本身就可以引起发病,有的则需要免疫抑制因素协同作用。本研究中,该鸡场发生高死亡率传染病,经初步筛选,引起鸡群高死亡率的疾病已知的有禽流感病毒、新城疫病毒、传染性支气管炎病毒以外,还有FADV-4感染,但从该鸡群的发病症状及剖检症状可以排除鸡传染性支气管炎病毒感染;通过接种鸡胚分离病毒和病毒血凝试验发现,死亡鸡胚尿囊液均不凝集鸡红细胞,排除了具有血凝性的禽流感病毒、新城疫病毒感染致病的可能性。用分离的病毒接种SPF鸡进行动物攻毒回归试验,成功复制了与鸡场高度相似的临床症状与剖检病变,并且致死性高达100%,确定了病料中含有高致死性传染因子,并且成功分离到致病病原。据报道,PCR方法已经被用于检测Ⅰ亚群禽腺病毒,即使用六邻体基因引物可区分病毒种并定位到特定血清型[15]。因此,本研究使用文献报道的引物进行PCR并进行酶切位点序列分析,确诊该鸡场系感染了Ⅰ群禽腺病毒4型(FAdV-4)导致鸡群发病死亡。
该病在临床上可以分为两个阶段,急性发病期,在该阶段死亡率明显增高,随后转入慢性期,每天有鸡星死亡,大部分病程长达2个~3个月。该病既能水平传播,也能垂直传播,水平传播主要是接触性传播,也可经各种排泄物传播,而粪便中病毒含量最高,有报道称鸡舍内的水平传播主要是通过与粪便的直接接触来实现,并在短距离内也通过空气缓慢传播,持续数周,这一现象在该发病鸡场临床发病与表现得到印证,即一旦鸡群中有鸡发病,该病会以发病鸡为中心向周围辐射传播,逐渐蔓延整个鸡群,这也可能是该病流行慢,病程长的原因。
已有报道通过制备肝组织灭活疫苗在预防心包积水综合征上获得显著成效[16-17]。本研究制备同源组织灭活疫苗,对发病和未发病鸡群进行紧急防疫,发现在短时间内成功控制了该病。说明该疫苗不仅可以对发病鸡群起到很好的治疗作用,还能够对未发病鸡群起到良好的预防作用。另外,该病在“817肉鸡”中发病严重,对鸡群也可以大剂量应用卵黄抗体,通过临床观察发现,虽然治疗效果确切,但容易复发,不适合在饲养期较长的鸡群应用。本研究结果提示,同源组织灭活疫苗不仅能用于免疫预防,也可用于免疫治疗,开展该病的临床防控。
[1] Saif Y M.禽病学[M]:12版.苏敬良,高 福,索 勋,译.北京:中国农业出版社,2012:289-334.
[2] Anuum A D,Sabri M A,Iqbal Z.Hydropericarditis syndrome in broiler chickens in Pakistan [J].Vet Rec,1989,124(10):247-248.
[3] Singh A,Oberoi M S,Jand S K,et al.Epidemiology of inclusion body hepatitis in poultry in northern India from 1990 to 1994 [J].Revue Scientifique Ettechnique,1996,15(3):1053-1060.
[4] Singh A,Oberoi M S,Singh B.Pathogenicity of quail's inclusion body hepatitis virus (avian adenovirus-1) for Japanese quails and broiler chicks [J].Vet Res Commun,1995,19(6):545-551.
[5] Toro H,Prusas C,Raue R,et al.Characterization of fowl adenoviruses from outbreaks of inclusion body hepatitis/hydropericardium syndrome in Chile [J].Avian Dis,1999,43(2):262-270.
[6] Keterer P J,Timmins B J,Prior H C,et al.Inclusion body hepatitis associated with an adenovirus in racing pigeons in Australia [J].Aust Vet J,1992,69(4):90-91.
[7] Gomis S,Goodhope A R,Ojkic A D,et al.Inclusion body hepatitis as a primary disease in broilers in Saskatchewan,Canada [J].Avian Dis,2006,50(4):550-555.
[8] Dahiya S,Srivastava R N,Hess M,et al.Fowl adenovirus serotype 4 associated with outbreaks of infectious hydropericardium in Haryana,India [J].Avian Dis,2002,46(1):230-233.
[9] Zhao J,Zhong Q,Zhao Y,et al.Pathogenicity and complete genome characterization of fowl adenoviruses isolated from chickens associated with inclusion body hepatitis and hydropericardium syndrome in China [J].PLoS One,2015,10(7):e0133073.
[10] 牛登云,沈 元,王 蕊,等.2015年我国Ⅰ群禽腺病毒分子流行病学调查 [J].中国家禽,2016(9):65-68.
[11] 刁有祥.Ⅰ群禽腺病毒感染的流行情况与防控 [J].北方牧业,2016(10):21.
[12] Balamurugan V,Kataria J M.The hydropericardium syndrome in poultry--a current scenario [J].Vet Res Commun,2004,28(2):127-148.
[13] Hess M,Raue R,Prusas C.Epidemiological studies on fowl adenoviruses isolated from cases of infectious hydropericardium [J].Avian Pathol J WVPA,1999,28(5):433-439.
[14] Rahul S,Kataria J M,Senthilkumar N,et al.Association of fowl adenovirus serotype 12 with hydropericardium syndrome of poultry in India [J].Acta Virologica,2005,49(2):139-143.
[15] Hess M, Raue R, Hafez H M. PCR for specific detection of haemorrhagic enteritis virus of turkeys, an avian adenovirus[J]. J Virol Meth, 1999, 81(1-2): 199-203.
[16] Anjum A D.Experimental transmission of hydropericardium syndrome and protection against it in commercial broiler chickens [J].Avian Pathol J WVPA,1990,19(4):655-660.
[17] Roy P,Koteeswaran A,Manickam R.Efficacy of an inactivated oil emulsion vaccine against hydropericardium syndrome in broilers [J].Vet Rec,1999,145(16):458-459.
Pathogen Identification of Hydropericardium Syndrome and Contingency Vaccination with A Developed Tissue Inactivated Vaccine in Breeding Hens
LIU Ji-shan1,2,XIAO Yue-qiang2,CHU Ren-zhong4, YU Xue3,YAO Chun-yang2, MIAO Li-zhong2,YANG Hui3,LIU Zeng-shan1,SHEN Zhi-qiang2
(1.CollegeofVeterinaryMedicine,JilinUniversity,Changchun,Jilin,130062,China; 2.ShandongBinzhouAnimalScience&VeterinaryMedicineAcademy,Binzhou,Shandong,256600,China; 3.ShandongLvduBio-SciencesandTechnologyCo.Ltd.,Binzhou,Shandong,256600,China; 4.YangxinAnimalHusbandryandVeterinaryBureau,Yangxin,Shandong,251800,China)
In april 2016,a highly lethal infectious disease emerged in a farm of more than 25 000 breeding hens locating in Shandong province,and the mortality rate reached to 15%,which resulted in heavy economic losses.The disease was diagnosed through the clinical symptoms,autopsy lesions,hemagglutination test,PCR detection,serotype analysis and animal regression tests.The results showed that the fowl adenovirus type 4 (FAdV-4) was the agent of this disease.The livers of sick or dead chickens were collected and the tissue inactivated vaccine was developed,and all animals in this farm were performed contingency vaccination,7 days later,the number of sick hens began to decrease gradually,and there were no more infected animals at 12 day time point,so the disease was successfully controlled through the tissue inactivated vaccine immunization.This study provided a reliable measure for prevention and control of the epidemic disease with FAdV-4 infection through developing the homologous tissue inactivated vaccine and thereafter the contingency vaccination.
Hydropericardium syndrome; breeding hen; Fowl adenovirus serotype 4; tissue inactivated vaccine; contingency vaccination
2016-11-14
山东省现代农业产业技术体系家禽创新团队项目(SDAIT-11-16)
刘吉山(1975-),男,山东高唐人,副研究员,兽医博士生,主要从事预防兽医学研究。*通讯作者
S852.659.1;S858.31
A
1007-5038(2017)07-0037-05

