陕北白绒山羊小反刍兽疫病毒RT-PCR方法的建立
郝玉青,刘健鹏,杨增岐
(1.榆林市动物疫病预防控制中心,陕西榆林 719000;2.西北农林科技大学动物医学院,陕西杨凌 712100)
陕北白绒山羊小反刍兽疫病毒RT-PCR方法的建立
郝玉青1,2,刘健鹏1*,杨增岐2*
(1.榆林市动物疫病预防控制中心,陕西榆林 719000;2.西北农林科技大学动物医学院,陕西杨凌 712100)
为了建立适用于本地区小反刍兽疫病毒的分子生物学快速检测方法,通过分析NCBI数据库中小反刍兽疫病毒N基因序列,根据该基因设计特异性引物,建立针对本地区小反刍兽疫病毒N基因的一步法RT-PCR检测方法,利用该方法对来自疫源地的不同病料样本进行检测,结果显示该方法对病料的可选择性较多,对检测到的阳性条带通过测序分析,发现流行毒株与陕西毒株基因型差异不明显。该检测方法的建立有利于开展小反刍兽疫疫情监测,为有效防控小反刍兽疫提供技术支撑。
小反刍兽疫病毒;逆转录-聚合酶链反应;测序分析
小反刍兽疫(Peste des petis ruminants,PPR)是由小反刍兽疫病毒(Peste des petis ruminants virus,PPRV)引起的一种山羊、绵羊等小反刍兽类的急性接触传染性疾病[1],其发病率和病死率均较高。世界动物卫生组织(OIE)将其列为法定报告动物传染病,我国将其列为一类动物疫病[2]。
2014年4月3日在榆林市定边县盐场堡镇贾圈村发生一起疑似小反刍兽疫疫情,4月5日该疫情得到国家外来动物疫病防控制中心确诊,启动应急预案并进行了无害化处理。该病作为一种重大的跨国动物疫病,严重危险动物卫生安全,故建立一种快速特异且适合本地区的诊断技术就显得十分重要。PPRV病毒基因组为单股负链RNA,编码8个蛋白,依次为3′N-P/C/V-M-F-H-L 5′,N蛋白是组成病毒核衣壳的主要蛋白之一,基于该蛋白发展的诊断技术可以有效的区分小反刍兽疫和牛瘟[3]。针对PPRV检测试剂盒不稳定、质量层次不齐、价格昂贵等问题,本研究建立了一种针对N基因的适合于检测陕北白绒山羊PPRV的逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)用于本地区小反刍兽疫的监测,具有重要的实际意义。
1 材料与方法
1.1 材料
1.1.1 病料和疫苗PPRV 弱毒疫苗为新疆天康生产(Nigeria75/1)、病料采集为本地区已公布的小反刍兽疫病料,全市不同县区送到的120份棉拭子病源监测样品,犬瘟热病毒疫苗为杨凌绿方生物有限公司生产。
1.1.2 试剂与溶液 TIAN amp Virus DNA/RNA Kit病毒基因组RNA提取试剂盒、Master Mix、DNA Marker、Easy Script First-Strand cDNA Synthesis Super Mix反转录试剂盒,TaKaRa生物科技有限公司产品;RNAiso Plus裂解液、预冷氯仿(-20℃)、预冷异丙醇(-20℃)、RNase-free水,TaKaRa公司产品。
1.1.3 主要仪器设备 微量移液器,德国Eppendorf公司产品;超净工作台,北京亚泰科隆实验科技开发中心产品;PCR扩增仪,日本Bio-Rad公司产品;台式高速冷冻离心机、微波炉(LG)、稳压稳流电泳仪,北京六一厂产品;电子天平,美国Adventurer公司产品;核酸电泳仪,北京六一厂产品;紫外凝胶成像系统,英国Syngene公司产品。
1.2 方法
1.2.1 引物设计 参照NCBI公布的小反刍兽疫病毒N基因保守区域的序列,使用Primer 5.0 软件设计的基因引物交由invitrogen公司合成,合成的引物用1 mL/L DEPC处理水稀释至终浓度10 μmol/L,置于-20℃保存备用(表1)。
1.2.2 病料处理 取疑似患小反刍兽疫的病羊肺、淋巴结、肾或肝等病料组织加入适量灭菌生理盐水剪碎研磨,至匀浆状态后制成10%悬液,加入双抗,离心取上清液保存备用;采集棉拭子离心取上清液备用;采集抗凝血可直接使用。
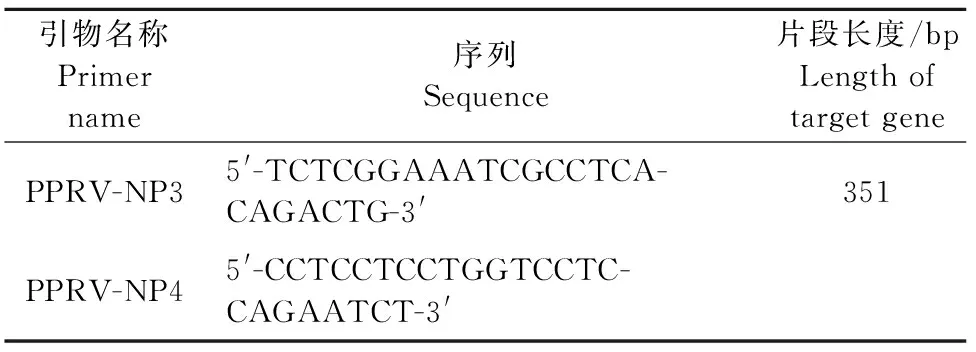
表1 PPRV引物序列
1.2.3 病毒核酸的提取 根据TaKaRa试剂盒的说明书进行RNA提取和反转录操作。PCR扩增以cDNA为模板进行PCR扩增,所有加样操作都需在冰盒上进行,PCR 扩增体系:反应体系为25 μL,2×TaqPCR Master Mix 12μL,ddH2O 10 μL,上、下引物各1 μL,cDNA 1 μL。扩增反应程序:95℃ min;95℃ 30 s,52℃ 30 s,72℃ 30 s,共40个或35个循环;72℃ 7 min。产物用15 g/L琼脂糖凝胶电泳,恒压120 V,40 min~50 min,凝胶成像仪观察PCR产物。
1.2.4 PPRV特异性试验 选取犬瘟热病毒(CDV)疫苗(批号:20150703)、PPR阳性羊全血按照PPRV提取方法进行提取检测,观察结果确定该方法的特异性。
1.2.5 PPRV敏感性试验 设置6个检测浓度,进行该方法的灵敏度检测:测定PPRV疫苗液的TCID50浓度,根据浓度分别将疫苗倍比稀释成终浓度为10-5TCID50/mL~100TCID50/mL,按照样品的方法进行RT-PCR扩增,琼脂糖凝胶电泳检测条带情况。
1.2.6 PPRV病料检测 采集疑似PPRV不同发病羊的抗凝血、口鼻棉拭子、直肠棉拭子、肺组织、肾组织、淋巴组织及血清,进行检测。
1.2.7 PPRV普通RT-PCR的病原学检测 利用本研究建立的PPRV检测方法分别对各县区送来的PPRV监测样品进行检测。
2 结果
2.1 PPRV疫苗毒株提取试验
设计好引物后按照PPRV提取方法,提取疫苗弱毒株后得到351 bp的条带(图1),与预期结果相符。
2.2 PPRV特异性试验
使用犬瘟热疫苗毒和PPR阳性羊全血为模板,按照PPRV体系进行提取,取反应后产物8 μL电泳检测,结果显示1号、2号为阴性,3号为阳性,表明PPRV普通PT-PCR检测方法对PPRV的检测有良好的特异性(图2)。

M.DNA标准DL 500;1.PPRV疫苗株;2.阴性对照
M.DNA Marker DL 500; 1.Vaccine strain of PPRV;2.Negative control
图1 PPRV疫苗毒株提取试验
Fig.1 Vaccine strain extraction test of PPRV

M.DNA标准DL 2 000;1.阴性对照;2.CDV疫苗株;3.PPR阳性病料
M.DNA Marker DL 2 000; 1.Negative control;2 .Vaccine strain of CDV; 3.Positive material of PPR
图2 PPRV特异性试验
Fig.2 Specificity test of PPRV
2.3 PPRV敏感性试验
从图3扩增结果可见,当PPRV疫苗毒株稀释到10-2TCID50/mL时,PCR扩增仍可为阳性,说明本方法具有较高的灵敏度。
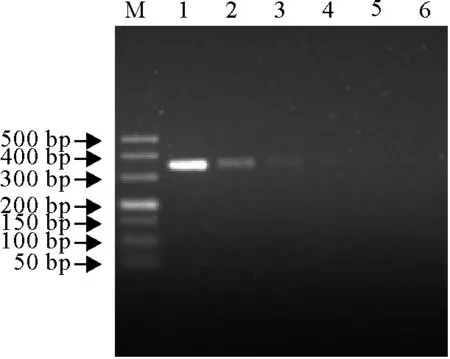
M.DNA标准DL 500;1~6.PPRV浓度100TCID50/mL~10-5TCID50/mL
M.DNA Marker DL 500; 1-6.PPRV with concentrations of 100TCID50/mL-10-5TCID50/mL
图3 PPRV敏感性试验
Fig.3 Sensitivity test of PPRV
2.4 PPRV病料检测
用琼脂糖凝胶电泳对PCR产物进行检测,检测结果显示(图4)1、2、4、5、6、7、8、9、10、11、14、15号为阳性,3、10、12、13、16为阴性。由1号、2号、4号、6号、14号可知采集的陕北白绒山羊直肠棉拭子中检测出PPRV病毒,说明此阶段羊处于排毒期,检出率高,采样也比较容易,小反刍兽疫病原学监测可推荐使用棉拭子样品;由5号、7号可知小反刍兽疫发病羊血清中含有病毒,用RT-PCR可检出,血清可作为小反刍兽疫病毒的检测病料;由4号、5号、8号、9号检测结果可知,发病期送检病料在不同组织中都可检出,表明对发病羊进行病料送检可选择性较多。选取3条阳性条带,切胶后密封保存,送北京博迈德生物科技有限公司进行测序。

M.DNA标准DL 500;B、N.同只羊采集样品;1.棉拭子;2.棉拭子;3.棉拭子;4.B棉拭子;5.B组血清;6.N组棉拭子;7.N组血清;8.B组肺;9.B组肾;10.肾;11.肾;12.肺;13.棉拭子;14.棉拭子;15.PPRV疫苗对照;16.阴性对照
M.DNA Marker DL 500;B&N.The same sheep samples;1.Cotton swab;2.Cotton swab;3.Cotton swab;4.Cotton swab of B;5.Serum of group B;6.Cotton swab of groupN;7.Serum of group N;8.Lung of groupB;9.Kidney of group B;10.Kidney;11.Kidney;12.Lung;13.Cotton swab;14.Cotton swab;15.Vaccine strain of PPRV ;16.Negative control
图4 PPRV病料检测
Fig.4 The detection of PPRV samples
2.5 PPRV普通RT-PCR的病原学检测
对全市不同县区送样的120份病源监测样品进行PPRV普通RT-PCR检测,初筛检测出7份棉拭子样品阳性,对7份阳性样品再次检测,检测结果显示有5份样品在351 bp左右处均可见到清晰的条带(图5),2份样品没有显示条带。
2.6 测序结果
测序结果经Megalin软件用Clustal W方法对测序结果中的核苷酸序列进行同源性比对,获得的D1、D2、Y3小反刍兽疫毒株序列分别与NCBI中公布的China/ShaanXi 2014(登录号:KP319027.1)毒株相应N基因序列进行核苷酸同源性比对(图6),序列同源性分别为97.8%、97.5%、98.1%;碱基序列比较发现,碱基主要发生了部分突变和缺失(图7)。
3 讨论
建立特异、敏感、快速的小反刍兽疫病原诊断方法,是榆林市小反刍兽疫防控的迫切需求,血清学诊断时使用青岛立见产PPRV阻断-ELISA试剂盒,只能用作免疫效果的评价,不能作为疫病诊断依据,进口竞争ELISA(C-ELISA)属于感染后的晚期诊断,且价格昂贵[4]。实时荧光定量TaqMan RT-PCR方法虽然特异性和灵敏度都有所提高[5],但是检测时需要产生荧光的引物、探针及昂贵的设备,现阶段市一级检测单位只有普通PCR仪,建立的PPR普通PCR对仪器要求相对较低也符合本地区流行毒株检测。RT-PCR检测发现,应用该对引物能够检测到0.01TCID50/mL的病毒,与国内外报道的检测方法比较,灵敏度较高[6-7]。
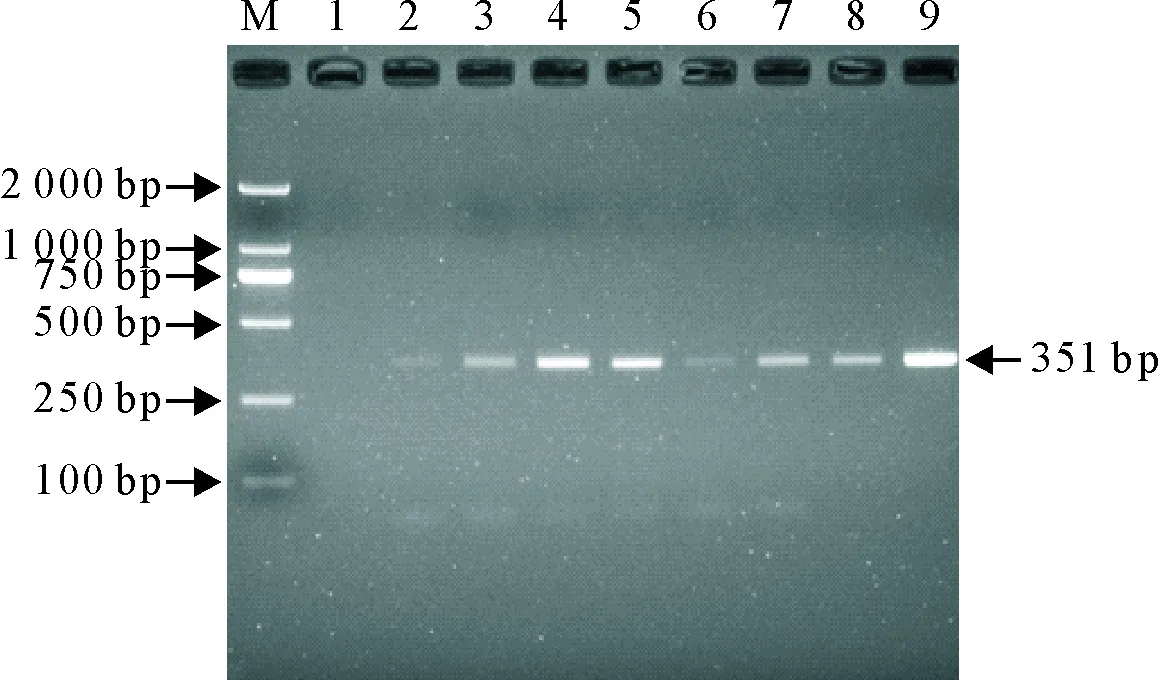
M.DNA标准DL 2 000 bp;1.阴性对照;2~8.病源学监测棉拭子样品;9.PPRV疫苗对照
M.DNA Marker DL 2 000 bp;1.Negative control;2-8.Cotton swab samples of the pathogenic surveillance;9.Vaccine strain of PPRV
图5 PPRV病原学检测
Fig.5 Pathogen detection of PPRV
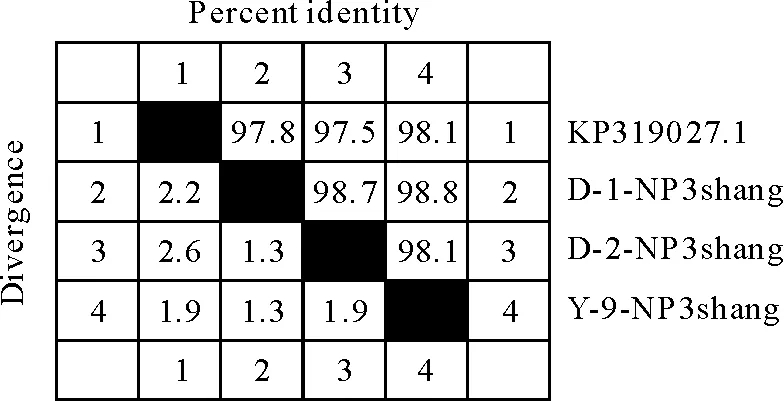
图6 不同毒株N基因核酸同源性比对
PPR病原学采集样品时《小反刍兽疫防治技术规范》中推介采集病料时可采用羊口鼻棉拭子、淋巴结或血沉宗黄层。本试验在关于PPR不同病料的检测中发现直肠棉试子在羊早期检测中可使用,PPRV主动监测时需要到散户采集样品,若采样时对羊的损伤过大会引起采样障碍,采集眼、鼻、口腔棉拭子病料成功率较低,而采集直肠棉拭子需要的人力少、技术要求低、对羊的伤害较小,检出率也高,因此推荐做主动或被动监测时采用直肠棉拭子[8];当发生疑似PPR时,采集发病羊的病料选择性较多,在不同组织中几乎都可检出,血清和全血也可作为PPRV检测样品使用。
利用建立的RT-PCR方法检测120份病原学样品,结果有5份阳性棉拭子,由于灭活疫苗的免疫效果不佳,目前国内外对PPR的防制主要采用弱毒疫苗接种[9],被检测样品中可能含有小反刍兽疫病毒或疫苗毒株[10],目前关于小反刍兽疫病毒或疫苗毒株进行鉴别检测技术还不成熟[11],市级实验室没有相关资质,根据相关条例需向上级疫控中心送样检测。小反刍兽疫N基因有部分位点发生了突变、缺失,但由于密码子具有简并性的特点[12],致使氨基酸序列未见差异,与China/ShaanXi 2014(登录号:KP319027.1)毒株基因序列亲缘关系较近。

图7 PPRV基因核苷酸序列同源性比较
[1] 田克恭,李 明.动物疫病诊断技术理论与应用[M].北京:中国农业出版社,2014:490-491.
[2] 于 红,郑明学,古少鹏,等.小反刍兽疫研究进展[J].畜禽业,2009,19(8):28-32.
[3] 包静月,李 林,王志亮,等.一步法实时定量RT-PCR检测小反刍兽疫病毒方法的建立[J].中国动物检疫,2007,24(8):21-23.
[4] Couacy-Hymann E,Bodjo S C,Koffi M Y,et al.The early detection of peste-des-petits- ruminants(PPR) virus antigens and nucleic acid from experimentally infected goats using RT-PCR and immunocapture ELISA techniques[J].Res Vet Sci,2009,87(2):332-335.
[5] 杨 卓,于汉勋,李 巍,等.小反刍兽疫病毒RT-LAMP检测方法的研究[J].现代畜牧兽医,2015(7):8-14.
[6] 唐 娜,孙翠平,王玉茂,等.小反刍兽疫病毒与产气加膜梭菌双重RT-PCR检测方法建立[J].动物医学进展,2015,36(6):9-13.
[7] Mahajan S,Agrawal R,Kumar M,et al.Sandwich ELISA based evaluation of clinical samples for Peste des petits ruminants virus detection[J].Small Ruminant Res,2012,106(2-3):206-209.
[8] 张高轩,赵福义.小反刍兽疫[J].新疆农垦科技,2001(6):17-18.
[9] 李 伟,李 刚,范晓娟,等.小反刍兽疫病毒RT-LAMP快速检测方法的建立[J].中国预防兽医学报, 2009(5):374-378.
[10] 印春生,支海兵,王乐元,等.小反刍兽疫活疫苗临床试验研究[J].中国兽药杂志,2010,44(7):4-5.
[11] 吕建强,杨俊兴,宗 卉,等.小反刍兽疫疫苗毒与野毒实时荧光RT-PCR鉴别检测方法建立[J].中国兽医学报,2012,32(12):1795-1798.
[12] Sharma N K,Beniwali B K,Gahloti G C.Economic losses due to morbidity in marwari breed of sheep in arid zone of Rajathan[J].India J Anim Sci,2007,77(1):92-98.
Development of RT-PCR for Detection of Peste-des-petits Ruminants Virus in Chasmere Goats of Norshwest Shaanxi
HAO Yu-qing1,2,LIU Jian-peng1,YANG Zeng-qi2
(AnimalDiseasePreventionandControlCenterofYulin,Yulin,Shaanxi,719000,China; 2.CollegeofVeterinaryMedicine,NorthwestA&FUniversity,Yangling,Shaanxi,712100,China)
In order to establish a rapid molecular biological method for testing peste des petits ruminants virus,the N gene sequence of peste des petits ruminants virus in NCBI database was analyzed,the specific primers were designed based on this gene,a one-step RT-PCR method for the detection of N gene of peste des petits ruminants ruminants virus in this area was established.The pair of primers were used to detect different samples from epidemic focus,the detected positive bands were sequenced,it can be determined that the epidemic strains and state released strains have the same genotype.The establishment of this detection method is propitious to the active monitoring and passive monitoring of the peste des petits ruminants epidemic situation,the technical support will be provided to prevent and control the peste des petits ruminants epidemic situation.
Peste des petits ruminant virus; reverse transcription-polymerase chain reaction,; sequencing analysis
2017-01-17
农业科技创新转化资金项目(NYKJ-2015-023);陕西省科技统筹创新工程科技技术项目(2015KTTSNY04-04)
郝玉青(1988-),男,陕西靖边人,兽医硕士,主要从事动物疫病防控工作。*通讯作者
S852.659.5;S858.27
A
1007-5038(2017)07-0012-05

