羊布鲁菌血清抗体iELISA方法的建立及应用
张广冻,陈梦茜,李俊玫,刘 欢,张建民,靳亚平,王爱华*
(1.西北农林科技大学动物医学院,陕西杨凌 712100;2.陕西省蒲城县畜牧兽医局,陕西蒲城 715500)
羊布鲁菌血清抗体iELISA方法的建立及应用
张广冻1△,陈梦茜1,2△,李俊玫1,刘 欢1,张建民2,靳亚平1,王爱华1*
(1.西北农林科技大学动物医学院,陕西杨凌 712100;2.陕西省蒲城县畜牧兽医局,陕西蒲城 715500)
为建立一种准确、快速、安全的羊布鲁菌检测方法,构建布鲁菌bp26基因的原核表达载体,用切胶-电洗脱的方法纯化重组GST-Bp26蛋白,并以纯化的重组GST-Bp26蛋白为包被抗原,优化反应条件,建立了羊布鲁菌血清抗体的iELISA方法。结果表明,所建立的iELISA方法具有较好的特异性和敏感性,与虎红平板凝集试验结果具有良好的符合性,能够满足羊布鲁菌病临床检测需要,具有较好的临床应用价值。
布鲁菌;Bp26;原核表达;间接酶联免疫吸附试验
布鲁菌病(Brucellosis)是由布鲁菌(Brucella)引起的一种人兽共患传染病,是我国法定的二类动物疫病和乙类传染病,全球每年约有5万新增病例,是全球性的公共卫生问题[1-2]。布鲁菌是一种兼性胞内病原菌,主要在吞噬细胞内定殖,能够逃避宿主免疫系统的监测和杀灭作用,从而建立慢性持续感染。患病动物主要表现为不孕不育、怀孕母畜流产、骨关节及生殖系统炎症等[3-5]。人类因与患病动物直接接触或食用未经消毒或消毒不彻底的动物性食品而感染布鲁菌病,患者主要表现出波状热、骨关节炎症、肝脾肿大等临床症状[4-7]。
及时、准确地确诊是布鲁菌病防控的关键,目前兽医基层常用的布鲁菌病诊断方法主要是虎红平板凝集试验,但该方法存在假阳性率较高、灵敏度不高等不足[8-10]。ELISA方法是目前应用最广泛的血清学检测方法,具有特异性强、灵敏度高、操作简便等优点[11]。本研究采用原核表达布鲁菌具有较强免疫原性的Bp26蛋白,以纯化的Bp26蛋白为包被抗原建立用于羊布鲁菌的间接酶联免疫吸附试验(iELISA),为羊布鲁菌病的诊断提供了一种灵敏度较好、特异性较强的血清学方法。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒及血清 布鲁菌病活疫苗S2株由陕西省兽药监察所惠赠;pGEX-4T-1表达载体由西北农林科技大学农业部动物生物技术重点开放性实验室保存;大肠埃希菌DH5α、BL21(DE3)感受态细胞,天根生化科技(北京)有限公司产品;羊布鲁菌病标准阳性血清、羊布鲁菌病标准阴性血清、30份羊布鲁菌病临床阴性血清由陕西省渭南市蒲城县畜牧兽医局惠赠。
1.1.2 主要试剂TaqDNA聚合酶、T4 DNA连接酶、DNA Marker,宝生物工程(大连)有限公司产品;辣根过氧化酶标记的兔抗山羊IgG,北京中杉金桥生物技术有限公司产品;DNA回收纯化试剂盒、质粒小提试剂盒、细菌基因组DNA提取试剂盒,天根生化科技(北京)有限公司产品;其他试剂均为进口或国产分析纯。
1.2 方法
1.2.1 布鲁菌bp26基因原核表达载体的构建 根据GenBank上公布的布鲁菌bp26基因序列(GenBank登录号:CP006961.1)设计1对特异性PCR引物,序列如下(划线部分分别为EcoRⅠ和SalⅠ酶切位点):
F:CCGGAATTCATGAACACTCGTGCTAGC;
R:ACGCGTCGACTTACTTGATTTCAAA- AACGAC;
以提取的布鲁菌活疫苗S2株的基因组为模板,扩增大小为753 bp的布鲁菌bp26基因片段。将扩增到的bp26基因片段与原核表达载体pGEX-4T-1连接,得到重组表达载体,并进行酶切和测序鉴定,鉴定正确的重组载体命名为pGEX-bp26。
1.2.2 重组布鲁菌Bp26蛋白的原核表达与纯化 用重组表达载体pGEX-bp26转化大肠埃希菌BL21(DE3)感受态细胞,次日挑取单克隆进行培养,然后加入终浓度为1 mmol/L的IPTG诱导表达,并对诱导产物进行SDS-PAGE检测。对鉴定正确的诱导产物以切胶-电洗脱的方法纯化重组布鲁菌Bp26蛋白(GST-Bp26)。
1.2.3 iELISA方法的建立
1.2.3.1 抗原最佳包被浓度及血清最佳稀释倍数的确定 采用双方阵试验确定最佳抗原包被浓度和血清稀释倍数:用0.05 mol/L的碳酸盐缓冲液(pH9.6)将纯化的重组蛋白分别稀释为0.2、0.4、0.8、1.6、3.2、6.4、12.8 μg/mL,100 μL/孔包被酶标板,37℃孵育1 h。将包被好的酶标板内液体弃去,每孔加入150 μL的50 g/L脱脂奶粉,37℃封闭30 min。弃去包被液,PBST洗涤3次,将羊布鲁菌病标准阳性血清和标准阴性血清分别做5、10、20、40、80倍稀释,每孔分别加入100 μL,与不同浓度的重组蛋白组成方阵,37℃孵育1 h。弃去酶标板内液体,PBST洗涤3次,每孔加入100 μL稀释好的HRP-兔抗山羊IgG(7 000倍稀释),37℃孵育1 h。弃去酶标板内的二抗,PBST洗涤3次,每孔加入100 μL现配的TMB显色液,37℃显色30 min,每孔加50 μL 2 mol/L硫酸终止。在酶标仪上读取OD 450 nm值,以阳性血清OD 450 nm值接近1.0,阳性血清与阴性血清的比值(P/N值)最大者为最佳抗原包被浓度和血清稀释倍数。
1.2.3.2 最佳抗原包被时间的确定 以筛选到的最佳浓度的抗原包被酶标板,于37℃分别包被30 min、1 h、1.5 h、2 h,其余步骤按照常规iELISA程序操作。反应结束后测定OD 450 nm,以阳性血清OD值接近1.0,P/N值最大者所对应的抗原包被时间为最佳抗原包被时间。
1.2.3.3 最佳封闭液的确定 用PBST配制10 g/L BSA、50 g/L BSA、50 g/L脱脂奶粉、100 g/L脱脂奶粉、10 g/L明胶作为候选封闭液,分别于37℃封闭30 min,其余步骤按照常规iELISA程序以筛选到的最佳抗原包被浓度、包被时间及血清稀释倍数操作,反应结束后测定OD值,以阳性血清OD值接近1.0,P/N值最大者所对应的封闭液为最佳种类封闭液。
1.2.3.4 最佳封闭时间的确定 向最佳包被的酶标板加入150 μL最佳封闭液,于37℃分别封闭15、30、45、60 min,其余步骤按照常规iELISA程序以筛选到的最佳血清稀释倍数操作,反应结束后测定OD值,以阳性血清OD值接近1.0,P/N值最大者所对应的封闭时间为最佳封闭时间。
1.2.3.5 最佳血清作用时间的确定 向最佳包被和封闭的酶标板加入最佳稀释的血清,于37℃分别作用0.5、1.0、1.5、2.0 h,其余步骤按照常规iELISA程序操作,反应结束后测定OD值,以阳性血清OD值接近1.0,P/N值最大者所对应的作用时间为最佳血清作用时间。
1.2.3.6 最佳二抗作用时间的确定 向最佳包被、封闭及血清作用的酶标板加入7 000倍稀释的酶标二抗,于37℃分别作用0.5、1.0、1.5、2.0 h,其余步骤按照常规iELISA程序操作,反应结束后测定OD值,以阳性血清OD值接近1.0,P/N值最大者所对应的作用时间为最佳二抗作用时间。
1.2.3.7 最佳显色时间的确定 按照前面筛选好的最佳反应条件进行iELISA操作,在加入TMB显色液后,分别于37℃孵育10、20、30、45、60 min,反应结束后测定OD值,以阳性血清OD值接近1.0,P/N值最大者所对应的作用时间为最佳显色时间。
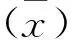
1.2.3.9 特异性试验 用建立的iELISA方法分别检测羊快疫、羊肠毒血症、羊猝疽、羊黑疫、羊口蹄疫及羊小反刍兽疫阳性血清。
1.2.3.10 敏感性试验 将羊布鲁菌阳性血清分别做5、10、20、40、80、160、320倍稀释,用建立的iELISA方法进行检测。
1.2.3.11 符合性试验及临床应用 利用建立的iELISA检测方法,对陕西省渭南市某养殖场的90份血清进行检测,并将检测结果与相同血清的虎红平板凝集试验检测结果进行对比。
2 结果
2.1 布鲁菌bp26基因原核表达载体的构建
将PCR产物进行10 g/L琼脂糖凝胶电泳,在约753 bp处出现特异性条带(图1);经测序验证,PCR产物序列与GenBank中公布的布鲁菌bp26基因序列相符,表明布鲁菌bp26基因扩增正确。将构建好的重组载体进行EcoRⅠ和SalⅠ双酶切鉴定,分别于约753 bp处和4 969 bp处出现特异性条带,表明重组表达载体构建正确(图2)。
2.2 重组布鲁菌Bp26蛋白的原核表达与纯化
将重组表达载体转化大肠埃希菌BL21(DE3)感受态细胞后的诱导表达产物进行SDS-PAGE电泳,在约54 ku出现高表达的蛋白条带,蛋白分子质量与目的蛋白相符,表明重组Bp26蛋白成功表达(图3)。为了提高目的蛋白的回收率和纯度,本试验以切胶-电洗脱的方法对诱导产物进行了纯化(图4)。

M.DNA标准DL 5 000;1.bp26 基因PCR产物
M.DNA Marker DL 5 000;1.PCR products of bp26 gene
图1 布鲁菌bp26基因PCR扩增
Fig.1 PCR amplification ofBrucellabp26 gene
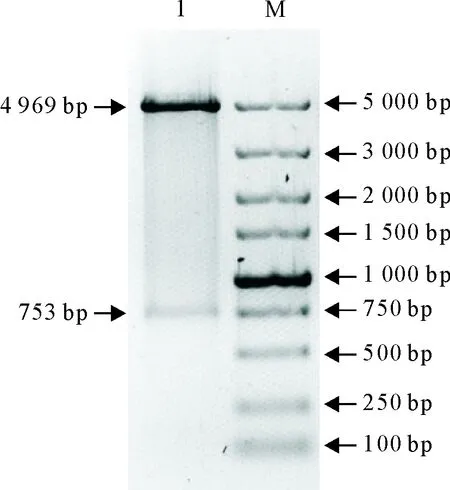
M.DNA标准DL 5 000;1.pGEX-bp26的酶切产物M.DNA Marker DL 5 000;1.pGEX-bp26 digested withEcoRⅠ &SalⅠ
图2 pGEX-bp26的酶切鉴定
Fig.2 Enzyme digestion identification of pGEX-bp26
2.3 iELISA方法的建立
2.3.1 iELISA反应条件的优化 由方阵试验结果(表1)可知,当重组蛋白浓度为3.2 μg/mL、血清稀释10倍时,阳性血清的OD 450 nm值接近1.0且P/N值较大,因此确定以3.2 μg/mL重组蛋白为最佳抗原包被浓度,血清10倍稀释为最佳血清稀释倍数。最终确定的iELISA最佳反应条件为:3.2 μg/mL的重组蛋白于37℃包被1 h,50 g/L的脱脂奶粉于37℃封闭30 min,血清样本作10倍稀释后于37℃孵育1 h,7 000倍稀释的酶标二抗于37℃孵育1 h,新鲜配制的TMB显色液于37℃反应30 min。

M.蛋白分子质量标准;1.pGEX-4T-1诱导产物;2.pGEX-4T-1未诱导;3.pGEX-bp26诱导产物;4.pGEX-bp26未诱导M.Protein molecular weight Marker;1.Products of pGEX-4T-1 induced with IPTG;2.Products of pGEX-4T-1 uninduced;3.Products of pGEX-bp26 induced with IPTG;4.Products of pGEX-bp26 uninduced
图3 pGEX-bp26的诱导鉴定
Fig.3 Identification of pGEX-bp26 with induction
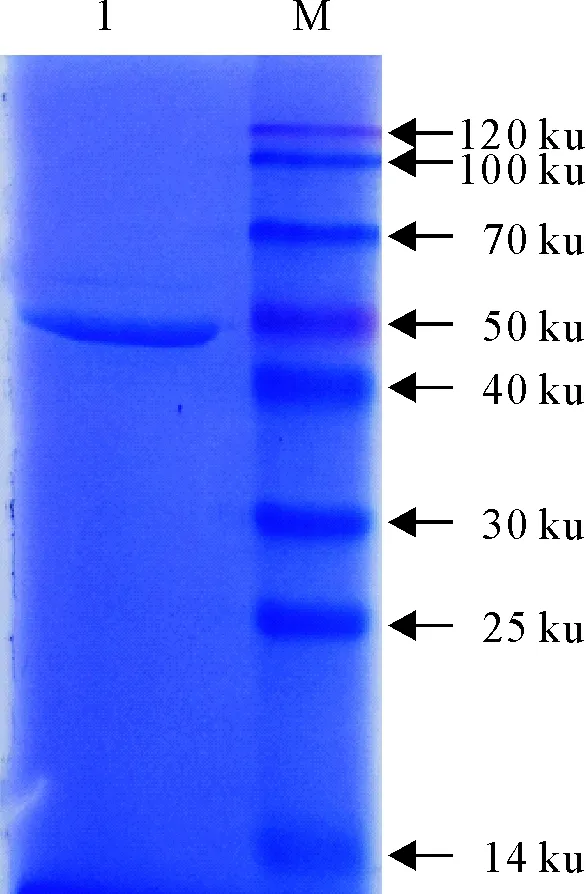
M.蛋白分子质量标准;1.GST-bp26纯化产物
M.Protein molecular weight Marker;1.Products of purified GST-bp26
图4 GST-Bp26的纯化
Fig.4 Purification of GST-Bp26
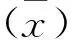
2.3.3 特异性试验 用建立的iELISA方法分别检测羊快疫、羊肠毒血症、羊猝疽、羊黑疫、羊口蹄疫及羊小反刍兽疫阳性血清,结果均低于临界值,表明本研究建立的iELISA方法特异性良好。
2.3.4 敏感性试验 将羊布鲁菌阳性血清分别做5、10、20、40、80、160、320倍稀释,用建立的iELISA方法进行检测,结果显示当血清稀释20倍时结果仍为阳性,能够满足羊布鲁菌病临床检测要求。
2.3.5 iELISA方法的临床应用与符合性试验 于陕西省渭南市某养殖场采集90份羊血清,分别用本研究建立的iELISA方法和虎红平板试验进行检测(表3),结果显示,iELISA方法分别检出21份阳性和69份阴性,虎红平板分别检出16份阳性和74份阴性,结果符合率达到90%,说明本研究建立的iELISA具有较高的敏感性和符合度。

表1 最佳抗原包被浓度和最佳血清稀释倍数的确定

表2 30份阴性血清检测结果
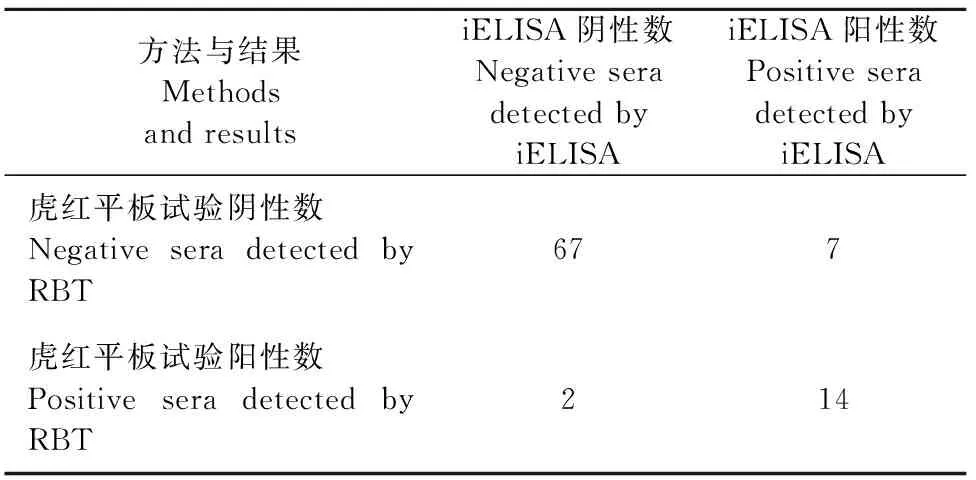
表3 iELISA与虎红平板试验对比结果
3 讨论
原核表达系统是目前最常用的蛋白体外表达系统之一,而且现有原核表达载体大都带有筛选和纯化标签,极大地方便了后续蛋白的纯化工作。然而,从实际应用效果来看,利用原核表达载体的纯化标签进行过柱纯化还存在着诸多不足,首先是过柱纯化要求表达的蛋白必须为可溶性蛋白,如果是包涵体蛋白则必须提前进行变性处理,操做稍显繁琐;其次是纯化柱的结合力有限,会导致部分表达产物的浪费,最终造成蛋白回收率较低;还有就是纯化柱的特异性不够强,会导致杂蛋白的非特异性结合,造成回收的蛋白纯度不高。而切胶-电洗脱方法纯化重组蛋白的回收率和纯度则相对较高,传统切胶方法是通过KCl染色来确定目的条带位置的,但是KCl染色特异性不高、染色效果不明显,一定程度上还是限制了切胶-电洗脱纯化的目的蛋白的纯度和回收率。通过不断的条件和方法摸索,本研究改进了切胶-电洗脱方法:先取少量诱导后的重组蛋白进行考马斯亮蓝染色鉴定,如果目的蛋白上下没有多余的杂蛋白,则可在切胶时参考蛋白Marker直接进行切胶;如果目的蛋白上下有杂带,则先对诱导菌液进行超声裂解,回收上清或沉淀以去除目的蛋白上下的杂蛋白,然后参照蛋白Marker切取目的蛋白条带;还可以对诱导菌液进行适当浓缩以提高目的蛋白的浓度,从而增大目的蛋白在SDS-PAGE凝胶上的条带大小,以此来保证切胶时目的蛋白的纯度和回收量;通过以上方法改进极大地提高了蛋白的得率和纯度。
对于布鲁菌病的诊断,病原的分离培养是最为准确的一种方法,但是此方法操作复杂、耗时长、需要一定的专业技能、存在感染风险等缺点。因此目前已很少应用。虎红平板凝集试验、试管凝集试验是目前应用最广泛的布鲁菌检测方法,其主要通过灭活菌体的LPS与血清中的抗体发生抗原抗体反应来判断结果。由于革兰阴性菌的LPS具有较为明显的交叉反应,因此这两种方法在临床应用中容易出现假阳性。另外,虎红平板凝集试验和试管凝集试验也存在工作量大、不利于大规模应用等缺点[12-13]。ELISA方法操作简便,适合临床大规模应用,尤其以抗原交叉性较弱的蛋白类抗原建立的ELISA方法,具有特异性强、灵敏度高等优点[8,14]。
Bp26蛋白是布鲁菌的一个外膜蛋白,在所有布鲁菌种高度保守,其在布鲁菌外膜组成通道样的结构[15-16]。研究表明,Bp26蛋白是一种保护性抗原,对人、牛、羊等具有较好的免疫保护性[17-18]。由于Bp26蛋白与其他细菌不存在抗原交叉性,因此可以用作亚单位疫苗和检测抗原的候选分子,且在布鲁菌病临床诊断上取得了较为理想的效果[15,19-21]。鉴于Bp26的多种特性,本研究以表达纯化的Bp26蛋白为包被抗原建立了检测羊布鲁菌病的iELISA方法。本研究将布鲁菌bp26基因克隆到原核表达载体pGEX-4T-1,经IPTG诱导获得了分子质量约为54 ku的重组蛋白GST-Bp26,并经切胶-电洗脱法纯化得到了纯度较高的GST-Bp26。以纯化的GST-Bp26为包被抗原,通过对各反应条件的优化,初步建立了用于羊布鲁菌病检测的iELISA方法。用建立的iELISA方法分别了羊快疫、羊肠毒血症、羊猝疽、羊黑疫、羊口蹄疫及羊小反刍兽疫阳性血清,结果均低于临界值,表明本研究以布鲁菌Bp26蛋白为检测抗原建立的iELISA方法与腐败梭菌、D型产气荚膜梭菌、C型产气荚膜梭菌、B型诺维梭菌、口蹄疫病毒及小反刍兽疫病毒不存在交叉反应。本研究建立的iELISA方法灵敏度表现为当血清稀释20倍时仍能够检出阳性血清,相对偏低,分析原因可能是抗原有待进一步优化。在验证该iELISA方法的符合性时,于临床随机采集了90份羊血清,分别用RBT方法和本iELISA方法进行检测,结果显示符合性良好,但是也出现了RBT阳性而iELISA阴性、RBT阴性而iELISA阳性的情况,可能是两种方法所依赖的抗原不同导致的[8,12-14]。总的来说,本研究建立的iELISA方法具有良好的特异性、敏感性及符合度,能够满足羊布鲁菌病临床检测的需要。
[1] Pappas G,Papadimitriou P,Akritidis N,et al.The new global map of human brucellosis [J].Lancet Infect Dis,2006,6(2):91-99.
[2] Bamaiyi P H, Hassan L, Khairani-Bejo S, et al. The prevalence and distribution ofBrucellamelitensisin goats in Malaysia from 2000 to 2009[J]. Prev Vet Med, 2015, 119(3): 232-236.
[3] Jesse F F A,Abba Y,Tijjani A,et al.Gonado-hypophyseal lesions and reproductive hormonal changes inBrucellamelitensisinfected mice and its lipopolysaccharides (LPSs)[J].Compar Clin Pathol,2016,25(1):31-36.
[4] Martirosyan A,Moreno E,Gorvel J P.An evolutionary strategy for a stealthy intracellularBrucellapathogen [J].Immunol Rev,2011,240(1):211-234.
[5] Assenga J A, Matemba L E, Muller S K, et al. Epidemiology ofBrucellainfection in the human, livestock and wildlife interface in the Katavi-Rukwa ecosystem, Tanzania[J]. BMC Vet Res, 2015, 11(1): 189.
[6] De Jong M F,Tsolis R M.Brucellosis and type Ⅳ secretion [J].Future Microbiol,2012,7(1):47-58.
[7] Barquero-Calvo E, Mora-Cartín R, Arce-Gorvel V, et al.Brucellaabortusinduces the premature death of human neutrophils through the action of its lipopolysaccharide [J]. PLoS Pathog, 2015, 11(5): e1004853.
[8] Mahmood R,Waheed U,Ali T,et al.Serological and nucleic acid based detection ofBrucellosisin livestock species and molecular characterization ofBrucellamelitensisstrains isolated from Pakistan[J].Int J Agr Biol,2016,18(2):311-318.
[9] 邢 进,王金锋,赵宝华.布鲁菌病及其诊断方法研究进展[J].动物医学进展,2009,30(3):69-73.
[10] Aktar F, Tekin R, Bektas M S, et al. Diagnostic role of inflammatory markers in pediatricBrucellaarthritis[J]. Italian J Pediatrics, 2016, 42(1): 3.
[11] García-Bocanegra I,Allepuz A,Pérez J J,et al.Evaluation of different enzyme-linked immunosorbent assays for the diagnosis of brucellosis due toBrucellamelitensisin sheep [J].Vet J,2014,199(3):439-445.
[12] de Figueiredo P,Ficht T A,Rice-Ficht A,et al.Pathogenesis and immunobiology of Brucellosis:review ofBrucella-host interactions [J].Am J Pathol,2015,185(6):1505-1517.
[13] Gwida M,El-Ashker M,Melzer F,et al.Use of serology and real time PCR to control an outbreak of bovine Brucellosis at a dairy cattle farm in the Nile Delta region,Egypt [J].Irish Vet J,2016,69(1):3.
[14] Ayala S M, Hasan D B, Celestino C A, et al. Validation of a simple universal IELISA for the diagnosis of human brucellosis[J]. Eur J Clin Microbiol Infect Dis, 2014, 33(7): 1239-1246.
[15] Lindler L E,Hadfield T L,Tall B D,et al.Cloning of aBrucellamelitensisgroup 3 antigen gene encoding Omp28,a protein recognized by the humoral immune response during human brucellosis[J].Infect Immun,1996,64(7):2490-2499.
[16] Kim D,Park J,Kim S J,et al.Brucellaimmunogenic BP26 forms a channel-like structure [J].J Mol Biol,2013,425(7):1119-1126.
[17] Ying F,Yu W,Shihua Z,et al.Identification ofBrucellamelitensisand molecular cloning of its BP26 gene into pET24a (+) vector[J].Anim Husb Feed Sci,2015,6:10.
[18] Ronneau S,Moussa S,Barbier T,et al.Brucella,nitrogen and virulence[J].Critical Rev Microbiol,2016,42(4):507-525.
[19] Gupta V K,Radhakrishnan G,Harms J,et al.InvasiveEscherichiacolivaccines expressingBrucellamelitensisouter membrane proteins 31 or 16 or periplasmic protein BP26 confer protection in mice challenged withB.melitensis[J].Vaccine,2012,30(27):4017-4022.
[20] Liang L,Leng D,Burk C,et al.Large scale immune profiling of infected humans and goats reveals differential recognition ofBrucellamelitensisantigens [J].PLoS Negl Trop Dis,2010,4(5):e673.
[21] Qiu J,Wang W,Wu J,et al.Characterization of periplasmic protein BP26 epitopes ofBrucellamelitensisreacting with murine monoclonal and sheep antibodies [J].PLoS One,2012,7(3):e34246.
Establishment and Application of iELISA for Detecting
Serum Antibody of GoatBrucella
ZHANG Guang-dong1,CHEN Meng-xi1,2,LI Jun-mei1,LIU Huan1, ZHANG Jian-min2,JIN Ya-ping1,WANG Ai-hua1
(1.CollegeofVeterinaryMedicine,NorthwestA&FUniversity,Yangling,Shaanxi, 712100,China;2.BureauofAnimalHusbandryandVeterinaryMedicine,Pucheng,Shaanxi,715500,China)
In order to develop an iELISA for detecting goat brucellosis,a prokaryotic expression vector ofBrucellabp26 gene was constructed,and the recombinant protein GST-Bp26 was purified by the method of gel- electricelution.Then the microplates were coated with purified GST-Bp26 protein,and the reaction conditions were optimized respectively,finally,the iELISA for detecting serum antibody of goat brucellosis was developed.The specificity and sensitivity of the iELISA were tested,the results showed that the iELISA can satisfy the clinical detection of goat brucellosis.In addition,compared with the rose bengal plate test (RBPT),the iELISA exhibited a comparable efficiency,suggested that the iELISA has a potential for clinical use.
Brucella; Bp26; prokaryotic expression; iELISA
2017-04-20
国家自然科学基金项目(31672584);陕西省科技统筹创新工程计划项目(2016TZC-N-13-5)
张广冻(1989-),男,山东新泰人,硕士研究生,主要从事动物繁殖障碍性疾病防控研究。△同等贡献作者 *通讯作者
S852.614
A
1007-5038(2017)07-0006-06

