小脑顶核电刺激对脑白质疏松患者执行功能的改善效果
魏佳军,曾非
(武汉大学人民医院,武汉430060)
小脑顶核电刺激对脑白质疏松患者执行功能的改善效果
魏佳军,曾非
(武汉大学人民医院,武汉430060)
目的 观察小脑顶核电刺激(FNS)对脑白质疏松(LA)患者执行功能的改善效果。方法 将33例LA伴执行功能障碍的患者随机分为观察组17例和对照组16例。两组均给予常规药物治疗,包括针对LA给予脑蛋白水解物护脑治疗,针对合并的基础疾病给予对症治疗,治疗20 d。观察组在常规治疗基础上采用FNS治疗,对患者小脑顶核进行仿生电刺激,电流1 mA,频率130~200 Hz,强度为70~100 mV,每次30 min,1次/d,连续治疗20 d。分别于治疗前后对两组患者进行执行功能评价,包括Stroop色词测试C部分(SCWT-C)、言语流畅性测试(VFT)、连线测试A部分和连线测试B部分(TMT-A、B)、画钟测验(CDT);进行头颅MRI检查,测算执行功能相关脑区白质部分各向异性(FA)值。结果 对照组治疗前后各项执行功能测试成绩差异无统计学意义。观察组FNS治疗后SCWT-C、VFT、TMT-A及TMT-B、CDT的测试成绩较治疗前有所提高(P均<0.05),且观察组治疗后各项执行功能测试成绩优于对照组治疗后(P均<0.05)。对照组治疗前后执行功能相关脑区白质FA值差异无统计学意义。观察组治疗后右额叶白质、左额叶白质、右顶叶白质、左顶叶白质、右扣带束、左扣带束的FA值均高于治疗前,且高于对照组治疗后(P均<0.05)。结论 FNS治疗可提高LA患者的执行功能,改善执行功能相关脑区皮层下白质纤维微结构的完整性。
脑白质疏松;小脑顶核;电刺激疗法;执行功能
脑白质疏松(LA)是指在脑皮层下白质或脑室旁CT检查呈低密度表现、MRI T2Flair呈高信号的斑点状或片状改变。LA被认为是血管性认知功能障碍的一个早期信号,可进展为痴呆[1]。在认知功能障碍中,患者的执行功能障碍较记忆障碍更为突出[2],会导致患者日常生活能力下降及社会行为能力障碍。因此,LA引起的执行功能障碍应引起足够重视。小脑顶核电刺激(FNS)是一种特异生物仿生电刺激技术,无创、安全,有改善脑血流及改善认知功能的作用,对脑梗塞、偏头痛、阿尔茨海默病等治疗有效[3]。但FNS对LA患者的执行功能是否有改善作用目前未见相关报道。为此,我们尝试对LA患者进行FNS治疗,观察FNS对患者执行功能的改善效果,现报告如下。
1 资料与方法
1.1 临床资料 选择2016年7月~2017年4月在神经内科住院治疗的LA患者纳入研究。所有患者均伴有执行功能障碍,后者符合Godefroy等提出的诊断标准[4]。LA纳入标准[5]:MRI检查脑室旁或(和)半卵圆中心白质散在或融合性病变呈长T1、长T2Flair信号。排除标准:①Binswanger病、肿瘤、CO中毒、脑炎、多发性硬化及脑积水等病引起的脑白质病变;②有精神病史;③半年内服用影响认知功能的药物;④有严重听力及视力障碍,影响神经心理测试;⑤心脏或颅内有金属植入;⑥患严重心肝肺肾等内科疾病。共纳入LA患者33例,男18例、女15例,年龄52~75(63.1±9.2)岁,受教育年限5~14(8.6±3.2)年,LA分级[6]轻度7例、中度14例、重度12例。将33例患者随机分为观察组17例和对照组16例。观察组男10例、女7例,年龄(62.7±9.0)岁,受教育年限(8.3±3.0)年,LA轻、中、重度各3、7、7例,合并高血压病7例、糖尿病4例、高脂血症8例;对照组男8例、女8例,年龄(63.5±9.4)岁,受教育年限(8.8±3.5)年,LA轻、中、重度各4、7、5例,合并高血压病5例、糖尿病3例、高脂血症7例。两组患者性别、年龄、受教育年限、LA严重程度及合并疾病情况差异无统计学意义,具有可比性。
1.2 治疗方法 两组均给予相同的内科常规药物治疗:针对LA给予脑蛋白水解物护脑治疗,即将20 mL脑蛋白水解物配入250 mL生理盐水中静滴,1次/d,连续治疗20 d;针对合并的基础疾病如高血压病、糖尿病、高脂血症分别给予非洛地平缓释片降血压、二甲双胍片降血糖、阿托伐他汀钙片降血脂。观察组在常规治疗基础上采用FNS治疗:将脑电仿生电刺激治疗仪(上海CVFT-010M型)的主电极片安置并固定于患者双侧乳突处,使用模式3对患者小脑顶核进行仿生电刺激,电流1 mA,频率130~200 Hz,强度为70~100 mV,每次30 min,1次/d,连续治疗20 d。
1.3 执行功能评价 分别于治疗前后对两组患者进行执行功能评价。①Stroop色词测试C部分(SCWT-C)[7]:卡片C包含50个字及4种颜色,要求患者尽快而正确地说出字的颜色而不是文字,将正确数(个)和完成时间(s)作为评价指标。②言语流畅性测试(VFT)[8]:在1 min内让患者尽可能多地说出动物名称,以说出动物名称的个数为评价指标。③连线测试(TMT)[9,10]:分A、B两部分,A 部分是让患者按顺序连接25个数字;B部分要求患者按顺序交替连接25个数字及字母,考虑到英文字母可能对中国人产生干扰,B部分测试采用中文修订版,将数字包含在正方形和圆形中,要求患者按数字顺序连接时两种图形要交替排列,以完成时间(s)为评价指标。④画钟测验(CDT):让患者画1个钟的表盘,标上所有时间刻度,指针指向8点20分,钟面轮廓、刻度和指针每项标画正确则各记1分,总共3分,得分<3分判定为异常。
1.4 执行功能相关脑区白质部分各向异性(FA)值的测算 两组分别于治疗前后进行头颅GE 3.0T MRI检查。MRI常规序列扫描包括T1Flair、T2Flair。MRI扩散张量成像(DTI)检查采用单次激发自旋回波平面成像进行横断面扫描,层厚5 mm,层间距0 mm,层数20个,重复时间8 000 ms,回波时间76.2 ms,视野24 cm×24 cm,采集矩阵128×128,向25个方向施加扩散敏感度梯度,扩散敏感系数为0和1 000 s/mm2。兴趣区选择为与执行功能相关脑区的皮层下白质区(额、顶皮层下白质及扣带回的扣带束)。DTI图像后处理由MRI专业技师采用Function软件处理并测出上述兴趣区的FA值。
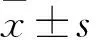
2 结果
2.1 两组治疗前后执行功能测试成绩比较 对照组治疗前后各项执行功能测试成绩差异无统计学意义。观察组FNS治疗后SCWT-C、VFT、TMT-A及TMT-B、CDT的测试成绩较治疗前有所提高(P均<0.05),且观察组治疗后各项执行功能测试成绩优于对照组治疗后(P均<0.05)。见表1。

表1 两组治疗前后执行功能测试成绩比较
注:与同组治疗前比较,*P<0.01,#P<0.05;与对照组治疗后比较,△P<0.01,▼P<0.05。
2.2 两组治疗前后执行功能相关脑区白质FA值比较 对照组治疗前后执行功能相关脑区白质FA值差异无统计学意义。观察组治疗后右额叶白质、左额叶白质、右顶叶白质、左顶叶白质、右扣带束、左扣带束的FA值均高于治疗前,且高于对照组治疗后(P均<0.05)。见表2。

表2 两组治疗前后执行功能相关脑区白质FA值比较
注:与同组治疗前比较,★P<0.05,△P<0.01;与对照组治疗后比较,◆P<0.05,◇P<0.01。
3 讨论
执行功能包括注意和抑制、任务管理、工作记忆、目标转移、监控功能及制定计划等[11]。多种量表可检测不同方面的执行功能。CDT涉及对执行功能的听理解、计划性、抗干扰、注意力的集中等多方面能力的考察。TMT-A可测试患者右大脑半球知觉的直线运动速度,TMT-B可测试左侧大脑半球的定势转移、概念的转换能力。SCWT-C结果反映患者的思维灵活性和对干扰的控制能力。VFT是一种对速度有要求的词语记忆作业,用于评价语义的流畅性。
已有研究[2]表明LA存在执行功能障碍,表现为患者计划性差、注意力不集中、思维不灵活、言语不流畅及易被干扰等。目前并无有效改善LA患者执行功能的方法或措施。本研究对照组在常规内科药物治疗前后执行功能测试成绩差异无统计学意义,表明内科常规药物治疗(如脑蛋白水解物)对LA患者执行功能的提高并无益处。观察组在FNS治疗后上述各项测试的成绩较治疗前及对照组治疗后均有明显改善,说明FNS能有效提高LA患者的执行功能,包括听理解、计划性、知觉运动速度、定势转移、语义的流畅性及干扰控制能力等。
脑执行功能的神经基础主要结构为额叶,还可能涉及扣带回、基底节、丘脑甚至顶叶。皮层下白质是神经纤维集中的地方,而后者是实现各脑功能区之间相互联系的物质基础。通过皮层下白质纤维形成与执行功能相关的3个皮层-皮层下环路:前额叶背外侧环路、额叶眶面外侧环路和前扣带回环路。研究[12]表明LA患者执行功能障碍可能是连接执行功能相关的皮层-皮层下环路的白质纤维损害的结果,如额叶皮层下白质损伤将导致计划决策、注意力和语言功能障碍,额叶-丘脑-顶叶皮层下白质纤维受损会影响工作记忆而出现首要目标被降序或置换[13],前扣带回环路中白质纤维受损会出现不能有效监控正在进行的目标定向行为。
代表水分子弥散运动各向异性大小的FA值与髓鞘的完整性、纤维致密性及平行性有密切关系,能够反映白质纤维是否完整[14]。LA患者不仅侧脑室旁白质和半卵圆中心区FA值降低,而且在常规MRI序列中看似正常的额颞顶叶、海马及胼胝体等区域的白质部位FA值也降低[15,16],这一方面说明上述看似正常部位的白质纤维微结构的完整性已有潜在破坏,另一方面也说明LA患者脑白质损害比我们想象的要广泛得多。广泛的白质损害会导致执行功能相关皮层-皮层下环路神经纤维有序的各向异性结构丧失,髓鞘完整性破坏,造成信息传递减弱或中断,从而导致执行功能障碍。
本研究结果显示,对照组治疗前后执行功能相关脑区白质FA值差异无统计学意义,说明内科常规药物治疗并不能改善LA患者执行功能相关脑区白质纤维微结构的完整性。用FNS治疗后,观察组右额叶白质、左额叶白质、右顶叶白质、左顶叶白质、右扣带束、左扣带束的FA值均高于治疗前,且高于对照组治疗后,表明FNS能改善LA患者执行功能相关脑区皮层下白质纤维微结构的完整性。推测其机制:①FNS治疗可能通过调节和扩张脑血管,增加白质局部缺血区的血流供应[17];②FNS治疗可激活机体“条件性中枢神经源性保护机制”,使全脑对缺血缺氧的耐受性提高,对脑白质局灶缺血产生保护性作用[18];③FNS治疗可抑制脑白质缺血性炎症反应,减轻谷氨酸等兴奋性递质的神经毒性,缩小白质区脱髓鞘的范围,促进神经轴突再生[19];④研究[20]发现细胞凋亡可能参与LA的形成,而FNS治疗可能抑制少突胶质细胞凋亡。
总之,经FNS治疗后,LA患者执行功能测试成绩提高,执行功能相关脑区皮层下白质纤维微结构的完整性得到改善。FNS有可能成为非药物性治疗LA患者执行功能障碍的一种手段。然而本研究纳入样本量较少,上述结论还需要大样本多中心的临床研究进行验证;FNS治疗改善LA患者执行功能的机制尚有待于进一步阐明。
[1] Henon H, Vroylandt P, Durieu I, et al. Leukoaraiosis more than dementia is a predictor of stroke recurrence [J]. Stroke, 2003,34(12):2935-2940.
[2] Li C, Ling X, Liu S, et al. Abnormalities of magnetic resonance spectroscopy and diffusion tensor imaging are correlated with executive dysfunction in patients with ischemic leukoaraiosis[J]. J Clin Neurosci, 2012,19(5):718-722.
[3] 姜利伶,赵建农,周治明,等.小脑顶核电刺激对阿尔茨海默病磁共振波谱代谢物的影响[J].中国医学影像技术,2016,32(2):183-186.
[4] Godefroy O, Azouvi P, Robert P, et al. Dysexecutive syndrome: diagnostic criteria and validation study[J]. Ann Neurol, 2010,68(6):855-864.
[5] Ryan DJ, Byrne S, Dunne R, et al. White matter disease and an incomplete circle of Willis[J]. Int J Stroke, 2015,10(4):547-552.
[6] Aharon-Peretz J, Cummings JL, Hill MA. Vascular dementia and dementia of the Alzheimer type. Cognition, ventricular size, and leukoaraiosis[J]. Arch Neurol, 1988,45(7):719-721.
[7] Morrow SA. Normative data for the Stroop color word test for a North American population [J]. Can J Neurol Sci, 2013,40(6):842-847.
[8] Canning SJ, Leach L, Stuss D, et al. Diagnostic utility of abbreviated fluency measures in Alzheimer disease and vascular dementia[J]. Neurology, 2004,62(4):556-562.
[9] O′Sullivan M, Morris RG, Markus HS. Brief cognitive assessment for patients with cerebral small vessel disease [J]. J Neurol Neurosurg Psychiatry, 2005,76(8):1140-1145.
[10] 陆骏超,郭起浩,洪震,等.连线测验(中文修订版)在早期识别阿尔茨海默病中的作用[J].中国临床心理学杂志,2006,14(2):118-120.
[11] Royall DR, Lauterbach EC, Cummings JL, et al. Executive control function: a review of its promise and challenges for clinical research. A report from the Committee on Research of the American Neuropsychiatric Association[J]. J Neuropsychiatry Clin Neurosci, 2002,14(4):377-405.
[12] 李踔,倪朝民,张健,等.缺血性脑白质疏松患者执行功能损害的康复治疗[J].中国康复医学杂志,2014,29(7):642-645.
[13] Levine B, Schweizer TA, O′Connor C, et al. Rehabilitation of executive functioning in patients with frontal lobe brain damage with goal management training[J]. Front Hum Neurosci, 2011,5(9):1-9.
[14] Puig J, Pedraza S, Blasco G,et al. Acute damage to the posterior limb of the internal capsule on diffusion tensor tractography as an early imaging predictor of motor outcome after stroke[J]. AJNR Am J Neuroradiol, 2011,32(5):857-863.
[15] 张晖,王勇,耿左军,等.超高场强磁共振扩散张量成像对脑白质疏松症的诊断价值[J].中华老年心脑血管病杂志,2012,14(10):1028-1031.
[16] 张帅.弥散张量成像在缺血性脑白质疏松症中的应用初步研究[J].现代诊断与治疗,2013,24(17):3841-3844.
[17] Chida K, Iadecola C, Underwood MD, et al. A novel vasodepressor response elicited from the rat cerebellar fastigial nucleus: the fastigial depressor response [J]. Brain Res, 1986,370(2):378-382.
[18] 董伟为.电刺激小脑顶核与中枢神经源性神经保护[J].中国工程科学,2001,11(3):32-38.
[19] 李小丽,贾天明,栾斌,等.电刺激小脑顶核对缺氧缺血性脑损伤新生鼠海马神经胶质细胞的影响[J].中国当代儿科杂志,2011,13(4):317-320.
[20] Brown WR, Moody DM, Challa VR, et al. Apoptosis in leukoaraiosis lesions [J]. J Neurol Sci, 2002,203-204:169-171.
曾非(E-mail: fwf197923@163.com)
10.3969/j.issn.1002-266X.2017.27.020
R741.05
B
1002-266X(2017)27-0067-04
2017-04-26)

