减量施氮与间作模式对甜玉米AMF侵染和大豆结瘤及作物氮磷吸收的影响*
周贤玉, 唐艺玲, 王志国,王建武**
减量施氮与间作模式对甜玉米AMF侵染和大豆结瘤及作物氮磷吸收的影响*
周贤玉, 唐艺玲, 王志国,王建武**
(华南农业大学热带亚热带生态研究所/农业部华南热带农业环境重点实验室/广东省高等学校农业生态和农村环境重点实验室 广州 510642)
通过4季(2014年秋季, 2015年春、秋, 2016年春季)大田定位试验, 对比研究了两种施氮水平[300 kg·hm-2(N1: 减量施氮)和360 kg·hm-2(N2: 常规施氮)]和4种种植模式[甜玉米||菜用大豆2∶3(S2B3)、2∶4(S2B4)间作、甜玉米单作(SS)和菜用大豆单作(SB)]对华南地区甜玉米和大豆产量、甜玉米AMF侵染率、大豆根瘤菌等的影响。结果表明, 减量施氮间作处理的甜玉米产量显著高于单作。2016年春季S2B3-N1处理大豆的根瘤数显著高于S2B3-N2处理; 4季减量施氮和间作处理对大豆根瘤干重均没有显著影响。2015年春秋两季两种施氮水平间作处理的甜玉米生物量和氮含量均显著高于相应的单作处理; 且减量施氮间作模式甜玉米AMF侵染率显著高于常规施氮处理。2015年秋季减量施氮间作模式处理甜玉米的磷含量显著高于单作处理。减量施氮与间作菜用大豆显著提高了甜玉米氮和磷含量、AMF侵染率、生物量及产量, 是华南地区甜玉米资源高效利用的可持续生产模式。
减量施氮; 甜玉米||菜用大豆间作; 氮吸收; 磷吸收; 根瘤菌; 丛枝菌根真菌
广东省甜玉米()种植面积约占全国60%, 是我国重要的甜玉米生产基地和消费大省[1], 其生产模式为一年2~3熟。农民为了追求高产和经济效益, 普遍过量施用化学氮肥, 其利用率仅为26%~28%, 大部分的氮素以地表径流、氨挥发和氮淋溶等形式流失, 带来一系列的生态环境问题[2-4]。研究表明, 豆科-禾本科作物间作可以提高豆科作物的固氮能力[5], 增加氮素转移[6], 产生“氮阻遏”消减作用, 实现氮素高效利用[7]。玉米和大豆(L.)套种模式中, 施氮量(330 kg×hm-2)减少18%和36%的处理均能促进大豆根瘤的形成, 距离玉米15 cm处施肥处理的大豆根瘤固氮能力较强[8]。Afza等[9]认为适量施肥有利于大豆根瘤的形成和生长, 但也有大豆生产中施氮量达30.38 kg×hm-2时会显著抑制大豆根瘤的形成和生长的报道[10], 大豆与玉米套作时大豆根瘤数及根瘤鲜重显著下降[11]。玉米具有发达的须根, 很容易与丛枝菌根真菌(arbuscular mycorrhizal fungi, AMF)形成共生关系, 丛枝菌根共生体中AMF根外菌丝可以利用NH4+、NO3-和简单形态的氨基酸, 加速有机氮的矿化, AMF的菌丝与植物的根系形成菌丝网络(common mycorrhizal networks, CMNs)连接根与土壤, 扩大了根部对营养的吸收[12]。易受AMF侵染的植物对施氮较为敏感, AMF只有在一定施氮量的基础上才能促进作物的生长, 但施氮量过高也会影响AMF的侵染[13]。AMF对玉米植株的氮贡献率可高达总氮的74%[14], 玉米大豆间作体系中接种AMF和根瘤菌后大豆向玉米转移了20%~43%的氮[15], 双接种(AMF和根瘤菌)比单接种AMF大豆向玉米转移的N提高了45%[16], 双接种具有协同增效作用[17]。
目前很多研究都是室内灭菌土壤盆栽单接种或双接种试验, 未能消除接种AMF或根瘤菌对植物生长的影响, 鲜有关于间作模式土著AMF和根瘤菌互惠共生关系的报道[12,17]。本文拟在田间研究减量施氮与甜玉米大豆间作对土著AMF和根瘤菌的影响, 旨在为建立华南地区甜玉米科学、高效的可持续生产模式提供理论依据。
1 材料与方法
1.1 试验区概况
试验于2014年8月至2016年6月在华南农业大学教学实验基地(23.08°N, 113.15°E)进行。该试验区属于典型亚热带季风海洋气候。年日照时数1 289~1 780 h; 年降雨量1 384~2 278mm, 约85%的降水集中在4—9月。试验地土壤为赤红壤, 耕层土壤有机质20.28 g∙kg-1, 速效氮75.50 g∙kg-1, 速效磷74.69 g∙kg-1, 速效钾72.59 g∙kg-1, pH 5.2。
1.2 供试材料
供试玉米品种为‘华珍1号’, 购于广州市南沙区绿田种子经营部。春季供试菜用大豆为‘毛豆3号’, 夏季为‘上海青’, 由华南农业大学农学院提供。
1.3 试验设计
试验采用施氮水平和种植模式二因素随机区组设计(表1)。施氮水平为N1减量施氮300 kg×hm-2和N2常规施氮360 kg×hm-2, 种植模式为S2B3(甜玉米||大豆的2行∶3行间作)、S2B4(甜玉米||大豆的2行∶4行间作)、SS(甜玉米单作)和SB(大豆单作)。每个处理重复3次, 小区面积为4.8 m×3.7 m=17.76 m2。间作模式中甜玉米和大豆之间行距为30 cm, 相邻的甜玉米之间行距为50 cm, 相邻大豆之间行距为30 cm。甜玉米单作模式的行距为60 cm, 大豆单作模式行距为30 cm。各处理中甜玉米株距为30 cm, 大豆株距为20 cm。甜玉米每穴种1株, 大豆每穴种3株。间作和单作甜玉米净占面积的种植密度分别为67 568株×hm-2和54 054株×hm-2, 间作和单作大豆净占面积的种植密度均为486 486株×hm-2。详细的试验设计和施肥方案等参见唐艺玲等[18]。
2014年秋季、2015年春季、2015年秋季和2016春季分别于8月9日、3月15日、8月10日和3月12播种大豆并育苗甜玉米, 8月19日、3月29日、8月20日和4月2日移栽甜玉米至大田, 10月19日、6月3日、10月31日和5月30日收获大豆, 10月26日、6月3日、10月29日和6月7日收获玉米。
4季施氮肥时间: 8月28日、3月31日、9月5日和4月9日施基肥, 9月20日、4月18日、9月20日和5月2日施拔节肥, 10月6日、5月24日、10月8日和5月30日施穗肥。

表1 甜玉米||大豆间作各试验处理的田间设计及施肥量
1.4 样品采集与分析
1.4.1 作物产量、生物量及土地当量比
作物成熟后, 在甜玉米和大豆的两个间作带各连续取10株, 在单作小区取20株, 测定甜玉米鲜穗和大豆鲜豆荚的产量和生物量。并计算土地当量比(LER)[19]:
LER=is/ss+ib/sb(1)
式中:is、ib分别为间作甜玉米、大豆的产量(kg×m-2),ss、sb分别为单作甜玉米、大豆的产量(kg×m-2)。若LER>1, 表明有间作优势; 若LER<1, 为间作劣势。
1.4.2 大豆根瘤菌测定
大豆结荚期(2014年秋季10月15日、2015年春季5月16日、2015年秋季10月11日和2016春季5月8日), 在与甜玉米间作的大豆带和大豆单作小区各连续取10株大豆, 记录各株大豆根瘤数, 自然风干后称量。
1.4.3 甜玉米AMF侵染率测定
2015年秋季和2016年春季, 于甜玉米生长40 d后, 在两个间作带连续取甜玉米2株, 将根系清洗干净。选取30条直径为1 mm的根系曲利苯蓝染色后显微观察, 根据根段中菌根侵染(0、<1%、<10%、<50%、>50%和>90%)的标准, 定义每一条根, 用“Mycocalc”软件计算出AMF侵染密度[20]。
1.4.4 作物氮磷含量测定
作物成熟后单作小区和间作小区间作带连续各取3株甜玉米和大豆, 105 ℃下杀青40 min, 80 ℃烘干至恒重。高速万用粉碎机研磨凯氏定氮法[21]测定植株全氮含量, 钒钼黄比色法[21]测定甜玉米植株全磷含量。
1.5 数据分析
采用Microsoft Excel 2003和SPSS 20软件进行数据统计分析, 采用Duncan多重比较方法检验差异显著性(=0.05), 图表中数据为平均值±标准误。
2 结果与分析
2.1 减量施氮与间作大豆对系统产量和土地当量比的影响
4季试验相同种植模式、不同施氮水平的甜玉米和大豆产量均没有显著差异(2015年春季S2B4模式的大豆和2016年春季S2B4模式甜玉米产量除外), 表明减量施氮不会影响作物产量(表2)。相同施氮水平4季间作甜玉米产量均显著高于单作(2015年春季N1种植模式除外); 而大豆的产量表现为2014年秋季和2016年春季间作和单作没有显著差异, 2015年春季和2015年秋季则单作显著高于间作。华南地区春秋及年际间的气候条件, 尤其是降雨量对大豆产量有较大的影响。
2014年秋季和2016年春季各间作处理的土地当量比均大于1(图1), 说明甜玉米和菜用大豆间作能够提高单位面积的土地利用率, 具有一定的间作优势。由于2015年春季和2015年秋季大豆单作的产量显著高于间作, 导致2015年各处理土地当量比小于或接近1。总体来看, 除2016年常规施氮S2B4模式土地当量比显著高于S2B3外, 其他处理均没有显著变化。
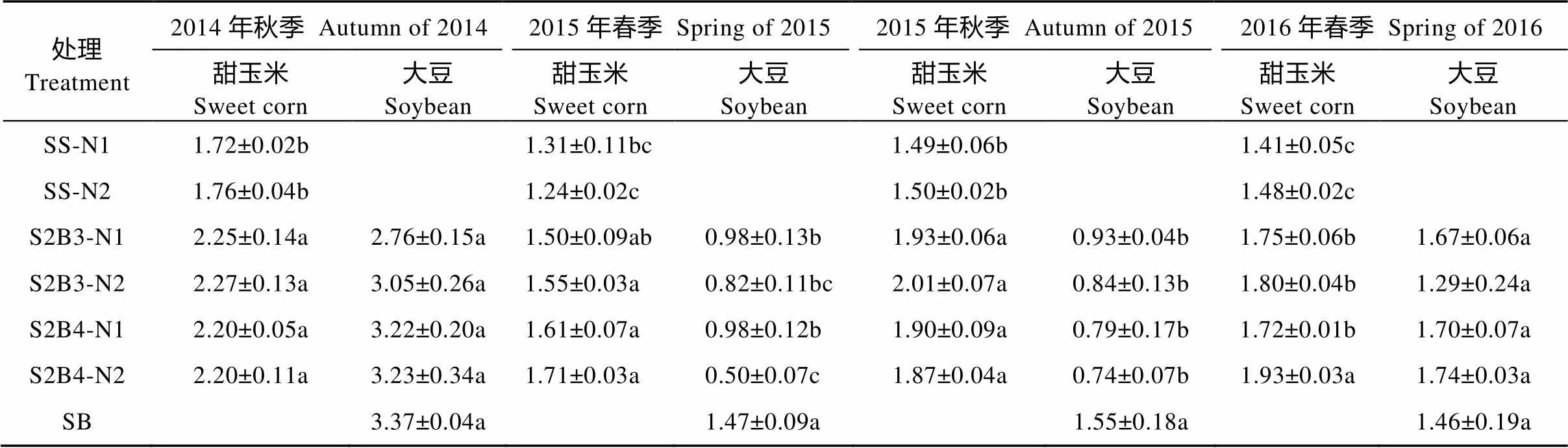
表2 2014年秋—2016年春不同处理下甜玉米||大豆间作系统的作物产量
图1 2014年秋—2016年春不同处理下甜玉米||大豆间作系统土地当量比(LER)
Fig. 1 Land equivalent ratio (LER) of sweet corn/soybean intercropping system from the autumn of 2014 to the spring of 2016 under different treatments
2.2 减量施氮与间作大豆对大豆根瘤菌及N积累的影响
相同种植模式下减量施氮处理单株大豆根瘤数(2014年秋季S2B3和2015年秋季S2B4除外)和单株大豆根瘤干重(2015年秋季S2B4和2016年春季S2B4除外)大于常规施氮处理(表3)。4季平均而言, 减量施氮S2B3模式的大豆单株根瘤数和单株根瘤干重比常规施氮处理分别提高34.49%和62.01%, S2B4模式也分别提高2.76%和14.01%; 减量施氮S2B3和S2B4模式单株大豆根瘤数分别比SB下降10.65%和13.70%, S2B3和S2B4的单株大豆根瘤干重分别比SB下降11.50%和13.02%; 常规施氮S2B3和S2B4的单株大豆根瘤数分别比SB下降29.65%和13.58%, S2B3和S2B4的单株大豆根瘤干重分别比SB下降45.11%%和20.67%。说明减量施氮可以提高大豆单株根瘤数和根瘤干重, 而间作则会降低大豆单株根瘤数和根瘤干重。
4季间作模式的菜用大豆植株氮含量小于大豆单作(表4)。4季平均而言, S2B3-N1和S2B4-N1菜用大豆植株的氮含量分别比SB下降21.01%和15.33%, S2B3-N2和S2B4-N2菜用大豆植株的氮含量分别比SB下降16.68%和18.49%。不施化学氮肥的单作大豆N素累积要高于施化肥的间作处理, 说明化学氮肥的投入抑制了大豆的生物固氮效率[22]。在相同施氮水平下, 4季间作系统中甜玉米植株的氮含量高于甜玉米单作。4季平均而言, S2B3-N1和S2B4-N1的甜玉米氮积累分别比SS-N1提高27.64%和13.49%, S2B3-N2和S2B4-N2的甜玉米氮积累分别比SS-N2提高29.27%和24.34%, 说明与大豆间作提高了甜玉米氮积累。
2.3 减量施氮与间作大豆对甜玉米AMF侵染率和磷积累的影响
减量施氮间作模式甜玉米根系AMF的侵染率高于常规施氮处理(表5)。2季平均而言, S2B3-N1的甜玉米AMF侵染率比S2B3-N2提高83.38%, S2B4-N1比S2B4-N2提高76.57%。减量施氮间作模式甜玉米根系AMF的侵染率高于单作甜玉米。2季平均而言, N1水平下S2B3和S2B4的甜玉米AMF侵染率分别比SS提高41.07%和72.31%。说明低氮间作能够提高AMF对甜玉米的侵染。
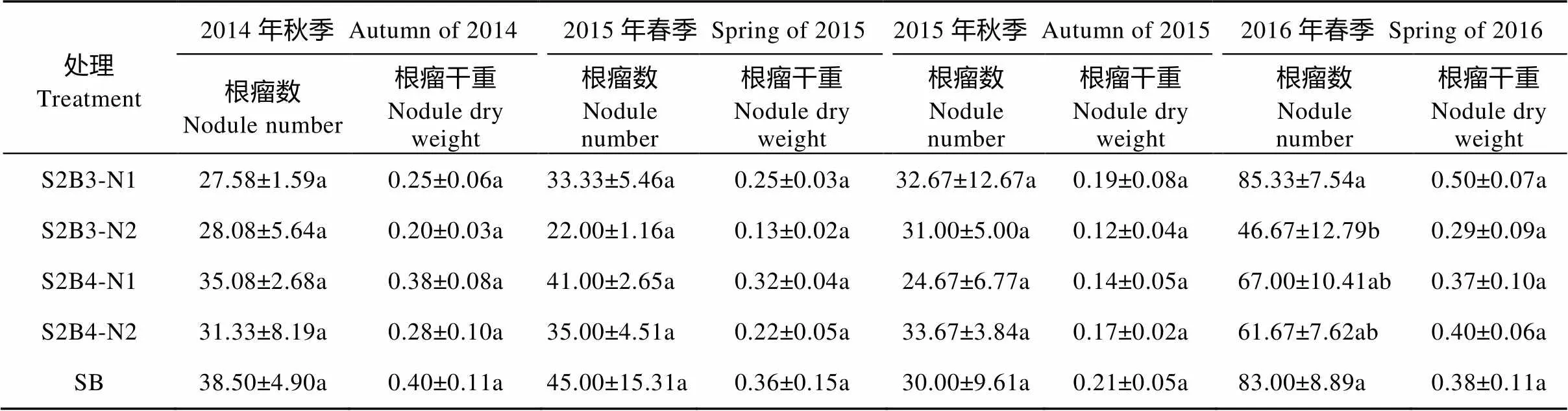
表3 2014年秋—2016年春不同处理下甜玉米||大豆间作系统中大豆根瘤的性状(单株)

表4 2014年秋—2016年春不同处理下甜玉米||大豆间作系统中甜玉米和大豆氮的积累
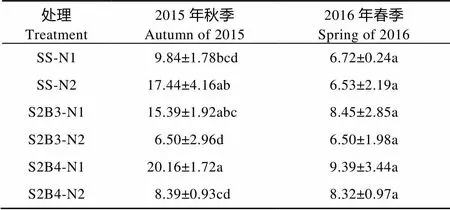
表5 2015年秋—2016年春不同处理下甜玉米||大豆间作系统中甜玉米根系AMF侵染率
4季相同施氮水平间作甜玉米植株磷含量高于单作甜玉米(表6)。4季平均而言, S2B3-N1和S2B4- N1的甜玉米磷积累分别比SS-N1提高27.95%和19.23%, S2B3-N2和S2B4-N2的甜玉米磷积累分别比SS-N2提高26.77%和18.70%, 说明间作大豆提高了甜玉米磷的积累。相同种植模式两种施氮甜玉米磷的积累无显著差异。
相同种植模式两种施氮水平对甜玉米和大豆生物量的影响均无显著差异(表7)。4季相同施氮水平间作模式甜玉米植株的生物量高于单作。平均而言, S2B3-N1和S2B4-N1的甜玉米生物量分别比SS-N1提高34.05%和23.75%, S2B3-N2和S2B4-N2则分别比SS-N2提高31.09%和24.67%; 4季间作模式大豆植株的生物量低于单作, S2B3-N1和S2B4-N1分别比SB降低15.27%和17.09%, S2B3-N2和S2B4-N2分别比SB降低22.55%和16.03%。说明间作能提高甜玉米的生物量, 但降低了大豆的生物量。

表6 2014年秋—2016年春不同处理下甜玉米||大豆间作系统中甜玉米对磷的积累
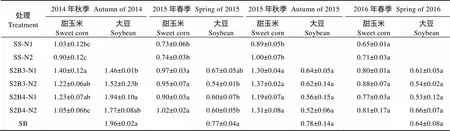
表7 2014年秋—2016年春不同处理下甜玉米||大豆间作系统中甜玉米和大豆的地上部生物量
3 结论与讨论
3.1 减量施氮和间作对作物产量的影响
本试验中, 作物产量受种植模式影响显著。间作甜玉米产量显著高于单作, 但间作却降低了大豆产量。玉米||大豆间作有利于光在群体中的分布和利用, 改善了田间通风透光条件, 增强了玉米光合作用能力, 降低了大豆的光合利用率[23]。间作甜玉米产量的增加, 可能是大豆结瘤固氮, 也可能是间作甜玉米AMF侵染率的提高促进了其对磷的吸收。本试验的减量施氮处理没有引起甜玉米和大豆的产量下降, 可见300 kg×hm-2施氮量已经能够满足作物生长需求。吴科生等[24]通过接种根瘤菌试验证明豌豆()与玉米间作模式施氮量为300 kg·hm-2时玉米的产量最高, 施氮量增加反而使产量下降。本试验2015年春季受台风影响甜玉米发生了严重的倒伏, 2015年秋季降雨量较大, 影响了作物生长。
3.2 减量施氮与间作大豆对根瘤菌的影响
根瘤菌是豆科植物与土壤根瘤细菌特异性结合的结果[25-26], 豆科作物不仅能够利用自身的根瘤菌固氮, 还可能将固定的氮素转移给邻近的植物[27-28], 可以减少氮肥投入并提高作物的产量[29]。本研究中, 甜玉米和大豆间作降低了大豆的结瘤数和根瘤的干重, 这与于晓波等[11]研究结果一致, 可能是间作环境中大豆受高位玉米的隐蔽, 光合产物优先供给地上部生长[30-31], 造成了对大豆根瘤数和干重的调控[30,32]。但也有许多学者发现, 间作可以提高豆科作物的结瘤水平[33-35]。间作减量施氮有利于大豆结瘤和根瘤干重的提高, 但本试验中间作大豆的单株根瘤数和干重与单作大豆相比有所下降, 这可能是甜玉米施用的氮肥在雨水和灌溉的作用下运移到大豆间作带, 影响了间作大豆的结瘤状况。
3.3 减量施氮与间作大豆对甜玉米AMF侵染的影响
本研究结果表明, 减量施氮与间作大豆有利于AMF对甜玉米根系的侵染, 不同程度提高了其磷的积累, 同时也增加了生物量。这与肖同建等[36]在水稻()-绿豆()间作的研究结果一致。与单作玉米相比, 间作甜玉米提高了物种的多样性, AMF丰富度增加, 提高了AMF对甜玉米的侵染率[36-39]。AMF的侵染率随着施氮水平的升高而降低[40], 这与本试验减量施氮AMF的侵染率高于常规施氮的研究结果一致。
综上所述, 4季的大田试验研究表明, 间作大豆可以提高甜玉米产量, 300 kg×hm-2的施氮量能够满足甜玉米和大豆高产的N素需求。减量施氮有利于大豆结瘤和根瘤的生长, 提高大豆对氮素的积累。减量施氮与间作大豆可促进土著AMF对甜玉米根系的侵染, 增强其对氮和磷的吸收, 促进作物生长, 提高生物量。施氮量为300 kg×hm-2的甜玉米||大豆间作能够发挥土著AMF和土著根瘤菌互惠共生作用, 减少化学氮肥投入, 保持高产, 提高资源利用效率, 是华南集约化农区甜玉米生产的一种资源高效利用可持续生产模式。
[1] 刘馨芬. 广东省甜玉米产业发展现状与对策研究[D]. 广州: 仲恺农业工程学院, 2016Liu X F. The industry status and development countermeasures of sweet corn in Guangdong Province[D]. Guangzhou: Zhongkai University of Agriculture and Engineering, 2016
[2] 张福锁, 王激清, 张卫峰, 等. 中国主要粮食作物肥料利用率现状与提高途径[J]. 土壤学报, 2008, 45(5): 915–924Zhang F S, Wang J Q, Zhang W F, et al. Nutrient use efficiencies of major cereal crops in China and measures for improvement[J]. Acta Pedologica Sinica, 2008, 45(5): 915–924
[3] 郭丽琢, 张虎天, 何亚慧, 等. 根瘤菌接种对豌豆/玉米间作系统作物生长及氮素营养的影响[J]. 草业学报, 2012, 21(1): 43–49Guo L Z, Zhang H T, He Y H, et al. Effect of rhizobium inoculation on crop growth and nitrogen nutrition of a pea/maize intercropping system[J]. Acta Prataculturae Sinica, 2012, 21(1): 43–49
[4] Pappa V A, Rees R M, Walker R L, et al. Nitrous oxide emissions and nitrate leaching in an arable rotation resulting from the presence of an intercrop[J]. Agriculture, Ecosystems & Environment, 2011, 141(1/2): 153–161
[5] Li Y K, Li B, Guo W Z, et al. Effects of nitrogen application on soil nitrification and denitrification rates and N2O emissions in greenhouse[J]. Journal of Agricultural Science & Technology, 2015, 17(2): 519–530
[6] Li L, Tilman D, Lambers H, et al. Plant diversity and overyielding: Insights from belowground facilitation of intercropping in agriculture[J]. New Phytologist, 2014, 203(1): 63–69
[7] 李隆. 间套作体系豆科作物固氮生态学原理与应用[M]. 北京: 中国农业大学出版社, 2013 Li L. The Ecological Principles and Applications of Biological N2Fixation in Legumes-Based Intercropping Systems[M]. Beijing: China Agricultural University Press, 2013
[8] 雍太文, 董茜, 刘小明, 等. 施肥方式对玉米-大豆套作体系氮素吸收利用效率的影响[J]. 中国油料作物学报, 2014, 36(1): 84–91Yong T W, Dong Q, Liu X M, et al. Effect of N application methods on N uptake and utilization efficiency in maize-soybean relay strip intercropping system[J]. Chinese Journal of Oil Crop Sciences, 2014, 36(1): 84–91
[9] Afza R, Hardarson G, Zapata F, et al. Effects of delayed soil and foliar N fertilization on yield and N2fixation of soybean[J]. Plant and Soil, 1987, 97(3): 361–368
[10] 宋秀丽. 不同氮肥施用量对大豆生长状况的影响[J]. 黑龙江农业科学, 2015, (6): 39–43Song X L. Effect of different nitrogen fertilizer amount on the growth of soybean[J]. Heilongjiang Agricultural Sciences, 2015, (6): 39–43
[11] 于晓波, 苏本营, 龚万灼, 等. 玉米-大豆带状套作对大豆根瘤性状和固氮能力的影响[J]. 中国农业科学, 2014, 47(9): 1743–1753Yu X B, Su B Y, Gong W Z, et al. The nodule characteristics and nitrogen fixation of soybean in maize-soybean relay strip intercropping[J]. Scientia Agricultura Sinica, 2014, 47(9): 1743–1753
[12] 韦莉莉, 卢昌熠, 丁晶, 等. 丛枝菌根真菌参与下植物—土壤系统的养分交流及调控[J]. 生态学报, 2016, 36(14): 4233–4243 Wei L L, Lu C Y, Ding J, et al. Functional relationships between arbuscular mycorrhizal symbionts and nutrient dynamics in plant-soil-microbe system[J]. Acta Ecologica Sinica, 2016, 36(14): 4233–4243
[13] Wallander H, Nylund J E. Nitrogen nutrition and mycorrhiza development[J]. Agriculture, Ecosystems & Environment, 1991, 28(1/4): 547–552
[14] Tanaka Y, Yano K. Nitrogen delivery to maize via mycorrhizal hyphae depends on the form of N supplied[J]. Plant, Cell & Environment, 2005, 28(10): 1247–1254
[15] Meng L B, Zhang A Y, Wang F, et al. Arbuscular mycorrhizal fungi and rhizobium facilitate nitrogen uptake and transfer in soybean/maize intercropping system[J]. Frontiers in Plant Science, 2015, 6: 339
[16] Wang M M, Wang S P, Wu L W, et al. Evaluating the lingering effect of livestock grazing on functional potentials of microbial communities in Tibetan grassland soils[J]. Plant and Soil, 2016, 407(1/2): 385–399
[17] 陈永亮, 陈保冬, 刘蕾, 等. 丛枝菌根真菌在土壤氮素循环中的作用[J]. 生态学报, 2014, 34(17): 4807–4815 Chen Y L, Chen B D, Liu L, et al. The role of arbuscular mycorrhizal fungi in soil nitrogen cycling[J]. Acta Ecologica Sinica, 2014, 34(17): 4807–4815
[18] 唐艺玲, 管奥湄, 周贤玉, 等. 减量施氮与间作大豆对华南地区甜玉米连作农田N2O排放的影响[J]. 中国生态农业学报, 2015, 23(12): 1529–1535 Tang Y L, Guan A M, Zhou X Y, et al. Effect of reduced N application and soybean intercropping on soil N2O emission in sweet corn fields in South China[J]. Chinese Journal of Eco-Agriculture, 2015, 23(12): 1529–1535
[19] 章莹, 王建武, 王蕾, 等. 减量施氮与大豆间作对蔗田土壤温室气体排放的影响[J]. 中国生态农业学报, 2013, 21(11): 1318–1327 Zhang Y, Wang J W, Wang L, et al. Effect of low nitrogen application and soybean intercrop on soil greenhouse gas emission of sugarcane field[J]. Chinese Journal of Eco-Agriculture, 2013, 21(11): 1318–1327
[20] Trouvelot A, Kough J L, Gianinazzi-Pearson V. Mesure du taux de mycorhization VA d'un systeme radiculaire. Recherche de methodes d'estimation ayant une signification fonctionnelle[C]//Gianinazzi-Pearson V, Gianinazzi S. Physiological and Genetical Aspects of Mycorrhizae. Paris: INRA, 1986: 217–221
[21] 鲍士旦. 土壤农化分析[M]. 北京: 农业出版, 2000: 49–83 Bao S D. Soil and Agricultural Chemistry Analysis[M]. 3rd ed. Beijing: China Agriculture Press, 2000: 49–83
[22] 房增国, 赵秀芬, 孙建好, 等. 接种根瘤菌对蚕豆/玉米间作系统氮营养的影响[J]. 华北农学报, 2009, 24(4): 124–128 Fang Z G, Zhao X F, Sun J H, et al. Effects of rhizobium inoculation on nitrogen nutrition in fababean/maize intercropping system[J]. Acta Agriculturae Boreali-Sinica, 2009, 24(4): 124–128
[23] 高阳, 段爱旺, 刘祖贵, 等. 单作和间作对玉米和大豆群体辐射利用率及产量的影响[J]. 中国生态农业学报, 2009, 17(1): 7–12 Gao Y, Duan A W, Liu Z G, et al. Effect of monoculture and intercropping on radiation use efficiency and yield of maize and soybean[J]. Chinese Journal of Eco-Agriculture, 2009, 17(1): 7–12
[24] 吴科生, 宋尚有, 李隆, 等. 氮肥和接种根瘤菌对豌豆/玉米间作产量和水分利用效率的影响[J]. 中国生态农业学报, 2014, 22(11): 1274–1280Wu K S, Song S Y, Li L, et al. Effects of nitrogen fertilizer application and rhizobial inoculation on yield and water use efficiency of pea/maize intercropping system[J]. Chinese Journal of Eco-Agriculture, 2014, 22(11): 1274–1280
[25] Peters N K, Frost J W, Long S R. A plant flavone, luteolin, induces expression ofnodulation genes[J]. Science, 1986, 233(4767): 977–980
[26] Hirsch A M. Tansley review No. 40: Developmental biology of legume nodulation[J]. New Phytologist, 1992, 122(2): 211–237
[27] Cardoso E J B N, Nogueira M A, Ferraz S M G. Biological N2fixation and mineral N in common bean-maize intercropping or sole cropping in Southeastern Brazil[J]. Experimental Agriculture, 2007, 43(3): 319–330
[28] Li L, Sun J H, Zhang F S, et al. Wheat/maize or wheat/soybean strip intercropping I. Yield advantage and interspecific interactions on nutrients[J]. Field Crops Research, 2001, 71(2): 123–137
[29] Tsubo M, Walker S, Ogindo H O. A simulation model of cereal-legume intercropping systems for semi-arid regionsⅠ. Model application[J]. Field Crops Research, 2005, 93(1): 10–22
[30] 王竹, 杨文钰, 伍晓燕, 等. 玉米株型和幅宽对套作大豆初花期形态建成及产量的影响[J]. 应用生态学报, 2008, 19(2): 323–329Wang Z, Yang W Y, Wu X Y, et al. Effects of maize plant type and planting width on the early morphological characters and yield of relayplanted soybean[J]. Chinese Journal of Applied Ecology, 2008, 19(2): 323–329
[31] 刘卫国, 蒋涛, 佘跃辉, 等. 大豆苗期茎秆对荫蔽胁迫响应的生理机制初探[J]. 中国油料作物学报, 2011, 33(2): 141–146 Liu W G, Jiang T, She Y H, et al. Preliminary study on physiological response mechanism of soybean () stem to shade stress at seedling stage[J]. Chinese Journal of Oil Crop Sciences, 2011, 33(2): 141–146
[32] 周相娟, 梁宇, 沈世华, 等. 接种根瘤菌和遮光对大豆固氮和光合作用的影响[J]. 中国农业科学, 2007, 40(3): 478–484Zhou X J, Liang Y, Shen S H, et al. Effects of rhizobial inoculation and shading on nitrogen fixation and photosynthesis of soybean[J]. Scientia Agricultura Sinica, 2007, 40(3): 478–484
[33] 胡举伟, 朱文旭, 张会慧, 等. 桑树/大豆间作对植物生长及根际土壤微生物数量和酶活性的影响[J]. 应用生态学报, 2013, 24(5): 1423–1427Hu J W, Zhu W X, Zhang H H, et al. Effects of mulberry/soybean intercropping on the plant growth and rhizosphere soil microbial number and enzyme activities[J]. Chinese Journal of Applied Ecology, 2013, 24(5): 1423–1427
[34] Li Y Y, Yu C B, Cheng X, et al. Intercropping alleviates the inhibitory effect of N fertilization on nodulation and symbiotic N2fixation of faba bean[J]. Plant and Soil, 2009, 323(1/2): 295–308
[35] Banik P, Sharma R C. Yield and resource utilization efficiency in baby corn-legume-intercropping system in the Eastern Plateau of India[J]. Journal of Sustainable Agriculture, 2009, 33(4): 379–395
[36] 肖同建, 杨庆松, 冉炜, 等. 接种菌根真菌的旱作水稻-绿豆间作系统养分利用研究[J]. 中国农业科学, 2010, 43(4): 753–760Xiao T J, Yang Q S, Ran W, et al. Effect of inoculation with arbuscular mycorrhizal fungus on nitrogen and phosphorus utilization in upland rice-mungbean intercropping system[J]. Scientia Agricultura Sinica, 2010, 43(4): 753–760
[37] 马玲, 马琨, 汤梦洁, 等. 间作与接种AMF对连作土壤微生物群落结构与功能的影响[J]. 生态环境学报, 2013, 22(8): 1341–1347Ma L, Ma K, Tang M J, et al. Effects of intercropping and inoculation of AMF on the microbial community structure and function of continuous cropping soil[J]. Ecology and Environmental Sciences, 2013, 22(8): 1341–1347
[38] Wortman S E, Drijber R A, Francis C A, et al. Arable weeds, cover crops, and tillage drive soil microbial community composition in organic cropping systems[J]. Applied Soil Ecology, 2013, 72: 232–241
[39] 马琨, 杨桂丽, 马玲, 等. 间作栽培对连作马铃薯根际土壤微生物群落的影响[J]. 生态学报, 2016, 36(10): 2987–2995Ma K, Yang G L, Ma L, et al. Effects of intercropping on soil microbial communities after long-term potato monoculture[J]. Acta Ecologica Sinica, 2016, 36(10): 2987–2995
[40] 王晓英, 王冬梅, 黄益宗. 不同施氮水平下AMF群落对白三叶草生长及养分吸收的影响[J]. 北京林业大学学报, 2011, 33(2): 143–148 Wang X Y, Wang D M, Huang Y Z. Effects of AMF community on the growth and nutrient uptake of white clover at different N supply levels[J]. Journal of Beijing Forestry University, 2011, 33(2): 143–148
Effects of reduced nitrogen application and intercropping on sweet corn AMF colonization, soybean nodulation and nitrogen and phosphorus absorption*
ZHOU Xianyu, TANG Yiling, WANG Zhiguo, WANG Jianwu**
(Institute of Tropical and Subtropical Ecology, South China Agricultural University / Key Laboratory of Agro-environment in the Tropics, Ministry of Agriculture / Key Laboratory of Agro-ecology and Rural Environment of Guangdong Regular Higher Education Institutions, Guangzhou 510642, China)
In order to explore a sustainable pattern of sweet corn production in South China, a field experiment was carried out in Guangzhou over the period of 4 growing seasons — autumn of 2014, spring and autumn of 2015 and spring of 2016. The study investigated the effects of 2 N fertilizer levels [300 kg×hm-2(N1, reduced N dose) and 360 kg×hm-2(N2, conventional N dose)] and 4 planting patterns [sweet corn/vegetable soybean intercropping with 2∶3 (S2B3) and 2∶4 (S2B4) line ratios, sole sweet corn (SS) and sole soybean (SB)] on yield of sweet corn and soybean, degree of arbuscular mycorrhizal fungi (AMF) colonization of sweet corn and soybean rhizobia. The results showed that the yield of sweet corn under reduced N application and intercropping treatment was significantly higher than that under monoculture. In spring of 2016, nodule number of soybean under S2B3-N1 treatment was significantly higher than that under S2B3-N2 treatment. In the 4 seasons of the experiment, dry weight of soybean nodule was not affected by reduced N application and intercropping. In 2015, N content and biomass of sweet corn were significantly higher than those under monoculture, regardless of the N application level. In 2015, AMF infection rate of sweet corn under reduced N-intercropping treatment was significantly higher than that under conventional N treatment. In autumn of 2015, phosphorus content of sweet corn under reduced N and intercropping treatment was significantly higher than that under monoculture. In conclusion, the reduction of N input and intercropping with soybean significantly improved N and phosphorus contents, rate of AMF infection, biomass and yield of sweet corn. Intercropping with soybean under reduced chemical N input maintained high yield, increased resource utilization efficiency of sweet corn, and thus it was a practicable pattern for sustainable sweet corn production in southern China.
Reduced nitrogen application; Sweet corn/soybean intercropping; Nitrogen absorption; Phosphorus absorption; Rhizobium; Arbuscular mycorrhizal fungi (AMF)
10.13930/j.cnki.cjea.170050
S541.9
A
1671-3990(2017)08-1139-08
* 国家重大基础研究计划(973计划)项目(2011CB100400)、国家科技支撑计划项目(2012BAD14B16-04)和广东省科技计划项目(2012A020100003)资助
**通讯作者:王建武, 主要从事循环农业和转基因作物安全方面的研究。E-mail: wangjw@scau.edu.cn
周贤玉, 主要从事甜玉米和大豆间作效益的研究。E-mail: 1562783858@qq.com
2017-01-15 接受日期: 2017-03-21
* The study was supported by the National Basic Research Program of China (973 Program, 2011CB100400), the National Key Technology R&D Program of China (2012BAD14B16-04) and the Science-technology Project of Guangdong Province (2012A020100003).
, E-mail: wangjw@scau.edu.cn
Jan. 15, 2017; accepted Mar. 21, 2017
周贤玉, 唐艺玲, 王志国, 王建武. 减量施氮与间作模式对甜玉米AMF侵染和大豆结瘤及作物氮磷吸收的影响[J]. 中国生态农业学报, 2017, 25(8): 1139-1146
Zhou X Y, Tang Y L, Wang Z G, Wang J W. Effects of reduced nitrogen application and intercropping on sweet corn AMF colonization, soybean nodulation and nitrogen and phosphorus absorption[J]. Chinese Journal of Eco-Agriculture, 2017, 25(8): 1139-1146

