低铁胁迫对玉米苗期根系生长和铁素吸收利用的影响*
龙文靖, 辜 涛, 万年鑫, 彭白钰, 孔凡磊, 袁继超**
低铁胁迫对玉米苗期根系生长和铁素吸收利用的影响*
龙文靖1,2, 辜 涛1, 万年鑫1, 彭白钰1, 孔凡磊1, 袁继超1**
(1. 四川农业大学农学院 温江 611130; 2. 四川省农业科学院水稻高粱研究所 泸州 646000)
为了揭示不同耐低铁玉米品种苗期根系生长和铁素吸收利用的差异, 为玉米耐低铁能力的遗传改良提供依据, 以耐低铁玉米品种‘正红2号’和不耐低铁玉米品种‘川单418’为材料, 采用重度[10 μmol(Fe3+)∙L-1]、中度[30 μmol(Fe3+)∙L-1]和轻度[50 μmol(Fe3+)∙L-1]3种低铁胁迫及对照[100 μmol(Fe3+)∙L-1]的铁营养液处理3叶1心玉米幼苗, 分析低铁胁迫对不同耐低铁玉米品种苗期根系生长和铁素吸收利用的影响。结果表明, 随着营养液铁浓度降低, 两个玉米品种幼苗的根长、根体积、根系活力、干物质、铁含量、铁积累量、相对吸铁能力均显著降低, 但根系麦根酸分泌量增多, 铁素向地上部转移分配能力增强, 铁素的生理效率提高, 这是玉米适应低铁胁迫的重要生理机制之一。玉米幼苗的铁素积累量与根长、根体积、根干重、根系活力等根系性状均呈极显著或显著正相关。耐低铁玉米品种在中度和重度低铁胁迫下根长、根体积、根干重、根系活力均较不耐低铁玉米品种高, 是其铁素吸收积累量高的重要原因。根系麦根酸分泌量与铁素茎叶分配率呈正相关, 铁素茎叶分配率与铁素生理效率呈极显著正相关, 增加根系麦根酸的分泌量可在一定程度上提高玉米铁素的茎叶分配率, 从而提高铁素生理效率; 耐低铁玉米品种在中度和重度低铁胁迫下麦根酸分泌量增幅高于不耐低铁玉米品种, 是其铁素生理效率高的主要原因。
玉米; 低铁胁迫; 苗期; 根系; 麦根酸; 铁素吸收利用
铁是植物必需的矿质元素之一, 在植物的物质和能量代谢中发挥着至关重要的作用[1-3]。尽管铁在地壳中含量居第4位, 但由于铁在氧化环境、中性和碱性土壤条件下趋向形成氧化态和氢氧化物态, 造成植物可利用的离子态铁的浓度非常低, 植物常表现出缺铁黄化症状[4], 尤其在干旱和半干旱的石灰性土壤地区植物缺铁黄化更为严重[5]。玉米()是重要的粮饲作物, 也是优良的工业原料。四川是我国玉米种植和消费大省[6-7], 其东部和北部的石灰性紫色土区面积423.73万hm2, 占四川紫色土总面积的46.5%, 土壤有效铁含量低, 严重制约了玉米产量的提高[8]。实践证明, 施用各种铁制剂、喷施叶面肥、打孔塞入法等矫治缺铁失绿的措施很难解决玉米缺铁黄叶病问题, 也容易带来严重的环境问题, 而且成本昂贵, 费工费时[9-12]。前人研究表明, 苗期是玉米缺铁黄化较敏感的时期之一, 是决定品种在石灰性土壤中后续能否正常生长的关键, 玉米缺铁时玉米幼苗生长明显受到抑制, 叶绿素含量、活性铁含量降低[13], 并产生一系列生理生化代谢变化以吸收足够的铁, 满足个体生长发育之需[14-16]。其中最为重要的就是麦根酸类物质的合成代谢, 玉米在缺铁时会在体内合成并向根际主动分泌麦根酸类植物铁载体, 然后, 铁载体与根际土壤中的三价铁形成螯合物迁移到根系质膜并在专一性转运蛋白作用下将铁运输进入根细胞内, 但不同玉米品种之间对麦根酸分泌和低铁胁迫的表现存在显著的基因型差异[17-18]。因此充分挖掘玉米自身的潜力, 筛选与培育耐低铁品种是解决玉米缺铁黄化症的经济有效途径之一。本文以前期筛选出的耐低铁能力差异显著的玉米品种为试验材料, 采用水培方法, 研究了低铁胁迫对玉米植株根系生长和铁素吸收利用的影响以及不同耐低铁玉米品种对低铁胁迫响应的差异, 为玉米耐低铁能力的遗传改良提供依据和参考。
1 材料与方法
1.1 供试品种
选取苗期耐低铁玉米品种‘正红2号’和不耐低铁玉米品种‘川单418’为供试材料[17], 种子均来自四川农业大学, 为前期试验筛选得到的对低铁胁迫反应不敏感和敏感的典型玉米品种。
1.2 试验设计
试验采用二因素完全随机试验设计, A因素为不同程度低铁胁迫, 其浓度设置参考龙文靖等[13]不同供Fe3+水平对玉米苗期生长的影响, 设置: A1, 重度低铁胁迫, Fe3+-EDTA浓度为10 μmol∙L-1; A2, 中度低铁胁迫, Fe3+-EDTA浓度为30 μmol L-1; A3, 轻度低铁胁迫, Fe3+-EDTA浓度为50 μmol∙L-1; A4, 对照, Fe3+-EDTA浓度为100 μmol∙L-1。B因素为玉米品种: B1, ‘川单418’; B2, ‘正红2号’。
玉米种子用清水漂洗数次, 除去原有包衣, 用70%酒精消毒30 s, 清洗数次后用蒸馏水浸泡10 h, 再将种子均匀播于粒径为1~2 mm的湿润石英砂上, 上面再覆盖一层薄石英砂, 早晚浇蒸馏水1次, 种子于12 000 Lx光强, 14 h光照/10 h黑暗(26 ℃/22 ℃)的光温周期以及60%相对湿度的人工气候箱内培养。9 d后将2叶1心的幼苗除去胚乳后分别移至改良Hoagland营养液中培养, 营养液中大量元素为: 945 mg∙L-1四水硝酸钙, 506 mg∙L-1硝酸钾, 80 mg∙L-1硝酸铵, 136 mg∙L-1磷酸二氢钾, 493 mg∙L-1硫酸镁; 微量元素为: 4.15 µg∙L-1碘化钾, 31.0 µg∙L-1硼酸, 111.5 µg∙L-1硫酸锰, 43.0 µg∙L-1硫酸锌, 1.25 µg∙L-1钼酸钠, 0.125 µg∙L-1硫酸铜, 0.125 µg∙L-1氯化钴; 铁盐为: 100 μmol∙L-1Fe3+-EDTA(27 mg∙L-1FeCl3∙6H2O、37.3 mg∙L-1乙二胺四乙酸二钠、pH 5.5)。待幼苗长至3叶1心时用不同浓度Fe3+的改良霍格兰营养液进行不同程度的低铁胁迫处理, 试验共8个处理, 重复3次, 共24盆, 每盆液面覆有20个孔、2 cm厚的泡沫板, 每孔定植1株玉米苗, 用海绵包裹茎秆以固定植株。每天用0.l mol∙L-1的HCl或NaOH调节营养液pH到5.8左右, 每4 d更换一次营养液, 并保证营养液通气良好。
1.3 样品采集与测定
分别于处理后14 d、28 d挑选各处理代表性玉米植株, 测定以下指标, 每处理重复测定3次。
1.3.1 植株根系形态
处理后14 d、28 d分别测定各处理的根长、根体积。根长用直尺直接测量各株根系中最长的一条根; 根体积用排水法测定。
1.3.2 干物质积累
处理后14 d、28 d分别取各处理玉米幼苗, 将植株地上部茎叶和地下部根系分开, 在105 ℃下杀青40 min, 再在80 ℃烘干至恒重后称重。
1.3.3 根系活力
处理后14 d用氯化三苯基四氮唑(TTC)还原法测定根系活力[19]。将玉米的根吸干水分, 切取0~1 cm的根尖切段, 称取0.2 g放入试管进行试验。
1.3.4 根系麦根酸分泌量测定
1)麦根酸的收集[20]: 处理后第14 d上午9:00, 将植株从盆内取出, 用水和蒸馏水将根系冲洗干净, 然后放在盛有300 mL蒸馏水的烧杯中, 在光照下生长4 h后取出植株, 并立即加入10 mL 30%的双氧水以抑制麦根酸分解, 将收集的根系分泌液放置冰箱中备用。2)活化Fe2O3测定法[20]测定麦根酸分泌量: 称取50 mg Fe2O3粉末放入试管中, 再加入10 mL根系分泌液及1 mL 1 mol∙L-1NaCl溶液, 静置24 h, 以充分反应形成Fe3+-PS(麦根酸铁类物质); 在2 500 r∙min-1条件下离心10 min后吸取5 mL上清液, 采用原子吸收分光光度法直接测定上清液中的Fe含量。
1.3.5 铁含量
将烘干称重后的样品粉碎, 使用原子吸收分光光度法测定玉米幼苗地上部茎叶和地下部根系的全铁含量[21]。
1.4 数据处理与分析
铁素积累量(µg∙plant-1)=植株地上部铁含量(µg∙g-1)×植株地上部干物质积累量(g)+地下部铁含量(µg∙g-1)×地下部干物质积累量(g) (1)
铁素茎叶分配率(%)=植株地上部铁素积累量/总铁素积累量´100 (2)
植株相对吸铁能力(mg∙g-1)=铁素积累量(mg)/植株根系干物质重(g) (3)
植株铁素生理效率(kg∙mg-1)=植株干物质重(kg)/铁素积累量(mg) (4)
试验数据采用Microsoft Excel 2007和DPS 7.05软件进行处理与分析。
2 结果与分析
2.1 低铁胁迫对不同耐低铁玉米品种苗期根系生长的影响
2.1.1 对根系形态的影响
由表1可知, 低铁胁迫导致玉米根体积和根长下降, 胁迫的程度越严重, 下降的幅度越大。两玉米品种降幅有所不同, 处理后14 d和28 d, 除轻度低铁胁迫外, ‘正红2号’玉米品种根体积和根长的降幅均低于‘川单418’, 其变异系数也均小于‘川单418’。表明低铁胁迫下‘正红2号’能够保持较长的根长和较大的根体积, 具有更为强健的根系, 有利于其在缺铁条件下对铁素的吸收。
2.1.2 对根系活力和麦根酸分泌能力的影响
由表2可知, 随低铁胁迫程度增加, 两玉米品种根系活力呈降低趋势。重度低铁胁迫下, 根系活力显著低于正常处理, 说明低铁胁迫会抑制玉米苗期根系活性, 胁迫的程度越严重, 抑制作用越强。轻度低铁胁迫条件下, 两玉米品种间根系活力差异不显著, 而中度和重度低铁胁迫下‘正红2号’显著高于‘川单418’。
麦根酸的分泌量以单位根重溶铁率表示。由表2可知, 低铁胁迫使玉米麦根酸分泌量增加, 但两个玉米品种反应不同。轻度、中度、重度低铁胁迫下, 单位根重溶铁率‘正红2号’较对照增幅分别为15.5%、11.9%和54.4%, ‘川单418’较对照增幅分别为46.6%、11.2%和20.9%; 轻度低铁胁迫下, ‘川单418’麦根酸分泌量增幅显著高于‘正红2号’, 其余各处理下‘正红2号’麦根酸分泌量的增幅均大于‘川单418’, 说明‘川单418’对低铁胁迫反应较为敏感, 在轻度低铁胁迫条件下具有一定耐受性, 在中度和重度低铁胁迫条件下耐受性低于‘正红2号’。
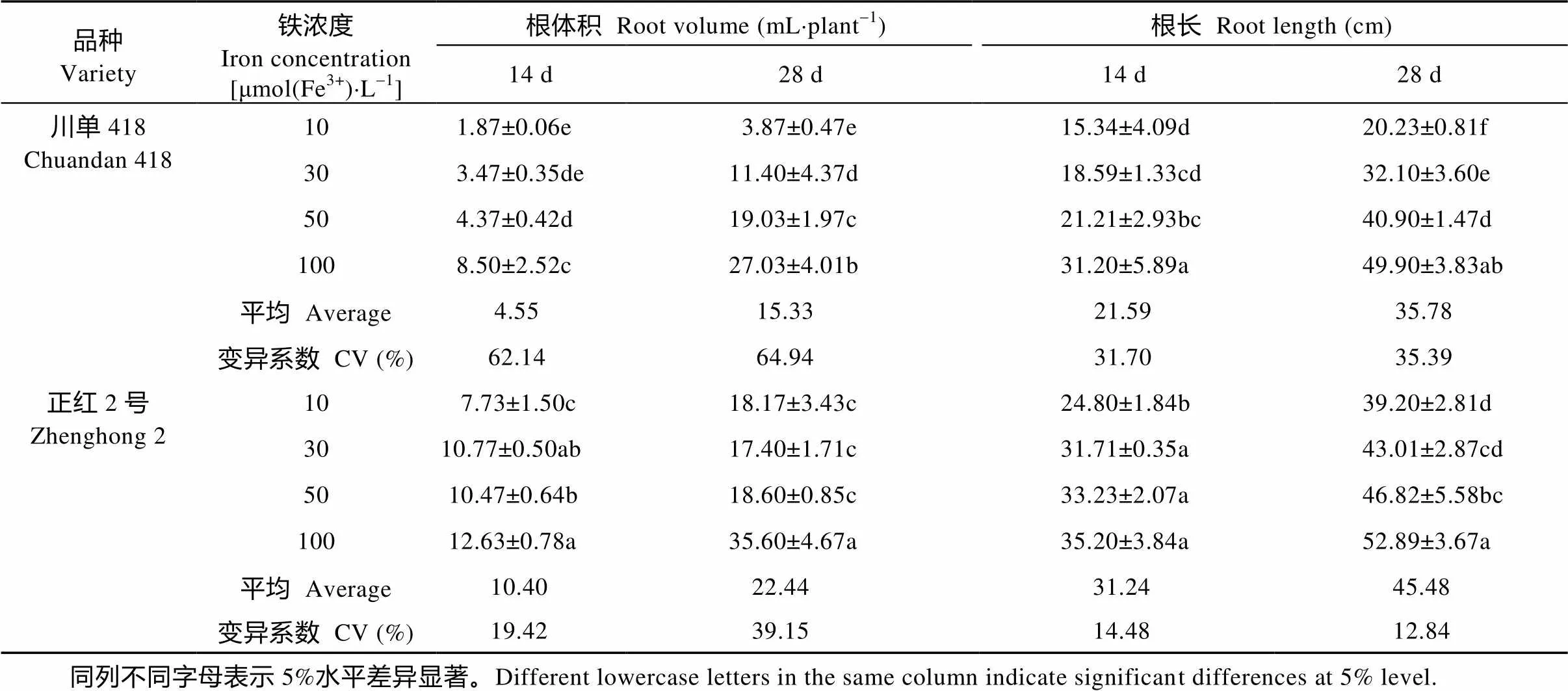
表1 不同时间低铁胁迫下不同耐低铁玉米品种苗期根系形态
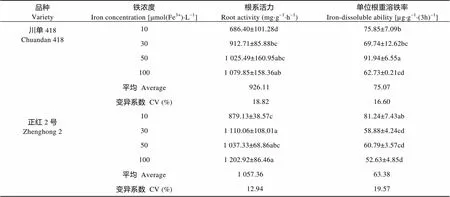
表2 不同程度低铁胁迫下不同耐低铁玉米品种苗期根系活力和单位根重溶铁率
同列不同字母表示5%水平差异显著。Different lowercase letters in the same column indicate significant differences at 5% level.
2.2 低铁胁迫对不同耐低铁玉米品种苗期干物质的影响
由表3可知, 低铁胁迫显著影响玉米苗期各器官的干物质, 导致玉米地上部和地下部根干物质降低, 胁迫的程度越严重, 下降的幅度越大; 在中、重度胁迫下, 随胁迫时间增加, 下降幅度增大。单株干重与铁浓度之间显著正相关, ‘川单418’在处理后14 d和28 d时单株干重()与铁浓度()的回归方程为14d=0.07+0.004 118(2=0.950 0*)和28d=0.36+0.025 197(2=0.887 8*), ‘正红2号’相应的回归方程分别为14d=0.46+0.003 197(2=0.985 1*)和28d= 2.04+ 0.023 495(2=0.975 2*)。由此可见, ‘正红2号’受的影响相对较小, 无论是14 d还是28 d, 其单株干重随铁浓度降低而降低的幅度(回归方程的斜率)均较‘川单418’低; 另外‘正红2号’的茎叶干重、根干重和总干重在不同低铁胁迫下的变异系数均低于‘川单418’。
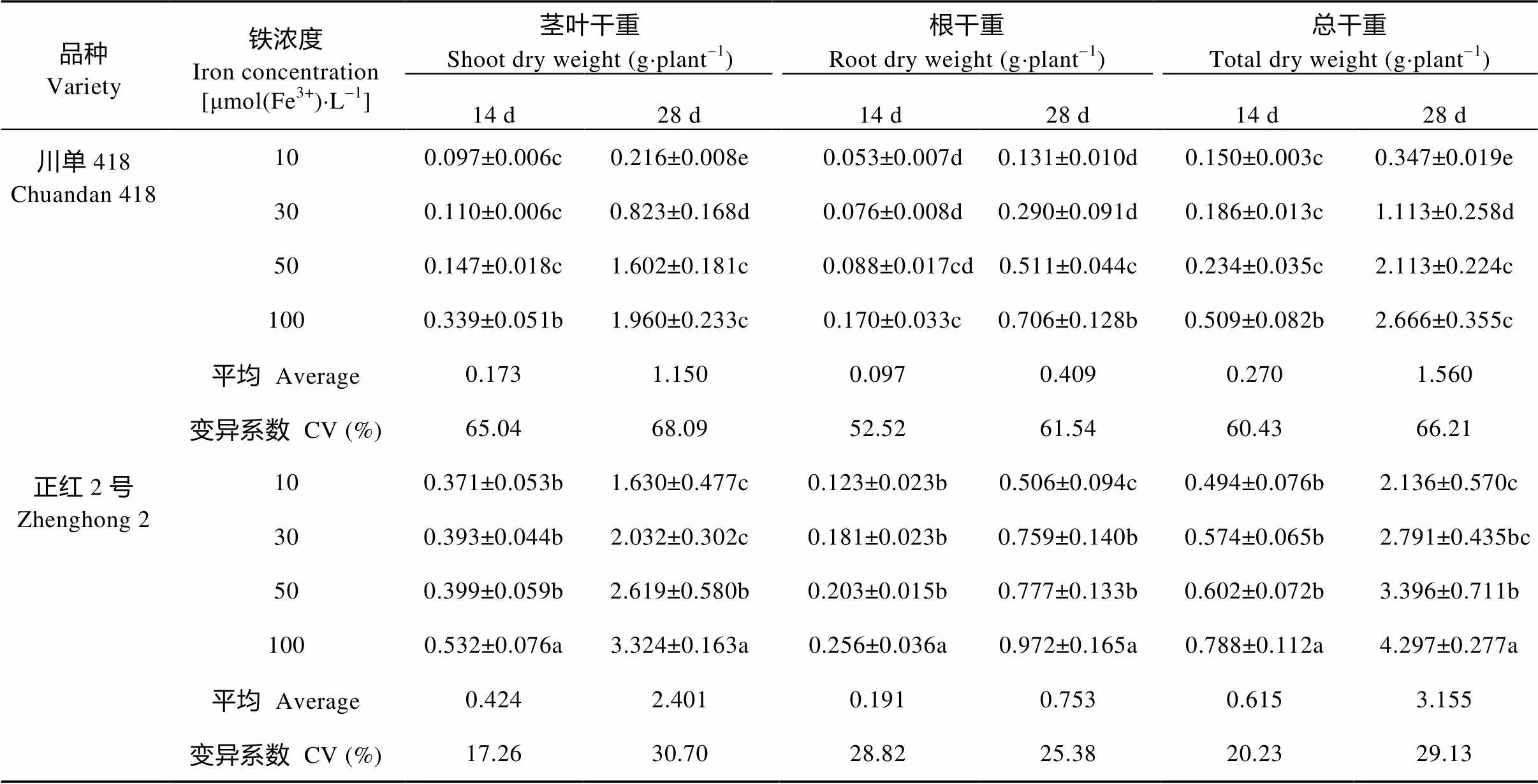
表3 不同时间低铁胁迫下不同耐低铁玉米品种苗期干物质
同列不同字母表示5%水平差异显著。Different lowercase letters in the same column indicate significant differences at 5% level.
2.3 低铁胁迫对不同耐低铁玉米品种苗期铁含量、铁素积累与分配的影响
由表4可见, 低铁胁迫后, 根系铁含量显著下降, 而茎叶铁含量变化相对较小。‘川单418’在生长14 d茎叶铁含量均高于‘正红2号’, 生长28 d两品种含量相当, 说明‘川单418’在生长前期需铁量可能较高, 是其苗期不耐低铁的一个重要原因。低铁胁迫下两品种铁含量降低的幅度因品种和时期而异, 3个低铁处理平均, ‘川单418’茎叶铁含量在处理14 d和28 d时的平均降幅分别为4.5%和8.7%, 根系的平均降幅分别为61.6%和42.0%, 而‘正红2号’茎叶相应的平均降幅分别为0.5%和18.2%, 根系的平均降幅分别为55.2%和38.9%, ‘川单418’根系的降幅更大, 处理28 d茎叶的降幅较小。
两品种的单株铁积累量均随铁浓度的降低而降低, 二者间显著正相关, ‘川单418’处理14 d和28 d时单株铁积累量()与铁浓度()的回归方程为14d=-31.11+4.408 5(2=0.955 7*)和28d=1.98+ 13.592 5(2=0.977 1*), ‘正红2号’相应的回归方程分别为14d=59.13+6.491 1(2=0.965 0*)和28d= 383.38+13.235 9(2=0.981 1**)。由此可见, 铁浓度对两个品种的铁积累量均影响较大, 无论是14 d还是28 d, 其单株铁积累量随铁浓度降低而降低, ‘正红2号’各处理下, 铁积累量均显著高于‘川单418’, 且随浓度变化的变异系数低于‘川单418’。随胁迫程度的增加铁素在茎叶的分配比例升高, 表明低铁胁迫会使更多的铁向地上部转运, 以满足叶片生长的需要, 这可能是其适应低铁胁迫的重要生理机制。随胁迫时间延长, ‘正红2号’茎叶分配比例增加, 而‘川单418’显著降低。
2.4 低铁胁迫对不同耐低铁玉米品种苗期根系相对吸铁能力和铁素生理效率的影响
单位重量根的铁吸收量(单株铁积累量/根系干重)可以反映根系的相对吸铁能力。由表5可知, 两玉米品种根系的相对吸铁能力(相对吸收效率)均随低铁胁迫的增加而降低。除轻度缺铁胁迫下14 d外, ‘正红2号’与‘川单418’的相对吸铁能力在其余各处理间差异均不显著。表明‘正红2号’铁积累量较‘川单418’高的主要原因是根系发达水平不同而不是根系相对吸铁能力的差异。
玉米苗期所吸收铁的生产能力(铁素生理效率)也显著受低铁胁迫的影响(表5), 随低铁胁迫的增加, 铁素生理效率升高, 这可能是玉米适宜缺铁环境的机制之一, 两个品种间差异极显著, 品种和铁浓度的交互作用也达到了极显著水平。在低铁胁迫下, ‘正红2号’ 具有更高的铁素生理效率, 尤其是在28 d时, 表明‘正红2号’较‘川单418’有更强的缺铁适应能力, 是‘正红2号’耐低铁能力强的重要生理机制。
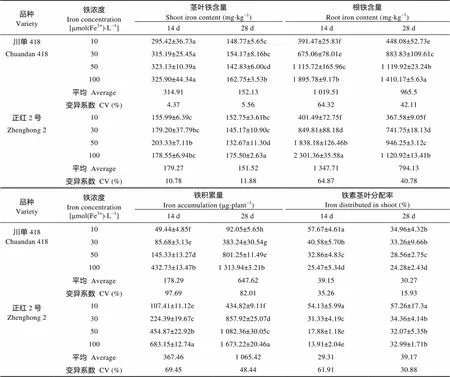
表4 不同时间低铁胁迫下不同耐低铁玉米品种苗期铁含量、铁素积累量及其茎叶分配率
同列不同字母表示5%水平差异显著。Different lowercase letters in the same column indicate significant differences at 5% level.
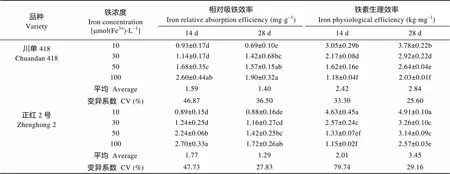
表5 不同时间低铁胁迫下不同耐低铁玉米品种苗期根系相对吸铁能力和铁生理效率
同列不同字母表示5%水平差异显著。Different lowercase letters in the same column indicate significant differences at 5% level.
2.5 根系性状与铁素吸收利用的相关性分析
对低铁胁迫14 d玉米幼苗根系主要性状和铁素吸收利用相关指标的相关性分析(表6)可知, 铁素积累量与根长、根体积、根干重的相关性达极显著水平, 发达的根系是提高玉米吸收积累铁素的重要形态基础; 铁素积累量与相对吸铁效率极显著正相关, 相对吸铁效率与根系活力显著正相关, 增强根系活力可在一定程度上增强根系的吸铁能力, 从而增加铁素积累量; 铁素生理效率与铁素茎叶分配率呈极显著正相关, 铁素茎叶分配率与根系麦根酸的分泌能力呈正相关, 相关系数达0.64, 增强根系麦根酸的分泌量可在一定程度上提高玉米铁素的茎叶分配率, 从而提高铁素生理效率。
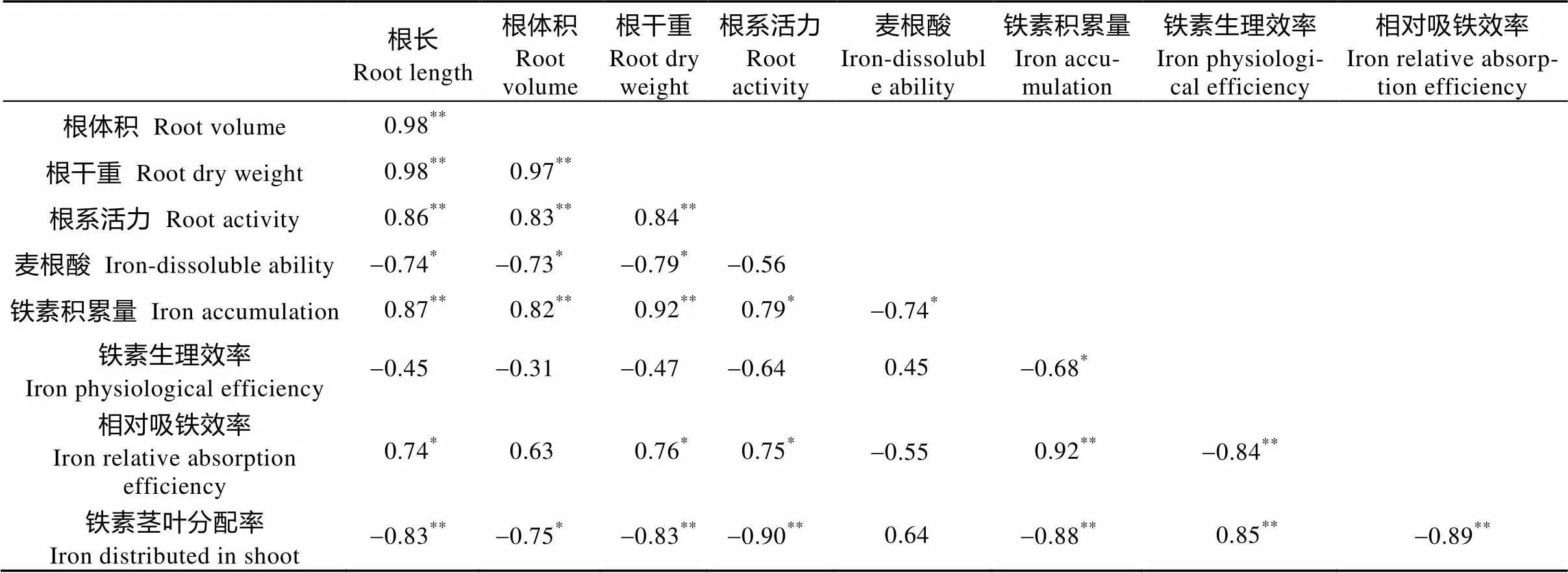
表6 低铁胁迫14 d不同耐低铁玉米品种苗期根系性状与铁素吸收利用的相关性
*和**分别代表各指标相关性达5%和1%显著水平。* and ** mean significant correlation at< 0.05 and< 0.01, respectively.
3 讨论
缺铁胁迫导致植物根系发生一系列形态和生理变化, 从而影响根系对铁素的吸收。张秀玮等[22]研究表明, 缺铁条件下花生()的根体积和根系活力显著下降。洪剑明等[23]研究表明, 玉米根在缺铁胁迫下先端出现棒状膨大, 根尖有明显的红点, 侧根较多, 缺铁处理40 d时根系多数线粒体内嵴开始解体, 局部出现空泡化, 线粒体功能丧失可能是根系活力下降的原因之一。殷文娟等[24]研究表明, 缺铁营养液提高了小麦()对Fe3+的还原能力和根际的酸化能力, 但降低了地上部铁素含量。吴妤等[25]对缺铁胁迫下草莓()幼苗研究表明, 缺铁胁迫显著降低草莓幼苗根系铁含量和生物量。本研究表明, 低铁胁迫导致玉米苗的根长、根体积、根系活力、根系干物质、根系铁含量、铁积累量均显著降低, 麦根酸分泌能力增加, 这与前人研究基本一致。低铁胁迫使得玉米根系吸收的铁素向地上部分配增加, 低铁胁迫对根系影响大于地上部分, 这与吴妤等[25]研究缺铁对叶片铁含量的影响大于对根铁含量的影响相反, 可能是不同作物对铁的吸收方式不同引起的, 玉米为机理Ⅱ植物, 对铁素吸收是主动分泌麦根酸类植物铁载体与根际Fe3+形成螯合物在专一性转运蛋白作用下进入根细胞内, 其进入根系为Fe3+螯合物形式, 而机理Ⅰ植物草莓则依靠通过增加H+等还原物质的分泌或提高根系铁还原系统的活性来增强其对铁的吸收, 其进入根系为Fe2+离子形式, 高Fe2+会对植物产生铁毒害, 因此其根系铁含量保持相对稳定。机理Ⅱ植物玉米()以Fe3+螯合物形式存在, 属于细胞内部耐性机制保护[26], 使得机理Ⅱ植物玉米根系铁含量远大于机理Ⅰ草莓, 外界铁浓度对其根系铁含量的影响也较大。
低铁胁迫下根系表面积较大是耐低铁品种具有较强铁素吸收能力的主要原因。Dasgan等[27]对番茄()研究表明, 耐低铁番茄亲本侧根数较不耐低铁多, 侧根数增加会增加根系的吸收表面积。石荣丽等[28]对6个小麦基因型的铁营养效率研究表明, 铁吸收的差异主要是由根表面积不同引起。韩振海等[29]对不同供铁水平对其铁离子吸收动力学参数影响的研究表明, 抗缺铁效率高的苹果属植物小金海棠()对铁素的亲和力较高、吸收能力较强。本研究结果表明低铁胁迫下玉米苗期根体积、根长和根系活力等指标与铁素积累量呈极显著正相关。在中度和重度低铁条件下耐低铁玉米品种‘正红2号’根长、根体积及根系干物质显著高于‘川单418’, 根系较为发达, 使得其单株铁素吸收积累量也显著高于‘川单418’。因此在干旱或半干旱石灰性土壤地区应首先选择根系较为发达的品种, 或者采取一定措施增加植株根系的生长量, 以利于玉米对土壤铁素的吸收。
同一物种不同品种之间对缺素胁迫存在显著的基因型差异, 耐受性强的品种除了表现为矿质元素吸收能力强, 还表现为其对矿质元素的利用效率高。张丽梅等[30]研究表明低磷条件下, 耐低磷玉米自交系 99239T、99180T和99327T磷吸收效率较高, 99186T和99184T磷利用效率高, 而敏感自交系99152S、99270S 磷吸收和利用效率均较低。Clark等[31]研究表明铁高效玉米品种‘WF9’其根系重量明显高于铁低效玉米品种‘ys1/ys1’, 铁素向地上部转移量也较‘ys1/ys1’多, 根系柠檬酸、乌头酸、苹果酸含量更高。本研究也表明低铁胁迫使铁素向地上部分配能力增强, 根系麦根酸的分泌量与铁素茎叶分配率呈正相关, 相关系数达0.64, 而铁素茎叶分配率与铁素生理效率呈极显著正相关。说明在低铁胁迫下, 根系麦根酸的分泌量与铁素向地上部分转运、生理效率的提高存在某种潜在的联系。前人研究表明, 3分子的S-腺苷甲硫氨酸经烟酰胺合成酶的作用合成烟酰胺, 烟酰胺在烟酰胺氨基转移酶作用下, 发生氨基的转移和酮酸的还原, 随后双加氧酶催化的羟基化或脱氧反应生成麦根酸类铁载体[32]。烟酰胺是合成铁载体类物质的前体分子, 被认为是细胞内最有可能的铁离子螯合剂。麦根酸分泌量增加, 必然使得烟酰胺在细胞中活跃度增加, 从而增加铁素在细胞中的转运能力, 使得玉米植株茎叶分配率增加, 从而提高铁素的生理效率。因此低铁胁迫条件下增加麦根酸分泌量可以在一定程度上提高玉米铁素生理效率。随胁迫程度增加, 中度和重度低铁胁迫条件下, 耐低铁玉米品种‘正红2号’麦根酸分泌量增幅较‘川单418’大, 随胁迫时间增加, 耐低铁玉米品种‘正红2号’铁素向地上部的分配能力增强, 而不耐低铁玉米品种‘川单418’则降低, 并且‘正红2号’铁素生理效率也显著高于‘川单418’, 这是其能够适应较低的铁素环境的主要原因。
4 结论
低铁胁迫导致玉米品种幼苗的根长、根体积、根系活力、干物质、铁含量、铁积累量、相对吸铁能力均显著降低, 但根系麦根酸分泌量增多, 铁素向地上部转移分配能力增强, 铁素的生理效率提高, 这是玉米适应低铁胁迫的重要生理机制之一。
玉米幼苗的铁素积累量与根长、根体积、根干重、根系活力等根系性状均呈极显著正相关, 耐低铁玉米品种在中度和重度低铁胁迫下根长、根体积、根干重、根系活力均较不耐低铁玉米品种高, 这是其铁素吸收积累量高的重要原因。
根系麦根酸分泌量与铁素茎叶分配率呈正相关, 铁素茎叶分配率与铁素生理效率呈极显著正相关。耐低铁玉米品种在中度和重度低铁胁迫下麦根酸分泌量增幅显著高于不耐低铁玉米品种, 这是其铁素生理效率高的主要原因。
[1] Kumar P, Tewari R K, Sharma P N. Sodium nitroprusside-mediated alleviation of iron deficiency and modulation of antioxidant responses in maize plants[J]. AoB Plants, 2010, (4)
[2] 段立红, 丁红, 李文学, 等. 机理Ⅰ植物铁吸收与运输的分子机制[J]. 植物营养与肥料学报, 2007, 13(4): 739–744 Duan L H, Ding H, Li W X, et al. Molecular biological mechanism of iron uptake and translocation in strategy Ⅰplant[J]. Plant Nutrition and Fertilizer Science, 2007, 13(4): 739–744
[3] 申红芸, 熊宏春, 郭笑彤, 等. 植物吸收和转运铁的分子生理机制研究进展[J]. 植物营养与肥料学报, 2011, 17(6): 1522–1530 Shen H Y, Xiong H C, Guo X T, et al. Progress of molecular and physiological mechanism of iron uptake and translocation in plants[J]. Plant Nutrition and Fertilizer Science, 2011, 17(6): 1522–1530
[4] 章艺, 史锋, 刘鹏, 等. 土壤中的铁及植物铁胁迫研究进展[J]. 浙江农业学报, 2004, 16(2): 110–114 Zhang Y, Shi F, Liu P, et al. Study progress on iron in soil and iron stress of plants[J]. Acta Agriculturae Zhejiangensis, 2004, 16(2): 110–114
[5] 刘文科, 杜连凤, 刘东臣. 石灰性土壤中铁肥的形态转化及其供铁机理研究[J]. 植物营养与肥料学报, 2002, 8(3): 344–348 Liu W K, Du L F, Liu D C. Study on the transformation and iron provision mechanism of iron fertilizers in the calcareous soil[J]. Plant Nutrition and Fertilizer Science, 2002, 8(3): 344–348
[6] 曹庆波. 2002年我国玉米市场分析与2003年展望[J]. 北京农业, 2003, (5): 1–2 Cao Q B. China’s corn market analysis in 2002 and prospect in 2003[J]. Beijing Agriculture, 2003, (5): 1–2
[7] 刘永红, 刘基敏, 何文铸. 四川玉米供需形势与主产区发展对策[J]. 中国农业资源与区划, 2006, 27(6): 19–21 Liu Y H, Liu J M, He W Z. Corn supply and demand situation in Sichuan and development counter measures for its major production region[J]. Chinese Journal of Agricultural Resources and Regional Planning, 2006, 27(6): 19–21
[8] 刘世全, 张明. 区域土壤地理[M]. 成都: 四川大学出版社, 1997 Liu S Q, Zhang M. Regional Soil Geography[M]. Chengdu: Sichuan University Press, 1997
[9] 段路路, 张民, 杨越超. 波尔多液营养保护剂对番茄缺铁锌症矫治及生长效应研究[J]. 干旱地区农业研究, 2006, 24(3): 89–94 Duan L L, Zhang M, Yang Y C. Effect of Bordeaux nutrition protective powder on iron and zinc deficiency and growth of tomatoes[J]. Agricultural Research in the Arid Areas, 2006, 24(3): 89–94
[10] 王光州, 韩慧韬, 车金鑫, 等. 不同铁制剂对石灰性土壤条件下猕猴桃缺铁黄化的矫治效果[J]. 果树学报, 2011, 28(1): 61–65 Wang G Z, Han H T, Che J X, et al. Effects of different iron preparations on iron chlorosis of kiwifruit trees in lime soil conditions[J]. Journal of Fruit Science, 2011, 28(1): 61–65
[11] 李小萌, 戚亚平, 王荣娟, 等. 苹果发酵液对缺铁苹果树叶片铁含量及光合特性的影响[J]. 中国农业科学, 2012, 45(3): 489–495 Li X M, Qi Y P, Wang R J, et al. Effects on the iron content and photosynthetic characteristics of the leaves of iron chlorosis apple trees with apple fermentation broth[J]. Scientia Agricultura Sinica, 2012, 45(3): 489–495
[12] 王满平, 孙占育, 孙志强, 等. 打孔塞入法治疗果树缺铁黄叶病[J]. 西北农业学报, 2012, 21(6): 174–177 Wang M P, Sun Z Y, Sun Z Q, et al. Therapy study of chlorotic disorder of fruit trees caused by iron deficiency through punched hole[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2012, 21(6): 174–177
[13] 龙文靖, 万年鑫, 朱从桦, 等. 不同供Fe3+水平对玉米苗期生长的影响[J]. 玉米科学, 2015, 23(4): 78–83 Long W J, Wan N X, Zhu C H, et al. Effect of different Fe3+levels on growth of maize seedlings[J]. Journal of Maize Sciences, 2015, 23(4): 78–83
[14] Nenova V, Stoyanov I. Physiological and biochemical changes in young maize plants under iron deficiency: Ⅰ. Growth and photosynthesis[J]. Journal of Plant Nutrition, 1993, 16(5): 835–849
[15] Nenova V, Stoyano I. Physiological and biochemical changes in young maize plants under iron deficiency: 2. Catalase, peroxidase, and nitrate reductase activities in leaves[J]. Journal of Plant Nutrition, 1995, 18(10): 2081–2091
[16] Nenova V, Stoyanov I. Physiological and biochemical changes in young maize plants under iron deficiency. 3. Concentration and distribution of some nutrient elements[J]. Journal of Plant Nutrition, 1999, 22(3): 565–578
[17] 龙文靖, 万年鑫, 辜涛, 等. 玉米苗期耐低铁能力的综合评价及其预测[J]. 植物遗传资源学报, 2015, 16(4): 734–742 Long W J, Wan N X, Gu T, et al. Comprehensive evaluation and forecast of low iron tolerant ability in maize seeding stage[J]. Journal of Plant Genetic Resources, 2015, 16(4): 734–742
[18] 董炳雪. 玉米自交系苗期麦根酸分泌特性及其与SSR标记的关联分析[D]. 泰安: 山东农业大学, 2012 Dong B X. Association analysis between mugineic acid release character and SSR markers in seeding stage of maize inbred lines[D]. Tai’an: Shandong Agricultural University, 2012
[19] 熊庆娥. 植物生理学实验教程[M]. 成都: 四川科学技术出版社, 2003 Xiong Q E. Plant Physiology Experiment Tutorial[M]. Chengdu: Sichuan Science and Technology Press, 2003
[20] 王维婷, 张春庆, 李鹏. 玉米麦根酸测定方法研究[J]. 分析化学, 2008, 36(1): 66–70 Wang W T, Zhang C Q, Li P. Study on the methods for the determination of corn root-washing’s mugineic acid[J]. Chinese Journal of Analytical Chemistry, 2008, 36(1): 66–70
[21] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 1999: 337 Lu R K. Soil Agricultural Chemical Analysis[M]. Beijing: China Agricultural Science and Technology Press, 1999: 337
[22] 张秀玮, 张民, 王全辉, 等. 外源NO对缺铁胁迫下花生生理特性的影响[J]. 植物营养与肥料学报, 2011, 17(3): 665–673 Zhang X W, Zhang M, Wang Q H, et al. Effects of exogenous nitric oxide on physiological characteristics of peanut under iron-deficient stress[J]. Plant Nutrition and Fertilizer Science, 2011, 17(3): 665–673
[23] 洪剑明, 汪洪杰, 邱泽生. 缺铁对玉米根和叶细胞超微结构的影响[J]. 电子显微学报, 1999, 18(6): 590–595 Hong J M, Wang H J, Qiu Z S. Effect of iron deficiency on the ultrastructure in root and leaf cell of maize[J]. Journal of Chinese Electron Microscopy Society, 1999, 18(6): 590–595
[24] 殷文娟, 吴玉霞, 刘泽军, 等. 小麦对缺铁胁迫的适应性反应[J]. 天津农业科学, 2014, 20(8): 8–12 Yin W J, Wu Y X, Liu Z J, et al. Effect of iron deficiency stress on growth and development of wheat in nutrient solution[J]. Tianjin Agricultural Sciences, 2014, 20(8): 8–12
[25] 吴妤, 禹文雅, 李奕松. 缺铁胁迫对草莓幼苗光合特性及细胞器铁含量的影响[J]. 植物营养与肥料学报, 2013, 19(4): 918–925 Wu Y, Yu W Y, Li Y S. Effects of iron deficiency stress on photosynthetic characteristics and organelle iron content of strawberry seedlings[J]. Journal of Plant Nutrition and Fertilizer, 2013, 19(4): 918–925
[26] 白红红. 水稻亚铁毒害的铁吸收与调控机理研究[D]. 晋中: 山西农业大学, 2013 Bai H H. The study of the mechanism of iron absorption and regulation in iron toxcity[D]. Jinzhong: Shanxi Agricultural University, 2013
[27] Dasgan H Y, Römheld V, Cakmak I, et al. Physiological root responses of iron deficiency susceptible and tolerant tomato genotypes and their reciprocal F1hybrids[J]. Plant and Soil, 2002, 241(1): 97–104
[28] 石荣丽, 张福锁, 邹春琴. 不同基因型小麦铁营养效率差异及其可能机制[J]. 植物营养与肥料学报, 2010, 16(6): 1306–1311 Shi R L, Zhang F S, Zou C Q. Iron efficiency of different wheat genotypes and its main contributed factors[J]. Plant Nutrition and Fertilizer Science, 2010, 16(6): 1306–1311
[29] 韩振海, 王永章, 孙文彬. 铁高效及低效苹果基因型的铁离子吸收动力学研究[J]. 园艺学报, 1995, 22(4): 313–317 Han Z H, Wang Y Z, Sun W B. Iron absorption kinetics for Fe-efficient vs. -inefficient species in[J]. Acta Horticulturae Sinica, 1995, 22(4): 313–317
[30] 张丽梅, 郭再华, 张琳, 等. 缺磷对不同耐低磷玉米基因型酸性磷酸酶活性的影响[J]. 植物营养与肥料学报, 2015, 21(4): 898–910 Zhang L M, Guo Z H, Zhang L, et al. Effects of phosphate deficiency on acid phosphatase activities of different maize genotypes tolerant to low-P stress[J]. Journal of Plant Nutrition and Fertilizer, 2015, 21(4): 898–910
[31] Clark R B, Tiffin L O, Brown J C. Organic acids and iron translocation in maize genotypes[J]. Plant Physiology, 1973, 52(2): 147–150
[32] 王育花, 肖国樱. 烟酰胺合成酶基因在植物铁胁迫应答反应中的功能[J]. 生命科学研究, 2009, 13(4): 354–359 Wang Y H, Xiao G Y. Function of nicotianamine synthase gene in plant iron stress[J]. Life Science Research, 2009, 13(4): 354–359
Effect of low iron stress on root growth and iron uptake and utilization of different maize cultivars at seedling stage*
LONG Wenjing1,2, GU Tao1, WAN Nianxin1, PENG Baiyu1, KONG Fanlei1, YUAN Jichao1**
(1. College of Agronomy, Sichuan Agricultural University, Wenjiang 611130, China; 2. Institute of Rice and Sorghum Research, Sichuan Academy of Agricultural Sciences, Luzhou 646000, China)
Iron, as a mineral element necessary for plant growth, has a significant effect on chlorophyll synthesis, REDOX reaction, plant photosynthesis, respiration, and substance/energy metabolism. Low content of effective iron in soil can easily cause iron deficiency (chlorosis) in maize planted in calcareous soils of arid/semi-arid regions. The study of the ability/mechanism of maize to resist low iron stress is critical for solving chlorosis due to iron deficiency. In order to determine the mechanism of resistant maize cultivars to low iron stress at seedlingstage, ‘Zhenghong 2’ (resistant to low iron) and ‘Chuandan 418’ (sensitive to low iron) were selected for the study. For genetic improvement of the maize varieties resistant to low iron stress, three-leaf maize seedlings were treated with different levels of iron solution with severe (10 μmol∙L-1), medium (30 μmol∙L-1), light (50 μmol∙L-1) iron stress and control (100 μmol∙L-1). Analysis of low iron stress for different maize varieties to low iron showed that the low iron stress had significant effects on root growth and iron uptake of maize seedlings after 14 and 28 days of treatments. As iron concentration decreased, root length, root volume, root vitality, dry matter, iron content, iron accumulation and relative absorption capacity of maize seedlings significantly dropped. However, iron treatment increased root-washing mugineic acid, iron distribution in aboveground parts and iron physiological efficiency of the seedlings. This was one of the most important physiological mechanisms of maize adaptation to low iron stress. Although iron accumulation had significant positive correlation with iron absorption ability of maize, iron absorption capacity under moderate and severe low iron stress in maize cultivars with different low iron resistances were not significant. Thus the difference in iron absorption ability was not the main cause of high iron accumulation in ‘Zhenghong 2’. Iron accumulation was also significantly positively correlated with root length, root volume, root dry weight and root activity. Compared with ‘Chuandan 418’ low iron resistant variety ‘Zhenghong 2’ had longer root length, larger root volume, heavier root dry weight, higher root vitality and higher iron accumulation. There was a positive correlation between mugineic acid and iron distribution in stems and leaves of maize seedlings. Also a positive correlation was observed between iron physiology efficiency and iron distribution in stems and leaves of maize seedlings. The enhancement of root secretion of mugineic acid improved iron allocation rate in the shoot system of maize so as to improve the efficiency of iron physiology. The rate of increase in mugineic acid was higher for ‘Zhenghong 2’ under moderate and severe low iron stress and that was the main reason for the high iron physiological efficiency.
Maize; Low iron stress; Seedling stage; Root; Mugineic acid; Iron uptake and utilization
10.13930/j.cnki.cjea.170082
S513; S143.7
A
1671-3990(2017)08-1163-10
* 国家科技攻关计划项目(2012BAD04B13-2)资助
**通讯作者:袁继超, 研究方向为作物栽培与耕作研究。E-mail: yuanjichao5@163.com
龙文靖, 研究方向为高粱品种选育及高粱、玉米配套栽培技术。E-mail: longjing9012@163.com
2017-01-23 接受日期: 2017-02-24
* This study was supported by the National Programs for Science and Technology Development of China (2012BAD04B13-2).
, E-mail:yuanjichao5@163.com
Jan. 23, 2017; accepted Feb. 24, 2017
龙文靖, 辜涛, 万年鑫, 彭白钰, 孔凡磊, 袁继超. 低铁胁迫对玉米苗期根系生长和铁素吸收利用的影响[J]. 中国生态农业学报, 2017, 25(8): 1163-1172
Long W J, Gu T, Wan N X, Peng B Y, Kong F L, Yuan J C. Effect of low iron stress on root growth and iron uptake and utilization of different maize cultivars at seedling stage[J]. Chinese Journal of Eco-Agriculture, 2017, 25(8): 1163-1172

