瑶药扁担藤薄层鉴别和原儿茶酸提取工艺及含量测定研究
魏江存 陈 勇 谢 臻 李耀华 庾延和 阙祖亮 张 昕 庞丹清 邓丽红
广西中医药大学,广西 南宁 530020
瑶药扁担藤薄层鉴别和原儿茶酸提取工艺及含量测定研究
魏江存 陈 勇*谢 臻 李耀华 庾延和 阙祖亮 张 昕 庞丹清 邓丽红
广西中医药大学,广西 南宁 530020
目的:以原儿茶酸为指标性成分,建立扁担藤薄层鉴别和提取工艺以及其含量测定方法。方法:薄层鉴别采用硅胶GF254薄层板,以体积比甲苯∶乙酸乙酯∶甲酸(12∶6∶1)为展开剂,置紫外灯(254nm)下检视。采用正交试验,以原儿茶酸含量为指标,考察溶剂浓度、溶剂体积和回流时间对扁担藤中原儿茶酸提取工艺的影响;采用色谱柱BDS HYPERSIL C18柱(4.60mm×250mm, 5μm);流动相:甲醇-0.1%磷酸(28∶72),检测波长258nm,流速1.0mL/min,柱温30℃,进样量10μL。结果:薄层色谱中可以检出原儿茶酸,斑点清晰,专属性好。原儿茶酸进样量在0.0292~0.1460 μg(R2=0.9991)范围呈良好的线性关系。扁担藤低、中、高加样组原儿茶酸的平均回收率分别为99.32%(RSD=1.73%)、98.54%(RSD=0.96%)和97.83%(RSD=1.40%)。溶剂浓度为影响扁担藤中原儿茶酸提取效果的主要因素,确定最佳工艺条件为40%乙醇,溶剂体积为20mL,提取时间2.5h。结论:优选出的提取工艺稳定,提取率高。该方法能有效鉴别瑶药扁担藤,能准确地测定其原儿茶酸的含量,为开发利用其药材资源提供科学依据。
扁担藤;原儿茶酸;含量测定;薄层鉴别;提取工艺;HPLC
扁担藤Tetrastigmaplanicaule(Hook.) Gagnep.系葡萄科崖爬藤属植物,又名扁骨风、过江扁龙、扁藤、腰带藤、大芦藤、铁带藤和羊带风等,分布于我国广西、贵州、云南、福建、广东和西藏东南部等地区,生于山谷林中或山坡石缝中,海拔100~2100m[1]。扁担藤是我国瑶族的常用药材,其性平,味微涩,入风、火、土、水塔,藤茎及根均可入药,具有祛风除湿、舒筋活络、除风解毒和消肿止痛的功效,临床用于治疗风湿性关节炎、腰肌劳损、跌打损伤、风湿痹痛、腰腿痛、下肢溃疡、半身不遂、荨麻疹和咳嗽哮喘等病症[2-3]。
近年来瑶药扁担藤的药用价值越来越受到重视,国内外学者对其进行了相关研究发现,扁担藤主要含有黄酮类、酚酸类、萜类、皂苷类、甾体、糖类和鞣质等化合物[4-5],酚酸类包括原儿茶酸、水杨酸、香草酸和丁香酸等成分[6]。原儿茶酸(protocatechuic acid)有广泛的药理作用和生物活性,目前对原儿茶酸资源的开发已应用到医药、食品和保健品等方面。原儿茶酸具有抗菌[7]、抗病毒[8-9]、抗心血管系统疾病[10-12]和祛痰平喘[13]等药理作用,临床主要用于治疗慢性气管炎[13]。目前,国内外对扁担藤进行薄层鉴别和含量测定的相关研究较少,为保证其药材质量及临床疗效,笔者实验建立了扁担藤中原儿茶酸的薄层鉴别和含量测定方法,为其质量标准的建立提供科学依据。
1 仪器与材料
1.1 仪器 2695型高效液相色谱仪(包括2489UV,四元泵、真空脱气泵、自动进样器、柱温箱和Empower3液相工作站,美国Waters公司);Practum224-1CN分析天平(赛多利斯科学仪器有限公司);SHB-III循环水式多用真空泵(郑州长城科工贸有限公司);Simplicity超纯水系统(密理博中国有限公司);TGL-16G高速台式离心机(上海安亭科学仪器厂);HWS-26电热恒温水浴锅(上海齐欣科学仪器有限公司);DHG - 9203A型电热恒温鼓风干燥箱(上海齐欣科学仪器有限公司);尼龙66(Nylon)-22μm 微孔滤膜(天津津腾实验设备有限公司)。
1.2 材料 原儿茶酸对照品(批号:110809-201604,中国药品生物制品有限公司);扁担藤药材采于广西贺州市富川县,经广西中医药大学中药鉴定教研室廖月葵高级实验师鉴定为葡萄科(Vitaceae)崖爬藤属(Tetrastigma)大型木质藤本植物扁担藤Tetrastigmaplanicaule(Hook.)Gagnep。薄层硅胶GF254(青岛海洋化工厂),甲醇、乙腈为色谱纯,水为超纯水,其它试剂为分析纯。
2 方法与结果
2.1 扁担藤样品制备 采集扁担藤药材,自然晒干后,将其粉碎,以备样品含量测定使用。
2.2 薄层鉴别 称取扁担藤药材粗粉3.0g,加40%乙醇60mL,回流2.5h,滤过,滤液挥干至约3 mL作为扁担藤供试品溶液。取原儿茶酸对照品适量,加甲醇使溶解,配制成浓度为292μg/mL原儿茶酸对照品溶液。吸取上述溶液各5μL,分别点于同一硅胶GF254薄层板上,以体积比甲苯-乙酸乙酯-甲酸(12∶6∶1)为展开剂,展开,取出,晾干,置紫外灯(254nm)下检视,扁担藤供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的荧光斑点。结果见图1。
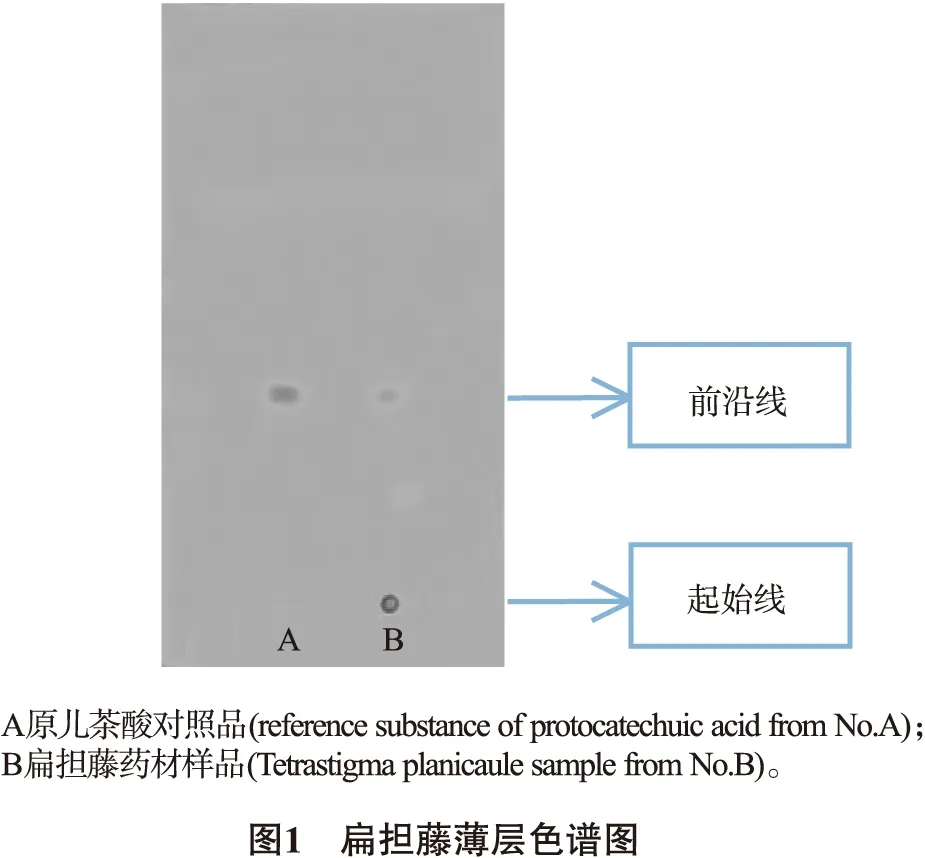
2.3 含量测定
2.3.1 波长的确定 用甲醇溶解并稀释原儿茶酸对照品溶液,以甲醇为参比液,用紫外-可见分光光度计在200~400nm波长范围内进行扫描,分析结果,确定原儿茶酸的最佳吸收波长。结果见图2。

由图2可知,原儿茶酸在波峰位子1号、2号和3号都有最大吸收,故根据原儿茶酸的吸收曲线及最佳的3个检测波长(分别是258、294、371nm),确定最佳吸收波长为258nm。
2.3.2 色谱条件 色谱柱BDS HYPERSIL C18柱(4.60mm×250mm, 5μm),流动相:甲醇-0.1%磷酸(28∶72),检测波长258nm,流速1.0mL/min,柱温30℃,进样量10μL,按照上述条件各组分分离度良好。结果见图3。
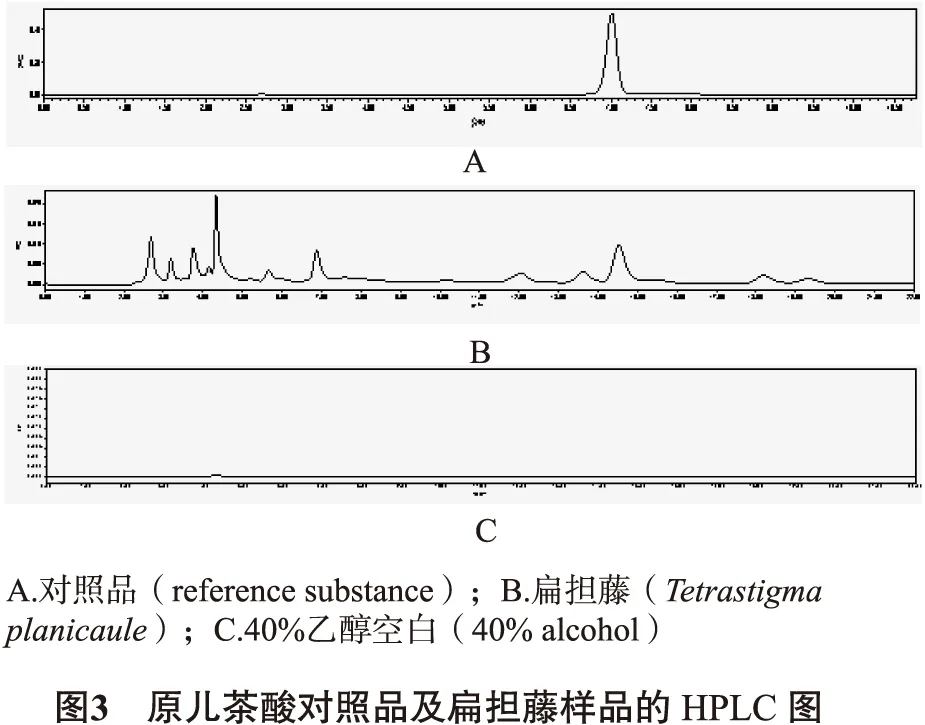
2.3.3 对照品溶液制备 精密称取原儿茶酸对照品14.6mg,置50mL量瓶中,加甲醇溶解并稀释至刻度,即得原儿茶酸对照品溶液(292μg/mL);精密量取上述原儿茶酸对照品溶液1mL,置50mL量瓶中,加甲醇溶液稀释至刻度,制成原儿茶酸对照品溶液(5.84μg/mL)。
2.3.4 供试品溶液制备 精密称定扁担藤药材粗粉1.0g,置具塞锥形瓶中回流提取,以半径0.65cm,13000r/min离心10min,取上清液,0.45μm微孔滤膜滤过,即得。
2.3.5 标准曲线的制备 精密吸取原儿茶酸对照品溶液(浓度为5.84μg/mL)5、8、12、16、20、25μL注入液相色谱仪,以峰而积和进样量(μg)分别为纵坐标和横坐标,绘制标准曲线并计算回归方程。原儿茶酸Y=3.0×106X-19945(R2=0.9991)。结果,原儿茶酸进样量在0.0292~0.1460μg范围呈良好的线性关系。
2.3.6 精密度试验 精密取原儿茶酸对照品溶液适量(5.84ug/mL),按2.3.2项下条件连续进样6次,计算原儿茶酸峰面积的RSD为0.61%,小于3%,说明仪器精密度良好。
2.3.7 稳定性试验 取同一批扁担藤药材粗粉1.0g,精密称定,按2.3.4项下的方法制备成供试品溶液,分别在供试品溶液制备后0、2、4、8、12、24 h按2.3.2项下条件测定,计算扁担藤中原儿茶酸峰面积的RSD为2.92%,小于3%,说明24 h内供试品溶液稳定性良好。
2.3.8 重复性试验 精密称取同一批扁担藤药材粗粉1.0g,共6份,按2.3.4项下的方法制备成供试品溶液,按2.3.2项下条件测定,计算扁担藤中原儿茶酸平均含量为0.1458mg/g,其RSD为0.85%,小于3%,表明该方法重复性良好。
2.3.9 加样回收率试验 精密称取同一批已知含量的扁担藤药材粗粉0.5g(0.1458mg/g),共9份,分成3组,即低、中、高加样组(0.5g药材含量的80%、100%和120%加样,加样量分别为0.0583mg、0.0729mg、0.0875mg),扁担藤低、中、高加样组的原儿茶酸的平均回收率分别为99.32%、98.54%、97.83%,RSD分别为1.73%、0.96%、1.40%(n=3),表明该方法准确性良好。结果见表1。
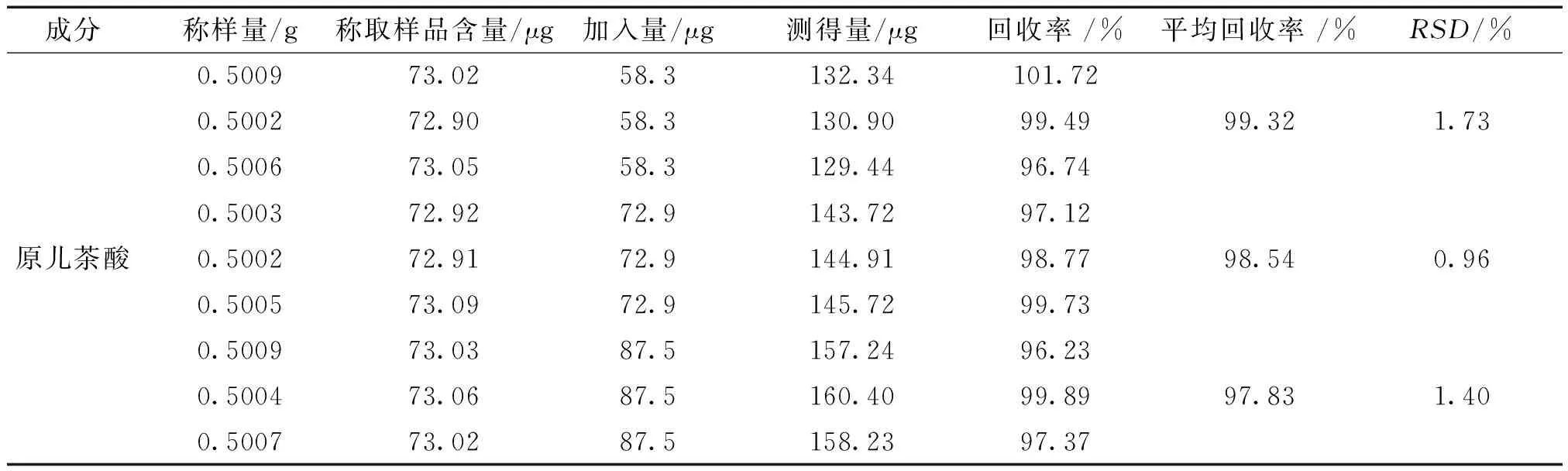
表1 扁担藤中原儿茶酸的加样回收率实验
3 提取工艺
3.1 单因素考察
3.1.1 提取方法考察 以原儿茶酸提取时间1h、20 mL 25%乙醇为提取条件,分别采用回流提取法、超声提取法和溶剂浸渍法对扁担藤药材进行原儿茶酸提取,实验结果表明,回流提取法对原儿茶酸提取率高,故本实验选用回流提取法。结果见图4。
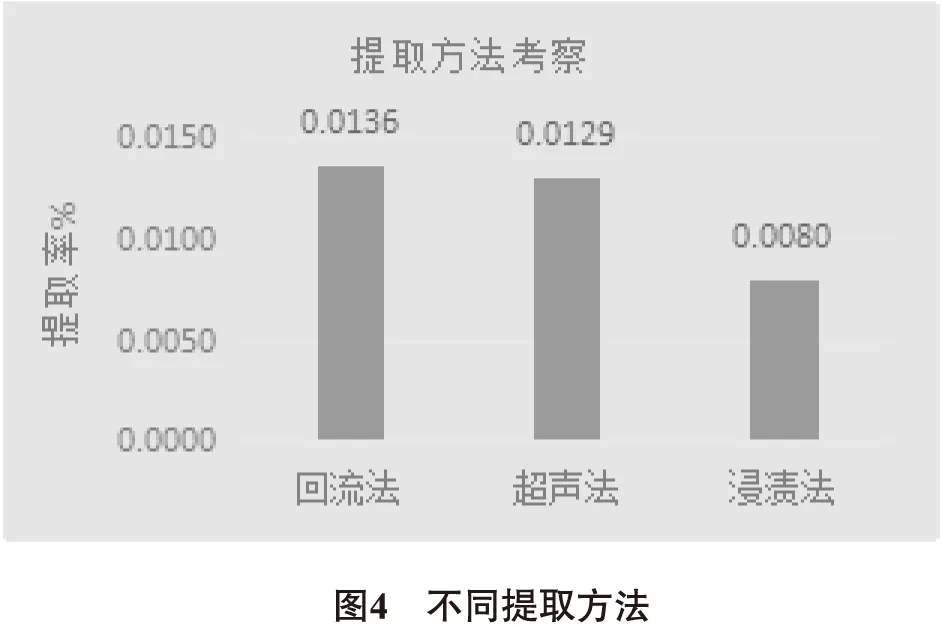
3.1.2 溶剂浓度考察 固定原儿茶酸提取时间1h、20mL溶剂,采用回流提取法,以乙醇和甲醇不同浓度对扁担藤中原儿茶酸得率做单因素试验,设计乙醇和甲醇浓度都为10%、25%、40%、60%和85%,结果显示40%乙醇回流提取率较高。结果见图5。

3.1.3 提取体积考察 以原儿茶酸提取时间1h和40%乙醇,采用回流提取法,以溶剂提取体积对扁担藤中原儿茶酸得率做单因素试验,提取体积为15、20、25、30mL,结果显示体积为25mL时的提取率最高。结果见图6。

3.1.4 提取时间考察 以40%乙醇25mL,采用回流提取法,以提取时间对扁担藤中原儿茶酸的得率做单因素试验,设提取时间为1.0、1.5、2.0、2.5、3.0h,结果显示,扁担藤提取时间在2.5h和3.0h时原儿茶酸得率较高,而这两个提取时间对原儿茶酸得率基本没有显著差别,考虑到能耗,所以选择提取时间为2.5h。结果见图7。

3.2 正交实验设计 单因素考察分析实验表明,本实验最终采取不同乙醇浓度为溶剂的提取方法,考察了溶剂浓度(10%、25%、40%乙醇)、溶剂体积(20、30、40mL)、提取时间(1.5、2.0、2.5h)三个条件。根据正交设计软件,选用L9(34)正交试验设计。见表2。

表2 正交试验因素与水平
3.3 正交实验与结果分析
取扁担藤药材粗粉1.0g,精密称定,按照上述扁担藤中原儿茶酸的提取方法进行提取,再依供试品溶液的制备方法操作,按L9(34)正交设计方案进行试验,使用高效液相色谱法对扁担藤中原儿茶酸成分进行含量测定。见表3。

表3 正交试验设计与结果
3.4 方差分析结果 由表3、4可知,以扁担藤中原儿茶酸的含量为实验指标,由于多种因素会影响对扁担藤中原儿茶酸成分的提取。在考察范围内,就原儿茶酸提取率而言,乙醇浓度对扁担藤中原儿茶酸的提取率有显著性影响;根据正交试验和方差分析结果确定最佳工艺条件为A3B1C3,即乙醇浓度是40%,提取溶剂体积20ml,回流提取时间是2.5h,且各影响因素的强弱为乙醇浓度>提取时间>溶剂体积,所以对扁担藤中原儿茶酸的提取率有统计学意义的因素是乙醇浓度。

表4 方差分析结果
注:F0.01(2,2)=99.00,F0.05(2,2)=19.00;
Note:F0.01(2,2)=99.00,F0.05(2,2)=19.00。
4 样品含量测定
在最佳提取工艺条件下,分别按2.3.4项下的方法制备成供试品溶液,平行称取扁担藤药材粗粉3份,每份1.0g,按2.3.2项下条件测定,采用外标一点法计算原儿茶酸的提取率,实验结果为原儿茶酸的平均提取率为2.83%,RSD=2.71%(n=3),说明优选的工艺可行,重现性较好。结果见表5。

表5 样品测定结果
5 讨论
5.1 薄层色谱条件的选择 预实验中分别考察了三氯甲烷-甲醇-甲酸、三氯甲烷-乙酸乙酯-甲醇-甲酸、甲苯-乙酸乙酯-甲酸、三氯甲烷-正丁醇-冰醋酸和三氯甲烷-丙酮-甲酸等展开系统,结果显示,甲苯-乙酸乙酯-甲酸(12∶6∶1)作为展开剂时,斑点相对清晰,分离度较好。
5.2 流动相的选择 预实验中考察了不同甲醇-酸水系统、乙腈-酸水系统以及甲醇-水和乙腈-水系统(0.1%、0.2%磷酸,0.1%、0.2%冰醋酸,纯水),结果表明,甲醇-0.1%磷酸溶液作为流动相时,分离度相对较好,基线较平稳,故流动相确定为甲醇-0.1%磷酸水溶液。
5.3 波长的选择 采用二极管阵列检测器,在200~400nm波长下对原儿茶酸对照品溶液进行全波长扫描,原儿茶酸在波长258、294、371nm下有最大吸收。在294、371nm检测波长时,其基线相对漂移以及杂峰比较多,而在258nm时,基线相对平稳,杂峰较少,溶剂峰小,原儿茶酸响应值较大,故最终选用258nm作为本实验的检测波长。
[1]中国科学院中国植物志编辑委员会.中国植物志(第48(2)卷)[M].北京:科学出版社,1979:48-50.
[2]南京中医药大学. 中药大辞典[M]. 上海:上海科学技术出版社,2006:2437.
[3]覃迅云,罗金裕,高志刚.中国瑶药学[M]. 北京:民族出版社,2002 :141.
[4]卢澄生,李兵. 瑶药扁担藤的化学成分预试验研究[J]. 广西中医学院学报,2011(2):43-44.
[5]李兵,廖广凤,黄业玲,等. 瑶药扁担藤乙酸乙酯部位化学成分研究[J]. 中药材,2014(4):610-611.
[6]邵加春,何翠红,雷婷,等. 瑶药扁担藤化学成分的研究[J]. 中国药学杂志,2010(21):1615-1617.
[7]代小青,刘纯,陈勇,等. 原儿茶酸对Huh7细胞中HNF1α表达的抑制影响[J]. 湖北大学学报(自然科学版),2016(4):303-306.
[8]张强,刘友,张中海. 原儿茶酸对帕金森模型大鼠血清TNF-α、IL-1β及氧化应激产物水平的影响[J]. 中国生化药物杂志,2015(11):37-39.
[9]代汝伟,章时杰,蔡伟彬,等. 原儿茶酸对β淀粉样蛋白(1-42)诱导PC12细胞毒性的保护作用及机制[J]. 广州中医药大学学报,2016(1):66-70.
[10]覃华,张琰,杜小燕,等. 原儿茶酸对大鼠心肌缺血/再灌注损伤的保护作用[J]. 西北药学杂志,2015(6):709-712.
[11]尹雪,苏新云,王秀华,等. 原儿茶酸对帕金森病模型小鼠中脑和纹状体D2DR、iNOS和TH表达的影响[J]. 中草药,2015(6):866-870.
[12]张秀丽,李亚晨,牛新华,等. 原儿茶酸对帕金森模型鼠脑组织抗氧化能力的影响[J]. 现代生物医学进展,2011(17):3248-3251.
[13]魏苗苗. 原儿茶酸对过敏性哮喘模型小鼠的保护作用及相关机制的研究[D].长春:吉林大学,2013.
国家自然科学基金项目(81260673、81360524);广西中医药大学科研创新项目(No.YJS201625);壮瑶药协同创新中心(No.桂教科研[2013]20号);广西中医药管理局2013年中医药民族医药继承创新工程立项课题(GZZY13-13);广西壮瑶药重点实验室(桂科基字[2014]32号);广西重点学科壮药学(桂教科研[2013]16号);广西八桂学者中药创新理论与药效研究(J13162)。
魏江存(1989-),男,汉族,硕士研究生,研究方向为药物质量控制。E-mail: WJC2553@163.com
陈勇(1961-),男,汉族,教授,硕士研究生导师,研究方向为中药及其制剂质量分析。E-mail: cy6381@163.com
R284.2
A
1007-8517(2017)14-0030-05
2017-05-11 编辑:程鹏飞)

