碧玉兰无菌播种快繁技术研究
李洪超,汪 旭,张玉洁
(1.云南师范大学 生命科学院,云南 昆明 650500;2.麻栗坡县八布中学,云南 麻栗坡 663605;3.文山学院 环境与资源学院,云南 文山 663099)
碧玉兰无菌播种快繁技术研究
李洪超1,2,汪 旭1,张玉洁3
(1.云南师范大学 生命科学院,云南 昆明 650500;2.麻栗坡县八布中学,云南 麻栗坡 663605;3.文山学院 环境与资源学院,云南 文山 663099)
以碧玉兰的种子为外植体进行组织培养。结果表明:碧玉兰种子萌发的最佳配方为:MS+NAA 0.5 mg/L+AC 2.0 g/L+蔗糖30 g/L+椰汁100 g/L,播种后50 d左右,可以形成绿色的原球茎(PLB);原球茎分化成幼苗的最佳配方为:1/2MS+6-BA 0.5 mg/L+KT 0.5 mg/L+蔗糖30 g/L+马铃薯100 g/L;生根并形成幼苗最佳的配方为:1/2MS+6-BA 0.2 mg/L+NAA 0.5 mg/L+AC 2.0 g /L+香蕉泥50 g/L。
碧玉兰;外植体;组织培养
碧玉兰[Cymbidium lowianum(Rchb.f.)Rchb.f.],附生植物,花葶长60~80 cm;每葶10~20朵花;花直径7~9 cm;唇瓣中裂片上有深红色的V形斑;花期4~6月份;云南主要分布在盈江、龙陵、沧源、景洪、绿春、文山、金平等地;缅甸和泰国也有分布;全草入药,用于跌打、骨折、扭伤、筋伤等。[1]碧玉兰的花比较大、花色艳丽,具有较高的经济价值,市场需求量逐渐增加,而野生碧玉兰却越来越少。为了更好地保护碧玉兰的种质资源,同时又能满足市场需求,笔者用碧玉兰的蒴果作为材料,对碧玉兰进行了组培快繁研究。
1 材料与方法
1.1 材料
研究材料为成熟度约八成的野生碧玉兰蒴果。
1.2 方法
首先将碧玉兰的蒴果用洗涤剂清洗表面,用75%的酒精表面灭菌20 s,然后用0.1%的HgCl2溶液浸泡8 min,最后用无菌水冲洗2~3次。在超净工作台里将种子均匀地撒在培养基上,基本培养基为1/2MS,活性炭2 g/L,蔗糖30 g/L,琼脂粉6.0 g/L,在灭菌前将培养基的pH值调整至6.2,在不同培养阶段加入不同种类和配比的激素,不同培养阶段加入不同的其它天然有机物附属添加成分,按常规方法配制。培养温度为(25±2)℃,每天光照12 h,移栽基质为较粗的锯木(杉木)。
2 结果与分析
2.1 种子萌发
种子萌发的培养基共设置了5个配方。种子播种后先进行遮光培养一周,然后才进行光照培养。培养50 d后观察并统计其萌发情况(见表1和图1)。
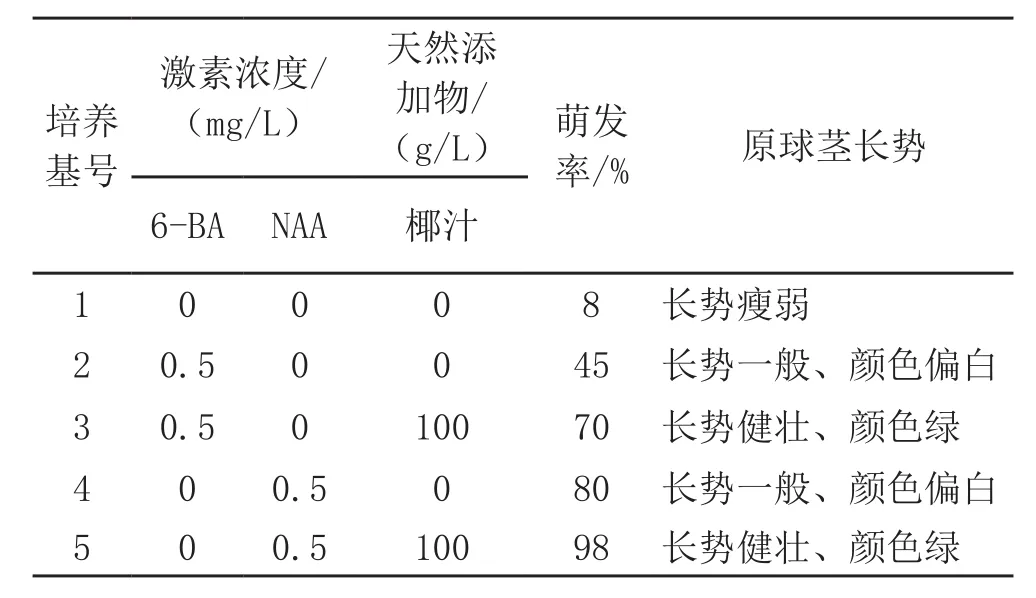
表1 不同培养基对碧玉兰种子萌发的影响
由表1看出,碧玉兰种子在1/2MS空白培养基中也有萌发的现象,但萌发率十分低,只有8%,而在添加NAA和椰汁组合组成的培养基中碧玉兰种子的萌发最好。5号配方中碧玉兰种子萌发后形成的原球茎长得最好。碧玉兰种子萌发发育成绿色圆球形的原球茎团块时,及时转瓶,这时进行增殖的效果最好,否则原球茎便开始发芽分化成幼苗。[2]结果表明,碧玉兰种子萌发最佳的培养基是MS+NAA 0.5 mg/L+活性炭1.0 g/L+蔗糖30 g/L+椰汁100 g/L,萌发率达98%,原球茎长势最好。

图1 种子的萌发(播种后40天)

图2 原球茎分化
2.2 原球茎的分化
将原球茎转到1/2MS+6-BA 0.5 mg/L+KT 0.5 mg/L+蔗糖30 g/L+马铃薯100 g/L分化培养基上继续培养,培养30 d左右即可看到原球茎顶端开始分化出芽尖(见图2)。继续培养一个月后,小芽即可生长成具有2~4片叶片的幼苗。
2.3 生根培养
活性炭具有很强的吸附能力,对植物形态和器官的形成有良好效应[3];香蕉泥、椰汁是成分较复杂的天然复合物,对细胞和组织的增殖分化有明显的促进作用,对幼苗生长发育也有一定的促进作用。[4]因此,试验以1/2MS为基本培养基,添加不同种类的激素和天然添加物,共配制了6种不同配方的生根培养基,每种配方接种10瓶,每瓶接种10株长势差异不大的的无根苗,培养60 d后统计结果(见表2)。
由表2可以看出,碧玉兰在空白培养基1/2MS中也能生根,但生根率也很低,仅为12.0%,长势也不理想;在添加不同种类的激素后,生根率迅速上升,如果在培养基中添加其它天然有机添加物,碧玉兰生根效果会更好。从幼苗的长势上看,5、6号培养基配方要比4号培养基配方好,而从经济成本上看5号培养基配方比6号培养基配方更节约成本。实验结果表明,碧玉兰最佳的生根培养基配方是:1/2MS+6-BA 0.2 mg/L+NAA 0.5 mg/L+活性炭2.0 g/L+香蕉泥50 g/L,生根率达到100%,植株健壮、叶片颜色浓绿(见图3)。
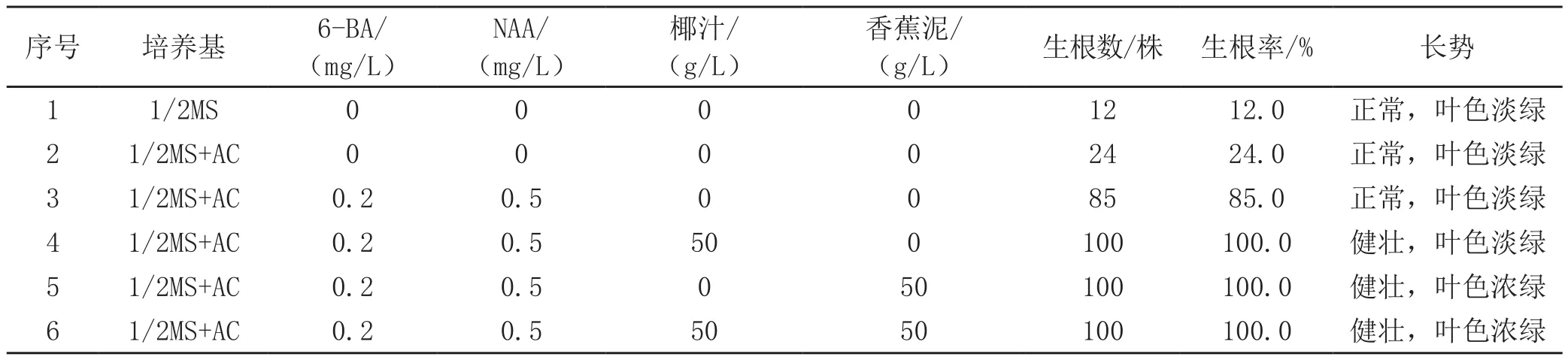
表 2 不同生根培养基对碧玉兰生根的影响

图 3 组培苗生根

图 4 移栽成活
2.4 组培苗的移栽
兰花试管苗自养能力差,移栽养护难度较大,在培养壮苗的基础上应注意温、光、营养、基质等因素与兰花生物学特性相协调,使移栽的兰花逐渐由异养向自养过渡。[4]因此,为了提高碧玉兰组培苗适应自然环境的能力,在移栽前,将生长发育完整的组培苗置于大棚内,自然光培养30 d左右即可移栽,大棚内避免阳光直射及温度过高。移栽时,先把瓶盖打开,用镊子将苗取出洗净培养基,再用多菌灵1 000~1 200倍液浸泡组培苗10 min,然后种在湿透的锯木或者椰糠上。湿度控制在80%~95%之间,定期喷洒杀菌剂,30 d左右即可成活(图4),成活率达90%以上。组培苗种植成活长出新根后才能施肥,否则容易出现烂苗现象。
3 结论
碧玉兰的种子非常细小,每一个蒴果里面有种子无数粒,因此用种子进行组培快繁,可达批量生产的目的,而且不会伤害到原植株。本试验表明:
1)在培养基中添加10%的椰汁对碧玉兰种子的萌发有明显促进作用。
2)若要大量增殖,用原球茎来增殖效果最好。
3)在原球茎密集的瓶内群体生长十分旺盛,幼苗分化率高,反之则低,表现出一定的群体生长效应[2];在对纹瓣兰无菌播种快繁技术研究中也得到类似的结果。
4)在生根阶段的培养基配方中添加50 g/L的香蕉泥对碧玉兰组培苗的生根、壮苗有明显促进作用。
[1]吴征镒,等.云南植物志·第十四卷:种子植物[M].北京:科学出版社,2003:434.
[2] 张铁,李洪超,王国芬.纹瓣兰无菌播种快繁技术研究[J].西南农业学报,2010(3):993-995.
[3]谭文澄,等.观赏植物组织培养技术[M].北京:中国林业出版社,1991:268-277.
[4] 何松林,等.碳源和有机添加物对文心兰原球茎增殖的影响[J].河南农业大学学报,2003(2):257.
(责任编辑 张 铁)
Study on Rapid Propagation Technology of aseptic seeding of Cymbidium lowianum (Rchb.f.) Rchb.f.
LI Hongchao1,2, WANG Xu1, ZHANG Yujie3
(1.School of Life Science,Yunnan Normal University, Kunming 650500,Yunnan, China;
2. Babu Middle School, Malipo County 663605, Yunnan, China; 3. School of Resources and Environment, Wenshan University, Wenshan 663099, Yunnan, China)
Rapid proliferation was done with seeds of Cymbidium lowianum (Rchb.F.) Rchb.F. as explant tissue. Results showed that the seeds can form protocorm in MS medium + NAA0. 5 mg/L + AC1.0 g/L + sugar 30 g/L + coconut milk 100 g/L 50 days after sowing. The best culture medium for differentiation of seedlings from protocorm is 1/2 ms + 6 - BA0.5 mg/L + KT0.5 mg/L + sugar 30 g/L + 100 g/L potato. Differentiated seedlings can be induced to form complete plant in the medium containing 1/2 MS + 6 – BA 0.2 mg/ L + NAA 0.5 mg/L + AC2.0g/L+ Banana juice 50g/L.
Cymbidium lowianum (Rchb.f.) Rchb.f.; Explants; Tissue culture method.
S685.153.8
A
1674 - 9200(2017)03 - 0012 - 03
2017 - 04 - 20
李洪超,男,壮族,云南文山人,麻栗坡县八布中学中学二级教师,云南师范大学生命科学学院硕士研究生,主要从事中学生物教学研究;汪旭,女,天津人,云南师范大学生命科学学院教授,博士,主要从事环境遗传毒性物质、微营养物质与人类健康之间关系研究;张玉洁,女,山东临清人,文山学院环境与资源学院副教授,博士,主要从事应用微生物学研究。

