电解质溶液中粒子浓度大小比较与计算的解题策略
安徽 代海峰
电解质溶液中粒子浓度大小比较与计算的解题策略
安徽 代海峰
当前,粒子浓度大小计算的考题不断推陈出新,考生解题常感到棘手,究其原因是相关基础知识和基本技能掌握不到位,导致不能综合应用,如对水溶液中微观化学过程定量认识的缺乏、对相关守恒规律的理解不透彻、对溶液酸碱性的实质把握不到位等。笔者认为在“双基”过硬的基础上借助定量计算分析不仅有利于问题解决,而且有利于把握问题的本质,掌握一些计算方法对粒子浓度大小比较会起到事半功倍的效果。
1.借助电离度进行计算
电离度α是电离平衡时弱电解质的电离百分率,如果α≤5%,此时酸电离出的H+浓度远大于H2O电离出的H+浓度,可忽略水的电离。以c mol·L-1CH3COOH为例,下式中α指电离度,列出“三段式”计算模式:


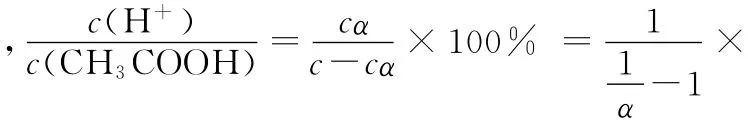
2.借助平衡常数进行计算

平衡常数有助理解电离、水解的强弱及主次规律,增强学生对溶液酸碱性的理性认识,借助电离常数可计算弱酸溶液中粒子浓度大小。多元弱酸溶液中同时存在几个平衡,如H2S水溶液中,有H2O的电离、H2S的一级电离和二级电离平衡。体系中同时存在未电离的H2S以及HS-、S2-、H+和OH-。H+有三个来源,由于酸性溶液中H2O的电离程度大大减小,由H2O电离产生的H+可忽略不计,又因二级电离比一级电离困难得多,因此,溶液中的H+主要是由一级电离产生的,计算时可作近似处理。但溶液中的H+浓度只有一个,它必须同时满足上述三个平衡关系式的要求。
例2 室温下,饱和H2S水溶液中,c(H2S)=0.1mol·L-1,求该溶液中的H+、HS-和S2-浓度。
设溶液中H+浓度为x
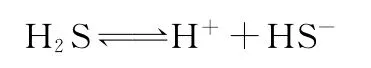
平衡浓度/mol·L-10.1-x x x
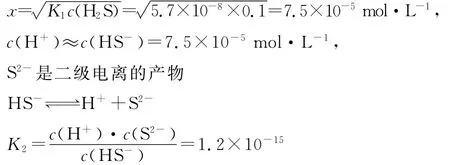
由于第二步电离非常小,可认为c(H+)≈c(HS-),得c(S2-)=K2=1.2×10-15mol·L-1。

例3 计算0.1mol·L-1Na2CO3溶液的pH。
Kh1Kh2,当一元弱酸强碱盐处理,设溶液中OH-浓度为x

平衡浓度/mol·L-10.1-xxx
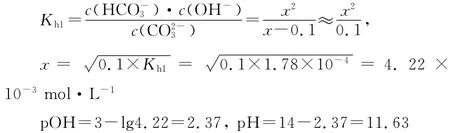
另外,溶度积常数也可用于比较或计算粒子浓度大小。需要提醒的是,对于同类型的化合物如AgCl、AgBr、AgI,Ksp表示式相似,Ksp越小,对应难溶电解质的溶解度就越小,但不同类型的化合物如AgCl与Ag2CrO4,就不能直接从Ksp比较它们溶解度的大小。
例4 比较AgCl、Ag2CrO4饱和溶液中Ag+浓度大小。
解析:设AgCl、Ag2CrO4饱和溶液中Ag+浓度大小分别为xmol·L-1,ymol·L-1

Ksp(Ag2CrO4)<Ksp(AgCl),而经过计算可知饱和溶液中Ag+浓度Ag2CrO4>AgCl。
3.借助守恒规律进行计算
电解质溶液中存在物料守恒、电荷守恒、质子守恒3个守恒规律,它们是考查的重点,同时也是难点,在3个守恒规律基础上进行数学运算也是考查方式之一,如“0.2mol·L-1某一元弱酸HA溶液和0.1mol·L-1NaOH溶液等体积混合后的溶液:2c(OH-)+c(A-)=2c(H+)+c(HA)”属高频热点,混合时HA与NaOH发生中和反应,则混合液溶质为浓度相等的HA和NaA,电荷守恒、物料守恒依次为c(H+)+c(Na+)=c(OH-)+c(A-) ①、c(A-)+c(HA)=2c(Na+) ②,进行①×2+②处理即可求解。
例5 (1)常温下,pH相等的氨水、NaOH溶液,比较c(Na+)、c(NH+4)的大小关系。
(2)已知HF的酸性比HCN的酸性强,现有相同温度下物质的量浓度相同的NaF和NaCN两种溶液,试比较两份溶液中离子总浓度的大小关系。
解析:上述问题均可以借助电荷守恒巧妙解决。(1)氨水、NaOH溶液电荷守恒依次为c(H+)1+c(NH+4)=c(OH-)1、c(H+)2+c(Na+)=c(OH-)2,由于常温下c(H+)·c(OH-)=Kw为一定值,pH相等的两份溶液c(H+)1=c(H+)2、c(OH-)1=c(OH-)2,则可推知c(NH+4)=c(Na+)。(2)一元弱酸盐NaA溶液电荷守恒为c(H+)+c(Na+)=c(OH-)+c(A-),则NaA溶液离子总浓度为c(H+)+c(Na+)+c(OH-)+c(A-)=2c(H+)+2c(Na+),NaF和NaCN物质的量浓度相同,则两者c(Na+)相等,所以两份溶液中离子总浓度的大小取决于c(H+),根据越弱越水解,HF的酸性比HCN的酸性强,CN-水解程度比F-大,则NaCN中c(H+)比NaF中c(H+)小,所以NaF溶液中离子总浓度大于NaCN溶液中离子总浓度。
解题策略
1.掌握正确的解题思路
粒子浓度大小问题的解决一般遵循:基于两个核心理论,即强弱电解质的电离理论、盐类的水解平衡理论;紧扣3个守恒规律,即电荷守恒、物料守恒、质子守恒;遵循一般思维流程,即写出动态平衡表达式→确定溶液中粒子种类→结合题给信息,尤其挖掘隐含信息,明确“电离”“水解”主次关系→解决相关“等式”“不等式”。需要说明的是,解题时应注重将复杂问题合理分解,对典型题一题多解训练思维品质,通过多题一法领悟解决问题的方法和诀窍,实现知识的系统化、方法的规律化,在把握双基的基础上达成综合应用。
2.注重难点的灵活突破
针对粒子浓度大小计算的难点问题,应注重解题指导,以解决问题为目的,从不同角度对问题进行分析解决。借助平衡转化、守恒规律、电离常数等定量化思维的方法各有优越性,平衡转化、守恒关系比较符合学生的知识结构和认知特点;而平衡常数可降低学生抽象思维的难度,它是理解水溶液平衡体系的重要工具,拓展一些解题思路。值得一提的是,酸式盐、弱酸(碱)及其盐的混合液是考查的重点和难点,笔者建议在教学中可借助平衡常数帮助学生定量化理解粒子浓度的大小关系,充分发挥其应有的价值和功能,有助于难点突破。
综上所述,将化学基本原理与数学方法合理融合探讨水溶液中的平衡体系,多角度解决粒子浓度大小的难点问题,有助讲透一些化学事实,也有助于培养学生化学学习的兴趣。
(作者单位:安徽省太和一中)

