多原子粒子中的中心原子价层电子对数计算方法及其应用
安徽 徐清硕
多原子粒子中的中心原子价层电子对数计算方法及其应用
安徽 徐清硕
多原子粒子(分子或离子)中的中心原子价层电子对数的计算至关重要,它决定着价层电子对互斥理论模型(VSEPR模型)及中心原子杂化类型,同时还决定着粒子的立体构型。人教版教材中有关中心原子价层电子对数的计算方法较为烦琐,不利于学生掌握,现结合个人的学习心得体会介绍两种比较简单的计算方法,希望对同学们有所帮助。
一、根据多原子粒子的价电子构型计算中心原子价层电子对数
1.多原子分子中的中心原子价层电子对数计算
(1)先确定多原子分子中的中心原子的价电子数(主族元素原子即为其最外层电子数)及周围原子的未成对电子数(未成对电子数=8-主族序数)。
(2)再根据周围原子数目及周围原子的未成对电子数画出多原子分子的价电子构型(包括共价键和孤电子对)。
(3)中心原子的价层电子对数=σ键个数(1个共价键只有1个σ键)+孤电子对数。
例1 根据上述方法确定下表中各分子中的中心原子的价层电子对数。
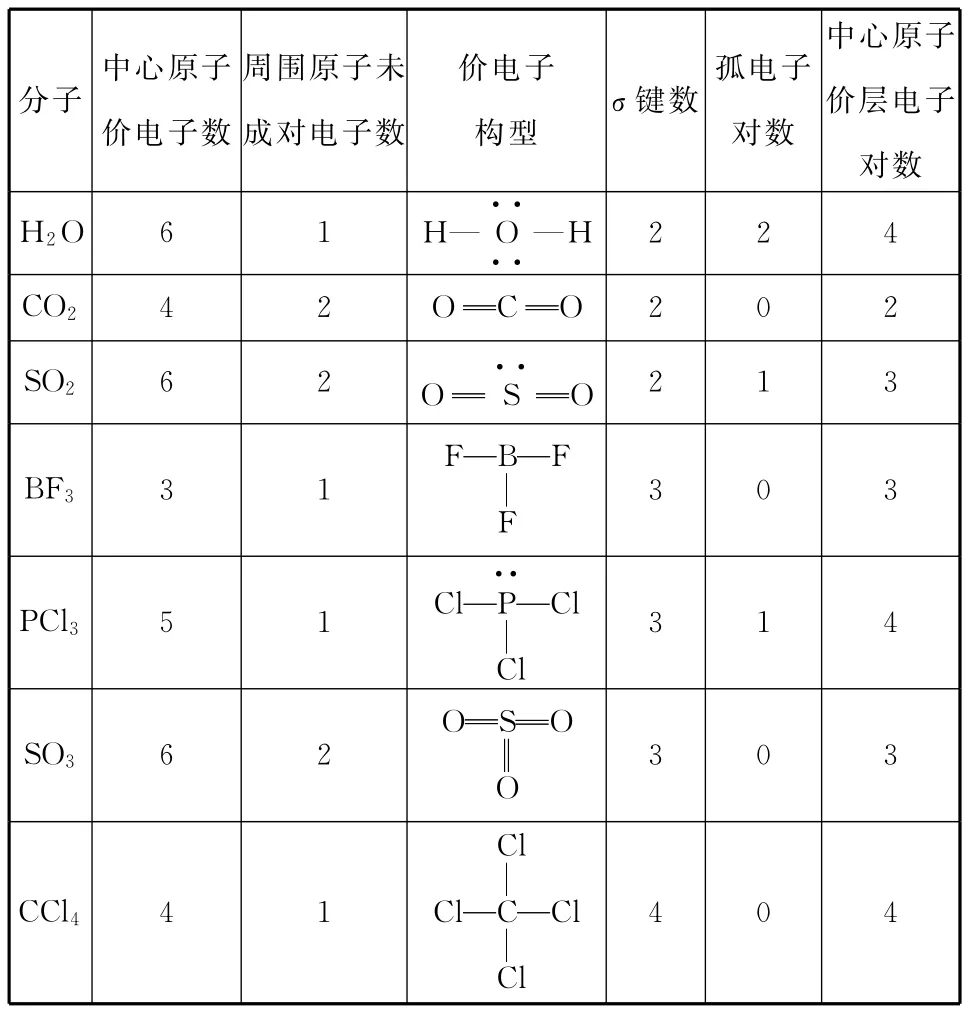
分子价电子构型σ键数中心原子价电子数周围原子未成对电子数孤电子对数中心原子价层电子对数H2O 6 1 H—O····—H 2 2 4 CO24 2OC O 2 0 2 SO26 2O SO··2 1 3 FBF BF33 1F 3 0 3 PCl35 1 P··ClClCl 3 1 4 OSO SO36 2O 3 0 3 CCl4Cl 4 1ClCCl 4 0 4Cl
2.多原子离子中的中心原子价层电子对数计算
(1)先把离子所带电荷数当作中心原子得失的电子,即可确定中心原子的价电子数(最外层电子数±离子所带电荷数)。
(2)再根据周围原子数目及周围原子的未成对电子数画出多原子离子的价电子构型(包括共价键和孤电子对)。
(3)中心原子的价层电子对数=σ键个数+孤电子对数。
例2 根据上述方法确定下表中各离子中的中心原子的价层电子对数。
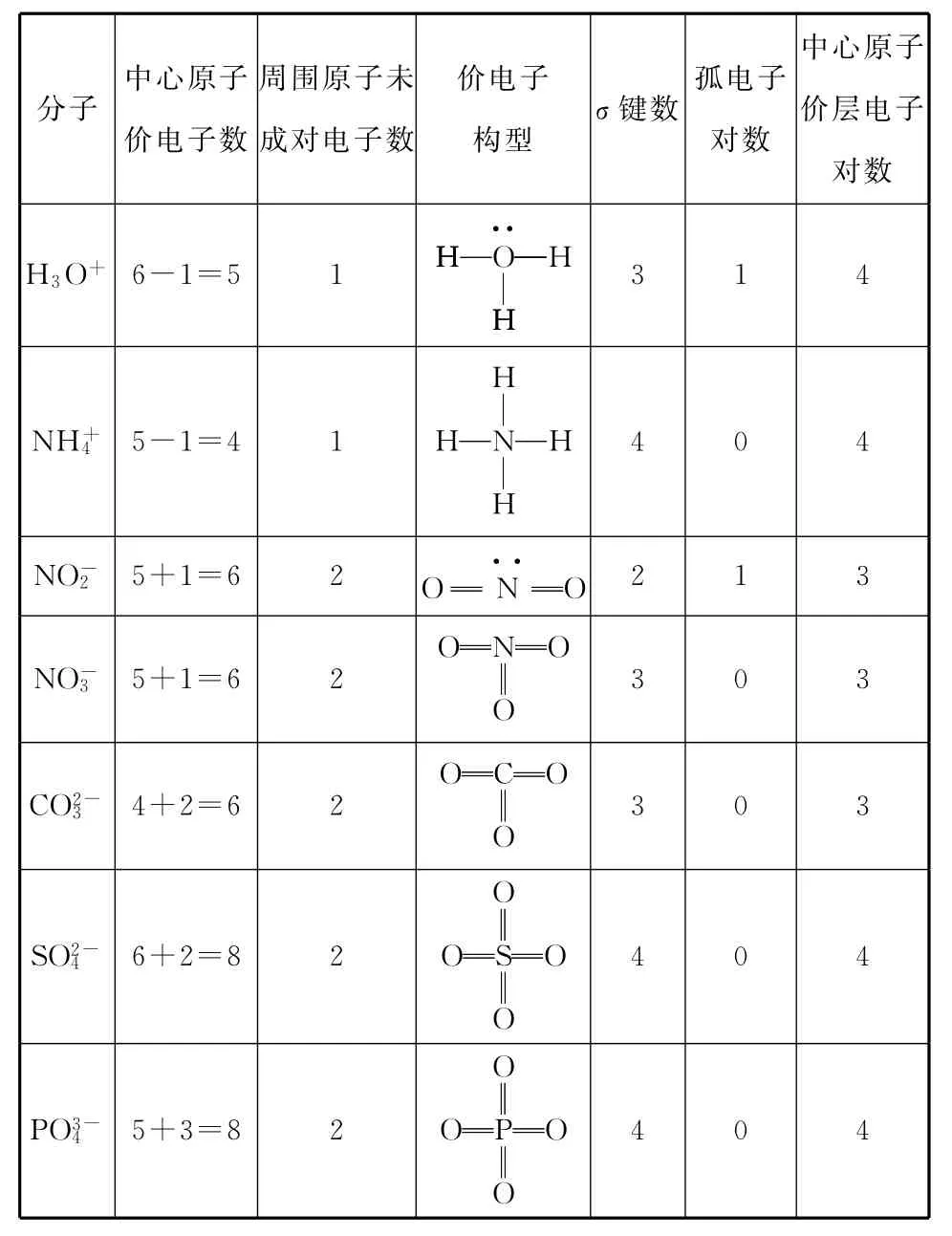
分子中心原子价电子数周围原子未成对电子数价电子构型σ键数孤电子对数中心原子价层电子对数H3O+6-1=5 1O··H H HHH 314 H NH+45-1=41NHHHH 4 0 4 NO-25+1=6 2O N··O2 1 3 ON NO-35+1=6 2OO 3 0 3 OC CO2-34+2=6 2OO 3 0 3 SO2-46+2=8 2SO O 4 0 4 OO PO3-45+3=8 2PO O OO404
3.多原子分子中的多中心原子的价层电子对数计算
可先把此类多中心原子分子的结构式画出,分析其中一个中心原子的成键情况及孤电子对存在情况:
(1)先画出此类多原子分子的结构式。
(2)再根据其中一个中心原子的最外层电子数及成键情况,分析该中心原子有无孤电子对,若有就标在中心原子上。
(3)中心原子的价层电子对数=σ键个数+孤电子对数。
例3 根据上述方法确定下表中各分子中的中心原子的价层电子对数。

分子价电子构型σ键数中心原子价电子数周围原子未成对电子数孤电子对数中心原子价层电子对数H2O26 1 H—O····—O—H 2 2 4 S2Cl26 1 Cl—S····Cl 2 2 4 N2H45 1 N··—S—HHHHH3 1 4 NH C2H64 1CHHHC HHH 4 1 4 C2H44 1CHHHCH 3 0 3 C2H24 1 H—C≡C—H 2 0 2
二、根据经验公式1/2(a+xb)计算中心原子价层电子对数
多原子粒子中心原子的价层电子对数=1/2(a+xb)
其中,a为中心原子的价电子数(即最外层电子数),若为多原子离子,a为中心原子的价电子数±离子所带电荷数。x为周围原子数。b为周围原子的未成对电子数,其中周围原子为O、S时,b视为0。
例 根据上述方法确定下表中各粒子中的中心原子的价层电子对数。
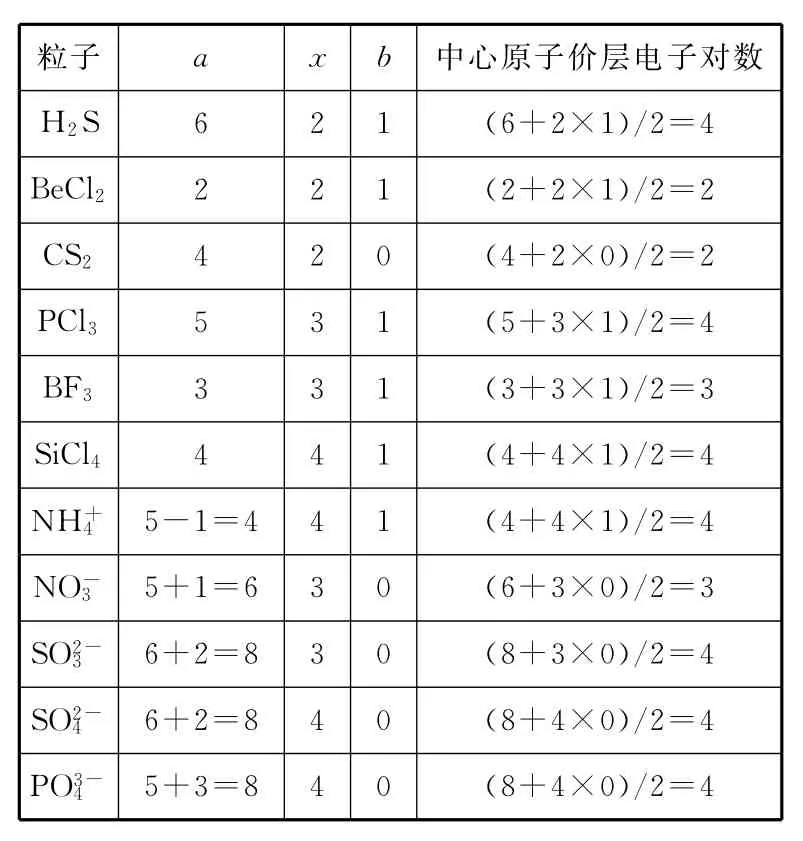
粒子a x b 中心原子价层电子对数H2S 6 2 1(6+2×1)/2=4 BeCl22 2 1(2+2×1)/2=2 CS24 2 0(4+2×0)/2=2 PCl35 3 1(5+3×1)/2=4 2=3 SiCl44 4 1(4+4×1)/2=4 NH+BF33 3 1(3+3×1)/35+1=6 3 0(6+3×0)/2=3 SO2-45-1=4 4 1(4+4×1)/2=4 NO-36+2=8 3 0(8+3×0)/2=4 SO2-46+2=8 4 0(8+4×0)/2=4 PO3-45+3=8 4 0(8+4×0)/2=4
三、价层电子对数应用
1.价层电子对数与杂化类型的关系
(1)中心原子的价层电子对数等于杂化轨道数。
(2)根据杂化轨道数即可确定中心原子的杂化类型:
杂化轨道数为2,中心原子杂化方式为sp杂化。
杂化轨道数为3,中心原子杂化方式为sp2杂化。
杂化轨道数为4,中心原子杂化方式为sp3杂化。
例1 请指出下列各粒子中的中心原子的杂化方式。
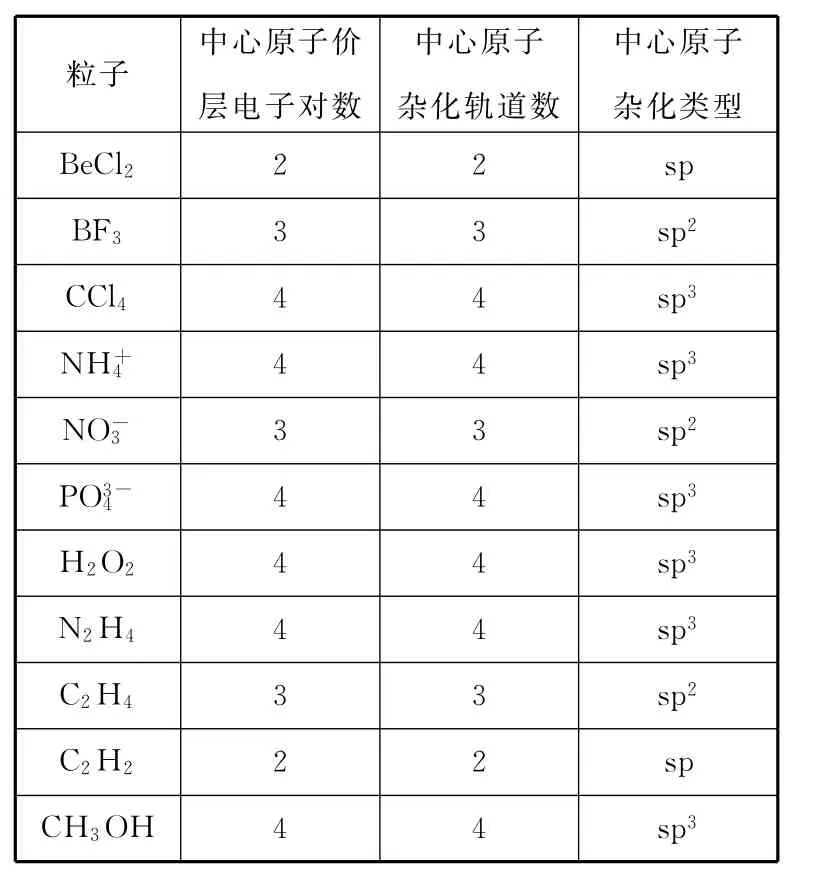
中心原子杂化类型BeCl22 2sp BF33 3sp2CCl44 4sp3NH+粒子中心原子价层电子对数中心原子杂化轨道数4 4sp3NO-4 4 4sp3H2O24 4sp3N2H44 4sp3C2H43 3sp2C2H22 2sp CH3OH 4 4sp33 3sp2PO3-34
2.价层电子对数与多原子粒子(分子或离子)立体构型关系
(1)根据中心原子价层电子对数可确定价层电子对互斥理论模型(VSEPR模型):
中心原子价层电子对数为2,VSEPR模型为直线形。
中心原子价层电子对数为3,VSEPR模型为平面三角形。
中心原子价层电子对数为4,VSEPR模型为四面体形。
(2)根据VSEPR模型和中心原子的孤电子对数可确定粒子的立体构型:
略去VSEPR模型中的中心原子上的孤电子对,即可得到多原子粒子的立体构型。
①中心原子价层电子对数为2时,中心原子无孤电子对数,其粒子立体构型为直线形。
②中心原子价层电子对数为3时,中心原子无孤电子对数,其粒子立体构型为平面三角形;中心原子孤电子对数为1,其粒子立体构型为V形。
③中心原子价层电子对数为4时,中心原子无孤电子对数,其粒子立体构型为四面体形;中心原子孤电子对数为1,其粒子立体构型为三角锥形;中心原子孤电子对数为2,其粒子立体构型为V形。
例2 请指出下列各粒子中的中心原子的杂化方式。

VSEPR模型粒子价电子构型价层电子对数孤电子对数粒子立体构型H2O H—O····—H 4四面体形2 V形SO2O S··O 3平面三角形1 V形FBF BF3F 3平面三角形0平面三角形PCl3P··ClClCl 4四面体形1三角锥形OSO SO3O 3平面三角形0平面三角形CCl4CClClCl 4正四面体形0正四面体形Cl
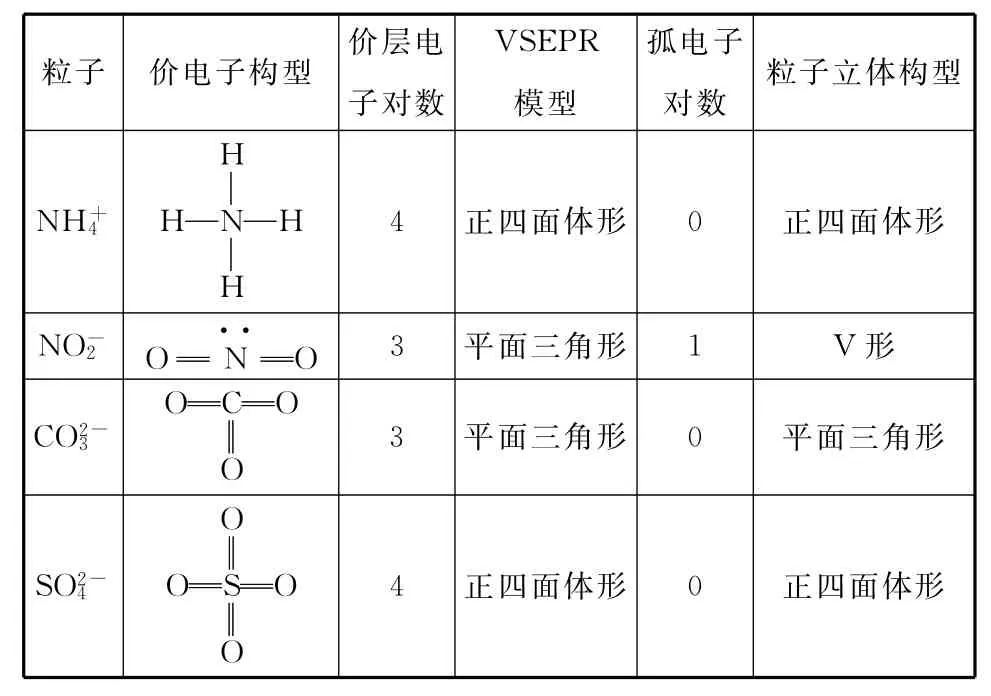
续表
(指导教师:徐文华 安徽省濉溪中学)
(作者单位:安徽省濉溪中学高二4班)

