有关三大常数的微计算与备考指导
江苏 陈仕功
有关三大常数的微计算与备考指导
江苏 陈仕功
电离常数、化学平衡常数、溶度积常数成为高考化学命题中的三大利器,虽属新课标新增内容,但因其“高大上”的气场而频频上卷,备受师生青睐,主要是依托常数本身进行变形或拓展计算,凸显对学生能力的考查。
一、多元弱电解质的电离常数计算及应用

【备考指导】掌握弱电解质的电离方程式书写及对应的电离常数表达式,再将相关的电离方程式叠加(如加减、扩大或缩小倍数)或作相关变形后的叠加(如反应的始终状态相反),得到答题所需的化学反应式,电离常数依次进行相应的整合(如乘除、多少次方或多少次方分之一),即得所需的平衡常数。
二、正、逆速率常数计算化学平衡常数
例2 (2016海南)顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如下转化:
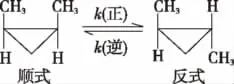
该反应的速率方程可表示为v(正)=k(正)c(顺)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正、逆反应速率常数。回答下列问题:
(1)已知:t1温度下,k(正)=0.006s-1,k(逆)=0.002s-1,该温度下反应的平衡常数值K1=________。
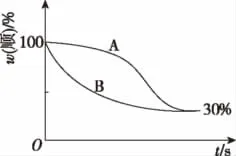
(2)t2温度下,图中能表示顺式异构体的质量分数随时间变化的曲线是________(填曲线编号),平衡常数值K2=________。
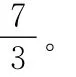
例3 (2015新课标Ⅰ)Bodensteins研究了下列反应:
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
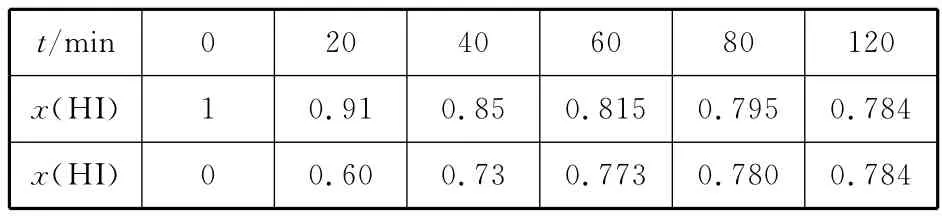
t/m i n 0 2 0 4 0 6 0 8 0 1 2 0__x(H I)0 0.6 0 0.7 3 0.7 7 3 0.7 8 0 0.7 8 4 1 0.9 1 0.8 5 0.8 1 5 0.7 9 5 0.7 8 4 x(H I)
(1)根据上述实验结果,该反应的平衡常数K的计算式为____________________________________________________。
(2)上述反应中,正反应速率为v正=k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为________(以K和k正表示)。
【解析】(1)反应前后气体体积相等,不同的起始状态达到等效的平衡状态。
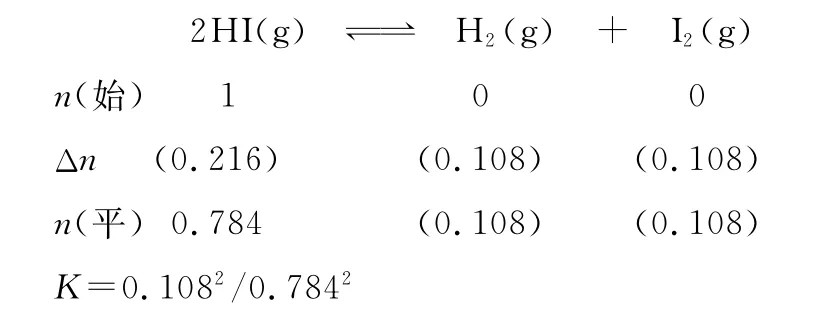
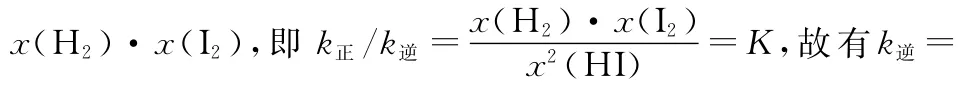
【备考指导】能根据可逆反应的化学方程式,写出该反应化学平衡常数的表达式,带入具体浓度数值进行相关计算。对于上述题给信息,根据正逆反应速率表达式,利用平衡时v正=v逆,得出化学平衡常数K与正、逆反应速率常数k正、k逆的相互关系。
三、难溶电解质的溶度积常数计算及应用
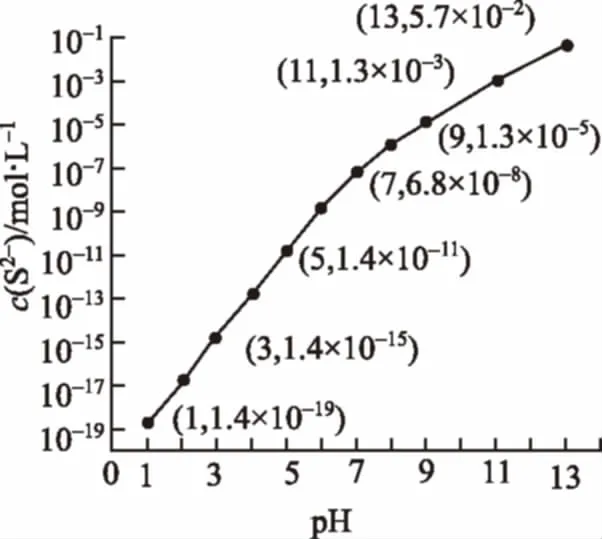
例4 (1)(2015福建)25℃,某溶液含0.020mol·L-1Mn2+、0.10mol·L-1H2S,当溶液pH=_________时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(2)(2015新课标Ⅰ)某浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中c(I-)/c(Cl-)为__________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
【解析】(1)由于Ksp(MnS)=2.8×10-13,某溶液含0.020mol·L-1Mn2+,则开始形成沉淀时的c(S2-)=Ksp(MnS)/c(Mn2+)=2.8×10-13/0.020=1.4×10-11mol·L-1。
【备考指导】掌握难溶电解质的溶度积常数Ksp的表达式及相关计算,题目信息得知两种沉淀共存,根据溶解平衡表达式,构建新的沉淀转化平衡方程式,得出新反应的平衡常数K与Ksp的相互关系,带入数值,即得相关离子浓度比的数值。
四、多种常数计算的综合应用
例5 (2016新课标Ⅰ)室温下,初始浓度为1.0mol·L-1的Na2CrO4溶液中c(Cr2O2-7)随c(H+)的变化如图所示。
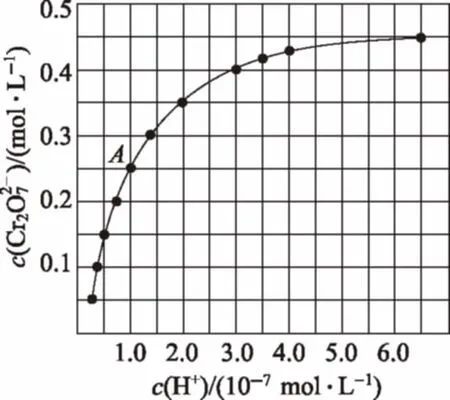
(1)由图可知,溶液酸性增大,CrO2-4的平衡转化率________(填“增大“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为________。
(2)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO2-4生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为_____mol·L-1,此时溶液中c(CrO2-4)等于_____mol·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
(2)当溶液中Cl-完全沉淀时,即c(Cl-)=1.0×10-5mol·L-1,根据Ksp(AgCl)=2.0×10-10,得c(Ag+)=Ksp(AgCl)/c(Cl-)=2.0×10-10/1.0×10-5=2.0×10-5mol·L-1。此时溶液中c(CrO)=Ksp(Ag2CrO4)/c2(Ag+)=2.0×10-12/(2.0×10-5)2=5×10-3mol·L-1。
【备考指导】阅读图形,利用物质的转化率和具体的方程式求算该反应的平衡常数,注意化学计量数以及纯液体等事项;根据Cl-完全沉淀时的浓度和Ksp(AgCl),求出此刻的c(Ag+),再依据Ksp(Ag2CrO4),求出c(CrO)的临界数值。
综上所述,高考试题中直接计算三大常数的试题越来越少了,在微计算中,通常以多个常数综合应用、一个表达式多次变形整合、构建新的平衡体系从而产生新的平衡常数等形式呈现,体现“知其然,更知其所以然”的命题特点。
(作者单位:江苏省响水中学)

