氮掺杂碳纳米管活化过一硫酸盐降解酸性橙AO7
王 莹,魏成耀,黄天寅,吴 玮,陈家斌(苏州科技大学环境科学与工程学院,江苏 苏州 215009)
氮掺杂碳纳米管活化过一硫酸盐降解酸性橙AO7
王 莹,魏成耀,黄天寅,吴 玮,陈家斌*(苏州科技大学环境科学与工程学院,江苏 苏州 215009)
采用氮掺杂多壁碳纳米管(N-CNT)作为固体活化剂,活化过一硫酸盐(PMS)氧化降解偶氮染料酸性橙7(AO7).结果表明,N-CNT活化PMS降解AO7比颗粒活性炭(GAC)效果好,N-CNT投加量为400mg/L、n(PMS)/n(AO7) 为 40/1时,反应60min可使AO7的脱色率达到99%; 研究了N-CNT活化PMS降解AO7的降解机制,发现N-CNT活化PMS产生的自由基主要是SO4-•,活化场所在N-CNT的表面.在N-CNT/PMS体系中,初始pH值对降解AO7有较大的影响,当pH = 3.0时AO7降解效果最好; Cl-、SO42-和CO32-离子对AO7降解都存在一定促进作用,离子浓度越高,AO7降解速率越快.紫外可见光谱、TOC分析表明AO7分子中偶氮键及萘环结构均被破坏,并进一步矿化为CO2和H2O.
氮掺杂碳纳米管;过一硫酸盐;酸性橙7
偶氮染料是分子结构中含有一个或多个偶氮基(–N=N–)的染料,其生产废水具有毒性强、含盐量高、致突变、致癌、难降解等特点[1-2],不经处理直接排放会对环境造成严重污染.偶氮染料废水常用的处理方法有吸附[3]、膜过滤[4]、光催化[5-6]、臭氧化[7-8]等.
普通碳纳米管(CNT)因具有比表面积大、热稳定性高、独特管腔和吸附特性以及特有的电学特性等性质,已作为新型催化材料引起了人们的极大兴趣,取得了广泛的应用,例如在其力学性能方面,CNT的强度比其他纤维强度约高 200倍,加之CNT的韧性很好,使其可以广泛应用于微米甚至纳米机械;同时,CNT还是一种新型超导材料,具有很高的临界超导电流,这为热敏电阻辐射器件的研制和开发提供了条件.目前,CNT的制备方法主要有石墨电弧法、激光蒸发法和催化热解法.
当碳纳米管掺入氮(N-CNT)之后,改变了碳原子周围的电子云密度,使其具有良好的电子传导性,其电子效应也在催化材料方面展示出独特性能.目前,氮掺杂碳纳米管的制备方法可以分为3:(1)同步原位掺杂,即在CNT生成过程中进行掺杂; (2)高温碳化含氮高分子; (3)在含氮条件下,对碳纳米管进行后处理,如采用等离子体、水热等方法进行氮掺杂.氮掺杂将影响CNT的状态密度、微分电容、体电导率和功函数等电化学及电子性质,使得碳纳米管可实现较低电位下氧的吸附解离,从而具有氧化还原反应催化活性.
碳纳米管具有独特的电学,机械和结构性能.由于氮和碳的原子半径相差不多,所以在六边形石墨网状结构的碳纳米管中经常用氮原子来取代碳原子以改变碳纳米管的电学和化学性能,从而使碳纳米管具有某些特殊功用,如催化载体,传感器和碳极等.在催化剂载体研究领域,科学家们发现碳纳米管中的氮掺杂原子本身还具有氧还原催化活性,从而使非贵金属负载的 N-CNT作为催化材料的研发备受关注.本文采用 N-CNT活化 PMS降解 AO7,分析其降解过程; 研究了AO7降解的主要影响因素(N-CNT投加量、PMS浓度、初始pH值、温度、离子浓度),并对各反应条件对降解反应进行分析.
1 材料与方法
1.1 材料
实验用氮掺杂多壁碳纳米管(N-CNT)主要特性为:外直径 30~50nm,长度 10~30um,氮含量2.98wt%,比表面积>78.9m2/g,购于南京先丰纳米材料科技有限公司;过一硫酸盐(HKSO5· 0.5KHSO4· 0.5K2SO4,PMS)购于Sigma-Aldrich;酸性橙 7(AO7)购于国药集团化学试剂有限公司,苯酚(phenol)、甲醇(CH3OH)、叔丁醇(C4H9OH)、盐酸(HCl)、硫酸(H2SO4)、氯化钠(NaCl)均为分析纯购于国药集团化学试剂有限公司.实验用水为去离子超纯水.
1.2 降解实验
在一定的温度下,将250mL配好的AO7溶液注入锥形瓶,锥形瓶采用磁力搅拌器混合.加入一定量的PMS,用稀H2SO4或NaOH调节pH值,然后迅速加入一定量的 N-CNT启动反应,每隔一段时间取样且样品经 0.45µm滤膜过滤后,立即测定.
1.3 分析方法
使用Mapada UV-1600(PC)紫外可见分光光度计,于AO7最大吸收波长484nm处测定滤液的吸光度,带入标准曲线求得浓度c; AO7矿化率采用总有机碳分析仪(TOC-LCPH,岛津)测定; 傅立叶红外光谱分析仪(FTIR,美国 Thermo公司, Nicole-6700型号)测定N-CNT表面活性官能团; Quanta FEG 250扫描电子显微镜(美国FEI公司)测定碳纳米管表面形貌特征.
2 结果与讨论
2.1 FT-IR以及表面形貌分析
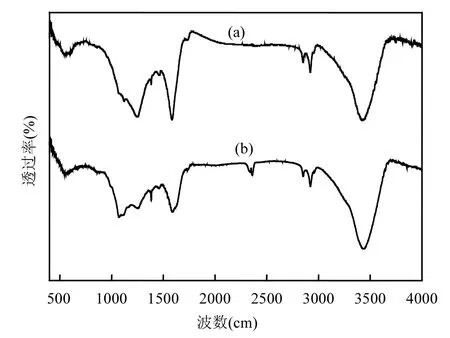
图1 N-CNT催化前后的FT-IR图谱(a)活化反应前;(b)活化反应后Fig.1 FT-IR spectra of the N-CNT: (a) before the catalysis; (b) after the catalysis
氮掺杂多壁碳纳米管在催化反应前后的FT-IR谱图如图1所示:3430cm-1处为O–H伸缩振动吸收峰[24];在 2917cm-1处的吸收峰为-CH3、-CH2的对称和反对称振动峰;2310cm-1附近对应–C≡C–的累积双键伸缩振动区; 1630cm-1附近的吸收峰是N-CNT表面羧基及内酯基中的C=O特征伸缩振动峰;1170cm-1处可归于CH2–O–CH2中的C–O对称伸缩振动峰[25].从图2中可以看出,N-CNT表面有大量活性官能团,且经过活化反应后N-CNT表面在2310处振动峰有明显增大,证明可能是碳质材料表面的含氧酸性官能团活化过一硫酸盐[19]降解AO7.
图 2为原始碳纳米管和氮掺杂碳纳米管的扫描电镜照片.通过与原始碳纳米管的形貌比较可以看出,经含氮有机物处理后的碳纳米管的形貌并未发生明显的变化,即基本保持了原有的形貌特征,而不像强酸(如硝酸)、强碱(如强氧化钾)或强氧化型物质(如高锰酸钾)等处理时发生碳纳米管被切短、刻蚀而导致碳纳米管本征形貌和结构被破坏的现象[21].
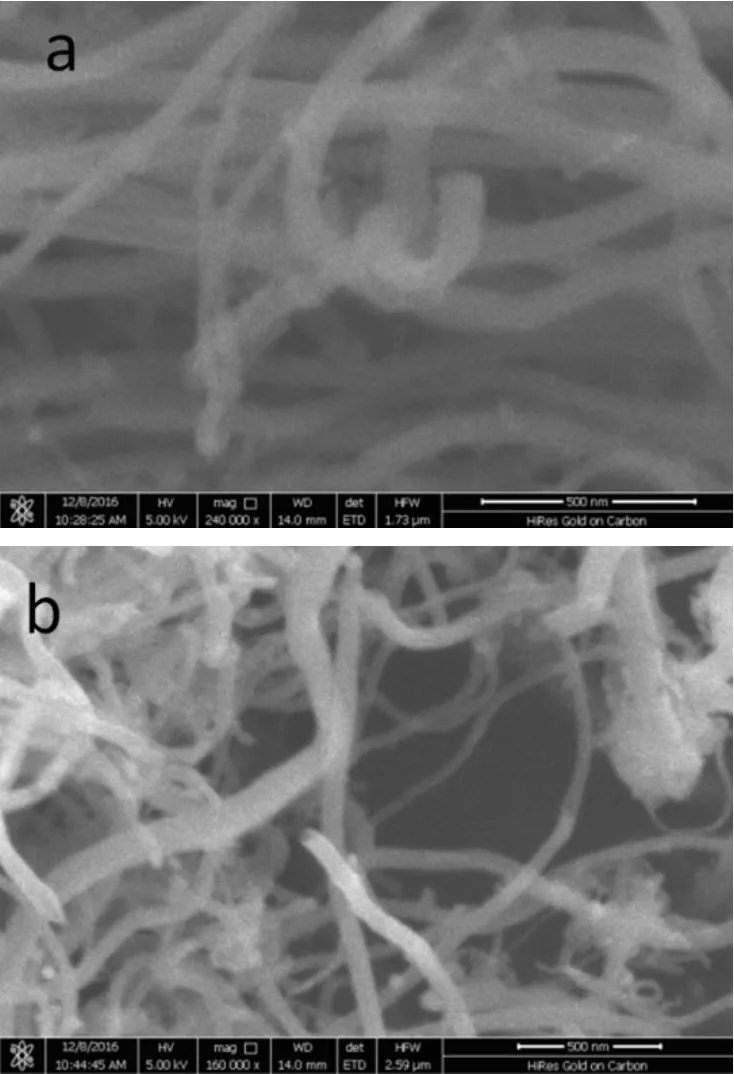
图2 CNT和N-CNT扫描电镜照片Fig.2 SEM images of as-prepared CNT (a) and N-CNT (b)
2.2 N-CNT活化性能
图3显示了AO7在不同反应体系中的降解效果.从中可看出,在 60min内,PMS单独氧化体系脱色率仅为2%,同时GAC和N-CNT对AO7的吸附效果也不明显,脱色率分别为 27.5%和17.9%,在 PMS/GAC体系中AO7的脱色率可达48.3%,然而在N-CNT/PMS体系中AO7的脱色率可达到 97%.由此得出,PMS单独氧化降解AO7速率较低,GAC和N-CNT对AO7的吸附作用也不明显,但N-CNT/PMS体系能够高效氧化降解 AO7,其效果远优于 PMS/GAC体系. Zhang[26]等曾报道GAC可以活化PMS产生•氧化降解染料 AO7,由此可认为,N-CNT活化PMS产生SO-4•的效率要比GAC强的多,更利于偶氮染料AO7的氧化降解.
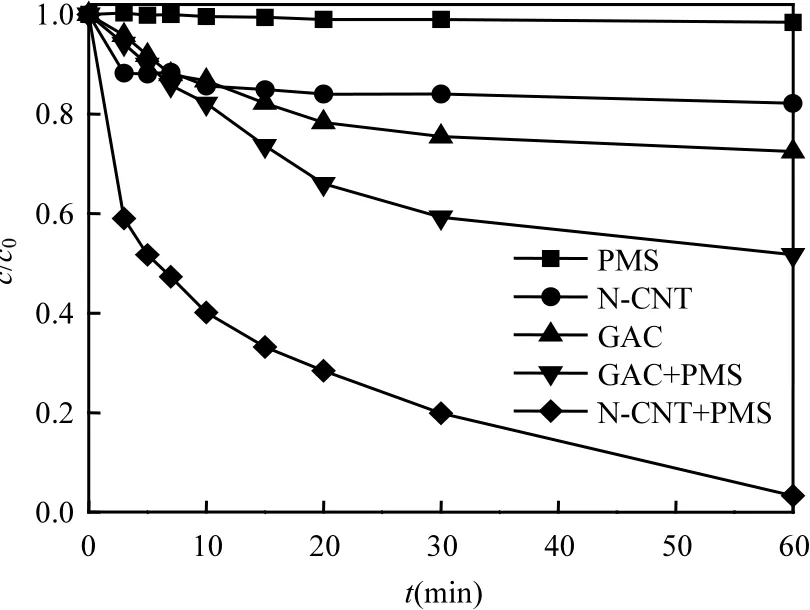
图3 不同体系AO7的降解效果Fig.3 Degradation of AO7 in different systems
2.3 N-CNT活化机理

图4 N-CNT/PMS体系中不同的自由基抑制剂对AO7的降解Fig.4 Degradation of AO7in the N-CNT/PMS system inthe presence of different radical scavengers
2.4 N-CNT投加量的影响

图5 N-CNT投加量对AO7降解的影响Fig.5 Effect of N-CNT dosage on the removal of AO7
N-CNT投加量对降解AO7的效果如图5所示.固定PMS投加量为40mg/L,60min时N-CNT对AO7吸附了1.6%,在加入一定量PMS之后,相同浓度下的N-CNT降解AO7达到31.3%;投加量增加至 200mg/L时,PMS/N-CNT系统内AO7在60min 时完全降解; 继续增大投加量为400mg/L时,AO7在20min就可完全降解.主要原因是N-CNT用量增加,提供了更多的活化点位,活化效果增强;同时由于N-CNT的用量的增加,对染料AO7的吸附量也略微提高.
2.5 PMS浓度的影响
图6为不同PMS浓度对AO7降解的影响.可以看出,与N-CNT用量对AO7降解的影响相似,随PMS浓度的增大,AO7降解速度越快,降解完全所需时间越短.当n(PMS):n(AO7)为10:1时,反应至 60min时 AO7仅降解 59.5%; 然而当n(PMS): n(AO7)为20:1、40:1时,反应至60min时 AO7分别降解了 81.4%和 97.3%.继续增大PMS用量至n(PMS): n(AO7)= 80:1,AO7降解至99%以上仅需30min.有研究认为,当PMS浓度过高时,自由基相互反应,产生氧化能力较弱的 SO—5·等[见式(1) ~ (2)].因此PMS浓度应控制在适当范围,后续实验选取n(PMS): n(AO7)为40:1.
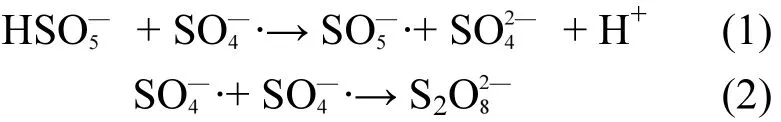
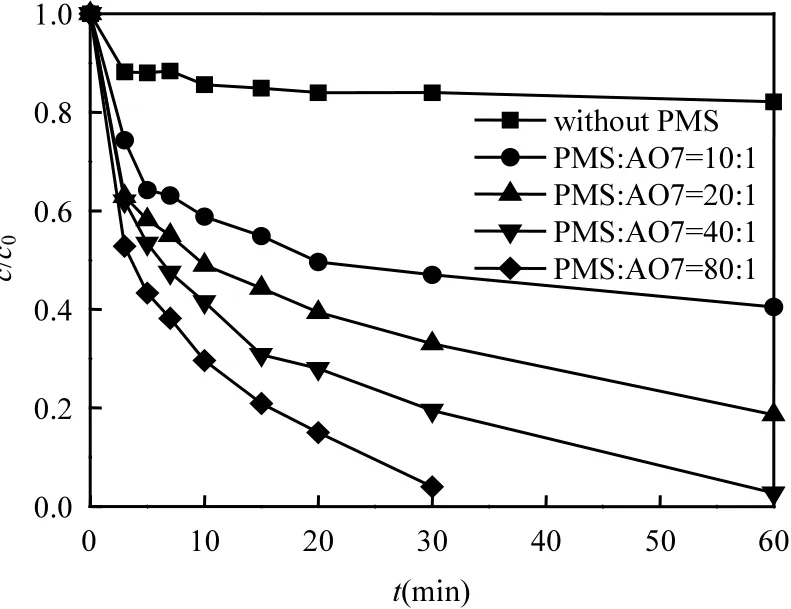
图6 PMS浓度对AO7降解的影响Fig.6 Effect of PMS concentration on the removal of AO7
2.6 pH值的影响
图7显示了不同初始pH值对反应活化体系降解AO7的影响.从中可知,在pH值为3时反应速率最快,且随着pH值的增大,在pH值分别为5、7、9时,反应速率逐渐降低.这一现象可能与N-CNT的表面零电荷点有关.当溶液 pH<pHpzc时,N-CNT表面带正电荷,有利于阴离子染料吸附;当溶液pH > pHpzc时,N-CNT表面带负电荷,有利于阳离子染料的吸附[19].经测得 N-CNT的pHpzc为 4.4,所以当溶液 pH值分别为 5、7、9时,N-CNT表面带负电荷.由于AO7属于阴离子偶氮染料,导致AO7与N-CNT的表面产生相互排斥的效果,使得表面反应不容易进行;同时,在碱性条件下,SO—4·易转化为HO·,且HO·会与OH—反应使氧化剂淬灭[见式(3)~(4)].
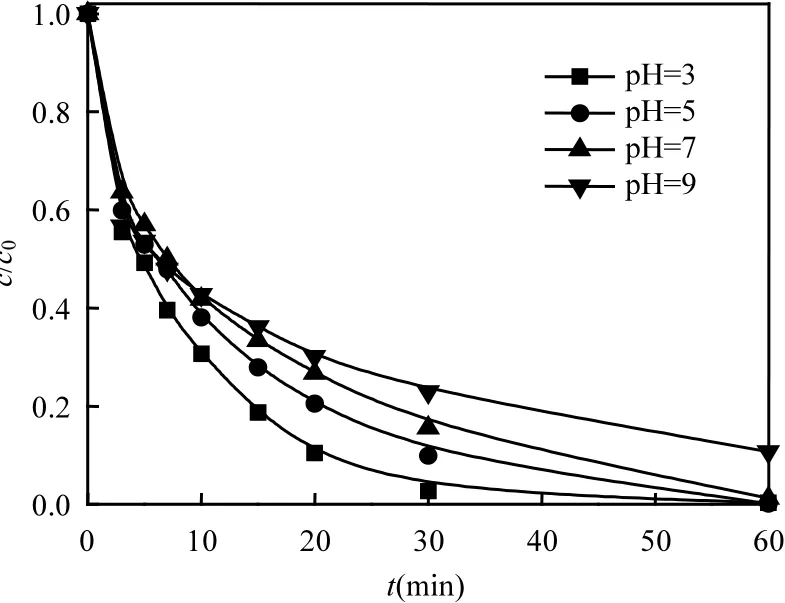
图7 初始pH值对AO7降解的影响Fig.7 Effect of initial pH on the removal of AO7
2.7 温度变化的影响
温度通常是活化反应中的关键因素,如图8(a)所示,考察了不同温度条件下活化降解 AO7效果.可以看出,PMS单独活化降解AO7受温度影响较小,在60℃下反应60min时,AO7降解率仅为5.5%;而N-CNT活化PMS降解AO7,随反应体系温度升高,降解速率加快.当在 50℃时,NCNT活化降解AO7在20min时降解率可达到99.5%,而当在60℃时,AO7降解完全仅需15min.这可能是因为在高温条件下 N-CNT更易活化PMS产生,并且染料分子在高温下容易克服反应活化能.由图 8(b)可知,在不同温度条件下,N-CNT/PMS体系降解AO7符合一级降解动力学,反应速率常数k随温度升高逐渐变大,表明随温度升高,降解速率加快;并通过 Arrhenius公式计算出反应活化能Ea为69.7kJ/mol.
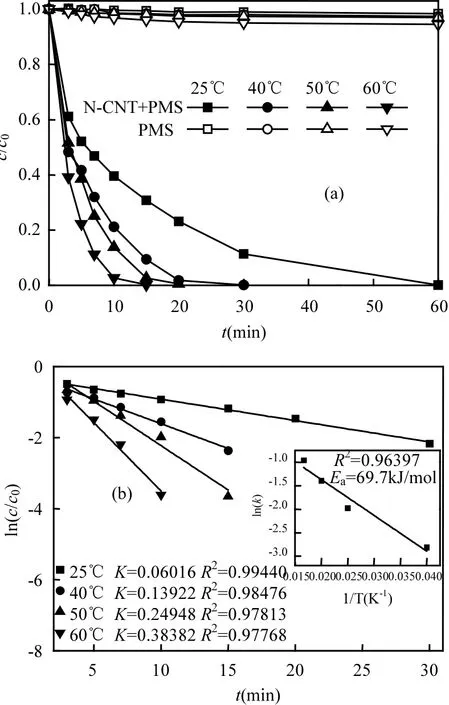
图8 反应温度对AO7降解的影响以及一级降解动力学与Arrhenius拟合Fig.8 Effect of reaction temperature on AO7 degradation and first order kinetics model and Arrhenius plot
2.8 NaCl、Na2SO4和Na2CO3对反应的影响
印染工艺中往往通过投加 NaCl加速染色,导致其产生废水通常含有大量的 NaCl,然而 Cl-对高级氧化过程有较大影响.图9显示了不同浓度NaCl对活化降解AO7的影响.可以看出,加入Cl-会促进 AO7的降解,且随着 Cl-浓度的增加,AO7降解速率增大.当Cl-浓度为10mmol/L时,反应在 30min时降解 99%;当 Cl-浓度达到100mmol/L时,AO7在 10min时已经降解完全.以上实验结果的原因可能是,当NaCl存在时,Cl-与反应生成具有强氧化性的 HClO[见式(5)~(9)].在•和ClO-共同作用下,AO7降解速率明显提高.
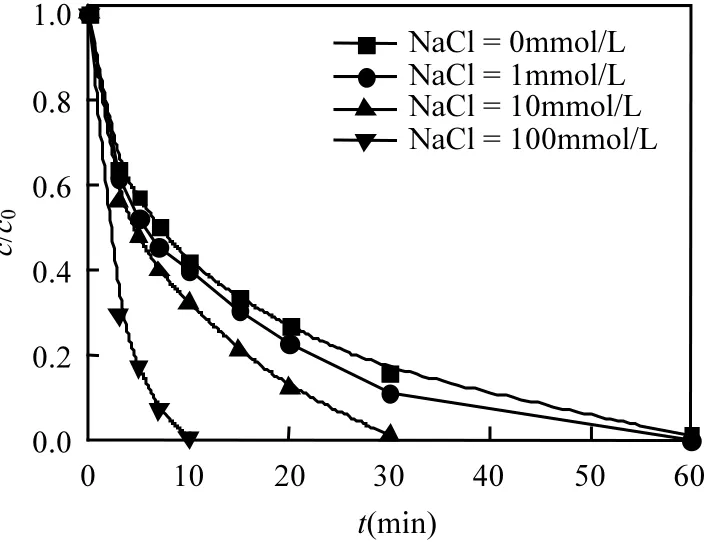
图9 NaCl浓度对AO7降解的影响Fig.9 Effect of NaCl amounts on AO7 removal
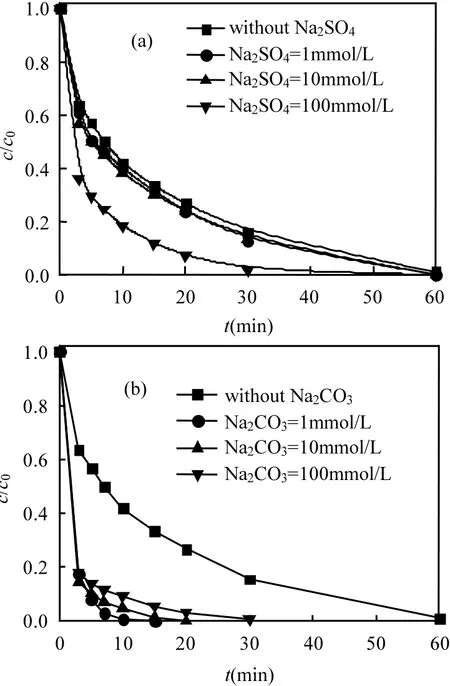
图10 Na2SO4和Na2CO3浓度对AO7降解的影响Fig.10 Effect of Na2SO4and Na2CO3amounts on AO7 removal

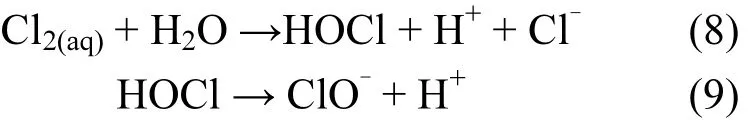
染料废水中除 NaCl浓度较高之外,通常以硫酸钠、碳酸钠等作为直接染料而导致染料废水中大量的存在.从图10可以看出随着浓度的升高,反应体系中AO7降解速率增大.这可能是因为高浓度的和可以增强离子强度,从而导致染料分子之间相互聚合,染料分子团聚后,更容易吸附于 NCNT表面,从而有利于染料和表面活性自由基的反应,促进AO7氧化脱色.
2.9 降解分析
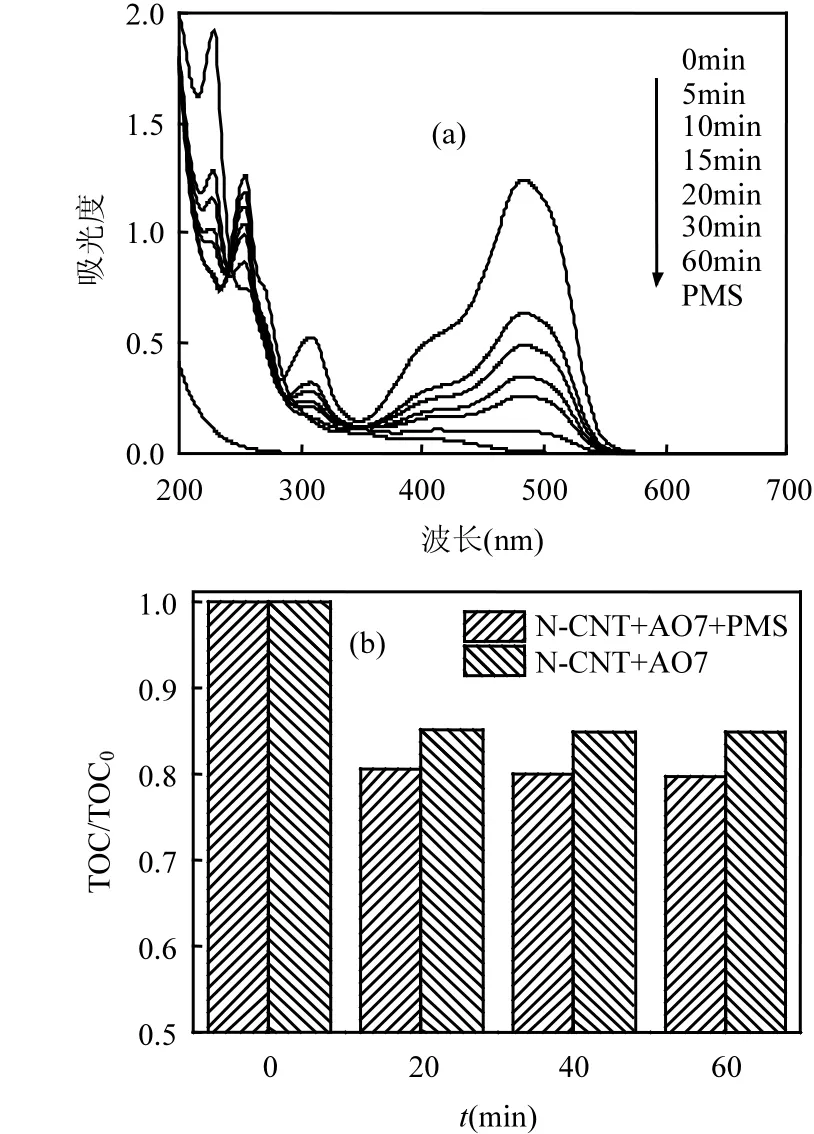
图11 AO7降解紫外可见光谱及TOC去除率Fig.11 UV-Vis spectra for degradation of AO7 (a) and TOC removal in N-CNT/PMS systems (b)
图11(a)所示为N-CNT/PMS体系降解AO7过程中紫外可见光谱.可以看出,AO7主要有484nm和310nm处的特征吸收峰,分别代表AO7的发色基团偶氮键和萘环结构.随活化反应的进行,位于484nm和310nm处的AO7特征峰强度不断下降,表明AO7的偶氮键和萘环结构不断被•氧化;60min后,偶氮键和萘环的特征峰接近消失.
为了进一步研究各 N-CNT/PMS体系降解AO7的TOC变化情况,本次研究还对反应过程中的TOC进行了测试,如图11(b)所示,对N-CNT体系,在0、20、40、60min分别取样,它们对AO7吸附效果的 TOC去除率分别为 0%、14.8%、15.1%和15.3%;而对于N-CNT/PMS体系中,在0、20、40、60min分别取样,它们对AO7的TOC去除率分别为 0%、19.6%、20%和 20.4%.结果表明N-CNT/PMS体系对AO7不仅有良好的降解效果,而且具有一定的矿化能力.
3 结论
3.1 N-CNT活化PMS降解AO7效果良好,可以证实CNT活化PMS产生的自由基主要是SO4-•, PMS被活化的场所在N-CNT的表面.
3.2 AO7降解效果随N-CNT投加量、PMS浓度、温度、Cl-等离子浓度的增大而得到提高.初始 pH值对降解有较大的影响,偏酸性条件下更有利于反应进行.
3.3 N-CNT/PMS体系对AO7的脱色效果良好,且N-CNT/PMS体系能使AO7分子得到一定程度的矿化.
[1] Ji P, Zhang J, Chen F, et al. Study of adsorption and degradation of acid orange 7 on the surface of CeO2under visible light irradiation [J]. Applied Catalysis B: Environmental, 2009, 85(3/4):148-154.
[2] Xu X, Li X. Degradation of azo dye Orange G in aqueous solutions by persulfate with ferrous ion [J]. Separation and Purification Technology, 2010,72(1):105-111.
[3] Gupta V K, Gupta B, Rastogi A, et al. A comparative investigation on adsorption performances of mesoporous activated carbon prepared from waste rubber tire and activated carbon for a hazardous azo dye—Acid Blue 113 [J]. Journal of Hazardous Materials, 2011,186(1):891-901.
[4] Anipsitakis G P, Dionysiou D D. Degradation of Organic Contaminants in Water with Sulfate Radicals Generated by theConjunction of Peroxymonosulfate with Cobalt [J]. Environmental Science & Technology, 2003,37(20):4790-4797.
[5] Saleh T A, Gupta V K. Photo-catalyzed degradation of hazardous dye methyl orange by use of a composite catalyst consisting of multi-walled carbon nanotubes and titanium dioxide [J]. Journal of Colloid and Interface Science, 2012,371(1):101-106.
[6] Khataee A R, Pons M N, Zahraa O. Photocatalytic degradation of three azo dyes using immobilized TiO2nanoparticles on glass plates activated by UV light irradiation: Influence of dye molecular structure [J]. Journal of Hazardous Materials, 2009, 168(1):451-457.
[7] Cuiping B, Xianfeng X, Wenqi G, et al. Removal of rhodamine B by ozone-based advanced oxidation process [J]. Desalination, 2011,278(1-3):84-90.
[8] Faria P C C, órfão J J M, Pereira M F R. Activated carbon and ceria catalysts applied to the catalytic ozonation of dyes and textile effluents [J]. Applied Catalysis B: Environmental, 2009, 88(3/4):341-350.
[9] 陈家斌,魏成耀,房 聪,等.碳纳米管活化过二硫酸盐降解偶氮染料酸性橙7 [J]. 中国环境科学, 2016,36(12):3618-3624.
[10] 张黎明,陈家斌,房 聪,等.Cl-对碳纳米管/过一硫酸盐体系降解金橙G的影响 [J]. 中国环境科学, 2016,36(12):3591-3600.
[11] Yang S, Yang X, Shao X, et al. Activated carbon catalyzed persulfate oxidation of Azo dye acid orange 7 at ambient temperature [J]. Journal of Hazardous Materials, 2011,186(1): 659-666.
[12] Waldemer R H, Tratnyek P G, Johnson R L, et al. Oxidation of Chlorinated Ethenes by Heat-Activated Persulfate: Kinetics and Products [J]. Environmental Science & Technology, 2007,41(3): 1010-1015.
[13] Liang C, Bruell C J. Thermally Activated Persulfate Oxidation of Trichloroethylene: Experimental Investigation of Reaction Orders [J]. Industrial & Engineering Chemistry Research, 2008,47(9): 2912-2918.
[14] Ghauch A, Tuqan A M, Kibbi N, et al. Methylene blue discoloration by heated persulfate in aqueous solution [J]. Chemical Engineering Journal, 2012,213:259-271.
[15] Gao Y, Gao N, Deng Y, et al. Ultraviolet (UV) light-activated persulfate oxidation of sulfamethazine in water [J]. Chemical Engineering Journal, 2012,195-196:248-253.
[16] He X, de la Cruz A A, Dionysiou D D. Destruction of cyanobacterial toxin cylindrospermopsin by hydroxyl radicals and sulfate radicals using UV-254nm activation of hydrogen peroxide, persulfate and peroxymonosulfate [J]. Journal of Photochemistry and Photobiology A: Chemistry, 2013,251:160-166.
[17] Kusic H, Peternel I, Ukic S, et al. Modeling of iron activated persulfate oxidation treating reactive azo dye in water matrix [J]. Chemical Engineering Journal, 2011,172(1):109-121.
[18] Rodriguez S, Vasquez L, Costa D, et al. Oxidation of Orange G by persulfate activated by Fe(II), Fe(III) and zero valent iron (ZVI) [J]. Chemosphere, 2014,101:86-92.
[19] Yang S, Xiao T, Zhang J, et al. Activated carbon fiber as heterogeneous catalyst of peroxymonosulfate activation for efficient degradation of Acid Orange 7in aqueous solution [J]. Separation and Purification Technology, 2015,143:19-26.
[20] Oh W, Lua S, Dong Z, et al. Performance of magnetic activated carbon composite as peroxymonosulfate activator and regenerable adsorbent via sulfate radical-mediated oxidation processes [J]. Journal of Hazardous Materials, 2015,284:1-9.
[21] Lee Y, Lo S, Kuo J, et al. Promoted degradation of perfluorooctanic acid by persulfate when adding activated carbon [J]. Journal of Hazardous Materials, 2013,261:463-469.
[22] O'Reilly J M, Mosher R A. Functional groups in carbon black by FTIR spectroscopy [J]. Carbon, 1983,1(21):47-51.
[23] Sun X, Li Y. Colloidal Carbon Spheres and Their Core/Shell Structures with Noble-Metal Nanoparticles [J]. Angewandte Chemie International Edition, 2004,43(5):597-601.
[24] Fierro V, Torné-Fernández V, Celzard A, et al. Influence of the demineralisation on the chemical activation of Kraft lignin with orthophosphoric acid [J]. Journal of Hazardous Materials, 2007, 149(1):126-133.
[25] 李莉香,刘永长,耿 新,等.氮掺杂碳纳米管的制备及其电化学性能 [J]. 物理化学学报, 2011,27(2):443-448.
[26] Zhang J, Shao X, Shi C, et al. Decolorization of Acid Orange 7with peroxymonosulfate oxidation catalyzed by granular activated carbon [J]. Chemical Engineering Journal, 2013,232: 259-265.
致谢:本实验的表征测量等工作由江苏省环境科学与工程重点实验室协助完成,在此表示感谢.
Activation of peroxymonosulfate by nitrogen-doped carbon nanotubes to decolorize acid orange 7.
WANG Ying, WEI Cheng-yao, HUANG Tian-yin, WU Wei, CHEN Jia-bin*(School of Environmental Science and Engineering, Suzhou University of Science and Technology, Suzhou 215009, China). China Environmental Science, 2017,37(7):2583~2590
Nitrogen-doped carbon nanotube (N-CNT) was used as an activator to activate peroxymonosulfate (PMS) to degrade azo dye, Acid orange 7 (AO7) in aqueous solution. The results indicated that N-CNT exhibited a much better performance on activating PMS to decolorize AO7 than activated carbon (GAC), the removal of AO7 could reach 99% after 60min with 400mg/L of N-CNT dosage, 40/1of PMS/AO7 molar ratio. The degradation mechanism of AO7 in N-CNT activated PMS system was explored,and SO-4• was found to be dominantly responsible for AO7 degradation, which mainly took place on the surface of N-CNT. The The initial pH had a significant effect on the AO7 degradation, and pH 3.0 was most favorable for its degradation. In addition, the degradation of AO7 was accelerated after addition of Cl-、SO2-4and CO2-3; From the analysis of UV-vis spectra and TOC analysis indicated that the azo band and naphthaline ring of AO7 that were destructed and then mineralized into CO2and H2O.
nitrogen-doped carbon nanotubes;peroxymonosulfate;acid orange 7
X703,X131.2
A
1000-6923(2017)07-2583-08
王 莹(1993-),女,黑龙江七台河人,硕士研究生,主要从事污水处理研究.
2016-12-19
国家自然科学基金资助项目(51478283);苏州科技大学大学生创新训练计划项目(201613985007Y)
* 责任作者, 讲师, chenjiabincn@163.com

