金匮肾气丸调控FNDC5、BMP2对BMSCs成骨分化的作用
张玉卓 任辉 余翔 许银坤 许献光 丁富平 黄进 张进*
1.广州中医药大学, 广东 广州 510405 2.广州中医药大学第一附属医院, 广东 广州 510405
随着年龄的增长,骨髓内微环境的改变,骨髓间充质干细胞(Bone marrow mesenchymalstem cells,BMSCs)分化成骨细胞数量的减少和成骨能力的减弱[1,2],造成骨质疏松症(osteoporosis,OP)。临床发现,OP表现在骨量丢失、骨微结构破坏与骨质量降低的同时,骨髓脂肪组织显著增多[3,4]。调节骨髓基质微环境,促进BMSCs成骨分化[5],对于防治OP具有重要意义。中医学认为肾主骨生髓,因此,探讨补肾方药促进BMSCs成骨分化有一定的临床意义。但其作用机制的相关研究仍然较少,近年来报道FNDC5、BMP2基因在成骨分化过程中起重要调控作用[6,7]。本研究拟采用全骨髓贴壁法培养BMSCs,分别用高、低剂量金匮肾气丸血清和空白血清、和干预BMSCs成骨分化过程,通过CCK8检测、AKP活性检测、ALP染色、RT-q PCR和Western-blotting等方法对金匮肾气丸促BMSCs的成骨分化能力及其作用机制进行了初步探讨。
1 实验材料
1.1 药物
金匮肾气丸:制附子(先煎)6 g、桂枝 6 g、生地黄30 g、山药15 g、山茱萸15 g、泽泻12 g、茯苓12 g、牡丹皮12 g (北京同仁堂股份有限公司提供)。以上药物加水漫过药面2 cm,浸泡30 min后, 先煎附子30 min,再纳入其他药物,大火煮沸后再煎30 min,第2煎加水量为第1煎的1/2,共煎2次,每次煎得药150 mL, 合并煎液,过滤,浓缩至120 mL,高温、高压灭菌,5 ℃冷藏备用。
1.2 动物
SD大鼠24只,雄性,SPF级,3月龄,体质量150~180 g,由广州中医药大学实验动物中心提供,动物合格证号:SYXK(粤)2013-0092。
1.3 分组、动物含药血清制备及给药
将24只大鼠随机分成3组(每组8只),分别为:金匮肾气丸低剂量组(SD组)、金匮肾气丸高剂量组(SG组)和空白对照组(CON组)。药剂量按照人与大鼠体表面积折算,SD组给药剂量为13 mg/kg/d,SG组给药剂量为26 mg/kg·d,CON组给予和SD组相同体积的生理盐水。各组每天灌胃两次,上下午各一次,连续1周,最后一次给药2小时后10%水合氯醛麻醉后,无菌条件下腹主动脉取血,4 ℃凝固,离心3 000 rpm,15 min,获取血清:正常血清,低剂量含药血清、高剂量含药血清。
1.4 试剂
CCK8试剂盒(上海贝博公司);AKP活性检测试剂盒(南京建成公司);ALP染色试剂盒、蛋白裂解液(碧云天公司);10%水合氯醛、胰蛋白酶PBS缓冲液(广州化学试剂厂);RNA提取盒、RNA逆转录盒及qPCR扩增盒(TAKARA公司);一抗:abcam。蛋白提取试剂主要包括:Tris-HCl、Triton X-100、BSA、cocktail蛋白酶抑制剂、蛋白定量试剂盒(Thermo公司);RNA提取试剂主要包括:DEPC水、氯仿、异丙醇、75%乙醇、溴化乙锭、琼脂糖(广州化学试剂厂),Trizol提取试剂盒(TAKARA公司)。qPCR试剂包括:PrimeScript TM RT Master Mix逆转录盒(TAKARA公司)。
1.5 仪器
超微量分光光度计(NanoDrop Technologies),分析天平(德国赛多利斯集团公司),高速冷冻离心机(Sigma公司),CO2培养箱(Thermo公司),倒置显微镜(NIKON 公司),超净工作台(ESCO公司)。T100梯度PCR仪、CFX96实时荧光定量PCR仪(Bio-Rad 公司,美国),全波长酶标仪(Thermo公司,美国)。
2 方法
2.1 BMSCs分离、培养、传代
选取4~6周龄大鼠,用10%水合氯醛麻醉,75%酒精消毒下半身,无菌条件下取出双下肢股骨和胫骨,暴露髓腔,用预先配好的含10%FBS的DMEM培养基冲洗髓腔,收集骨髓冲洗液,离心后,吸取下层含BMSCs,接种于培养瓶中,置入37 ℃、5%的CO2培养箱中培养。每3天换一次液。细胞长满后(细胞融合约80%),吸走培养基,PBS缓冲液清洗细胞后,加入2.5 g/L的胰蛋白酶消化45秒左右,加入少量10%FBS的DMEM培养基终止消化,轻轻吹打培养瓶底,将消化混合液离心,吸取下层BMSCs细胞层,按1∶2比例传代。
2.2 含药血清分组干预BMSCs
应用金匮肾气丸高、低剂量含药血清和空白血清分别干预BMSCs,分组为SG组、SD组和CON组。各组干预1、3、5、7、10天后CCK8检测BMSCs增殖、毒性作用;分别在干预第3天和7天时检测AKP活性、ALP染色评估BMSCs成骨分化活性及能力,PCR及Western-blotting检测FNDC5、BMP2的mRNA及蛋白表达。
2.3 CCK8检测
BMSCs以2000细胞/孔种植到96孔板,用于CCK8检测。10% FBS基培养一天,确认BMSCs贴壁后,应用含药血清和空白血清分组干预,每组细胞在干预培养的第 1、3、5、7、10 天进行CCK8检测,每孔加入 CCK8 工作液10 μL,孵育1 h,使用酶标仪测定各组细胞450 nm 处的吸光度(OD 值)。每个时间点设 6个复孔,重复该实验3次,最后汇总每次测得的OD值,取平均值进行统计分析。
2.4 AKP活性检测
BMSCs以2×104细胞/孔种植到6孔板,应用含药血清分组干预,分别在第3、7天,取细胞上清液进行AKP活性检测。具体步骤如下:(1)按表1配置反应液。(2)上述加样完毕后,充分混匀,37 ℃水浴15 min反应。(3)每孔加入50 mL显色剂。(4)轻轻振摇孔板混匀,用酶标仪在波长520 nm下,测定各孔吸光度值。(5)AKP活性计算:AKP活性=(测量空-空白孔)/(标准孔-空白孔)×0.1 mg/mL×100 mL。

表1 加样体系Table 1 Sample adding System
注:“-”表示该孔不用添加该项目。
Note: “-”No sample needs to be added to that cell.
2.5 ALP染色
BMSCs以2×104细胞/孔种植到6孔板,应用含药血清分组干预,在第7天时进行ALP染色。ALP染色具体步骤:(1)固定细胞:吸走培养基,PBS缓冲液洗涤3~5次,4%多聚甲醛适当固定,并适当洗涤3~5次,每次3~5分钟,末次洗涤结束后,吸走洗涤液;(2)按试剂盒说明配置BCIP/NBT染色工作反应液;(3)加入1 mL BCIP/NBT染色工作液(确保能充分覆盖细胞);(4)室温避光孵育30分钟(可适当增加时间,最长可达24小时),直至显色至预期深浅;(5)去除BCP/NBT染色工作液,纯水(蒸馏水)洗涤1~2次即可终止显色反应。
2.6 荧光定量(RT-qPCR)检测
BMSCs以2×104细胞/孔种植到6孔板,应用含药血清分组干预,在第3、7天时每组各取3个培养孔细胞进行RT-qPCR检测。应用TAKARA MiniBEST Universal提取试剂盒提取各组BMSCs总RNA,Thermo全波长酶标仪分析RNA浓度和纯度,PrimeScriptTM RT Master Mix逆转录盒进行cDNA合成反应,根据SYBR Premix Ex TaqTMⅡ操作步骤,使用Bio-Rad CFX96实时荧光定量PCR 仪进行两步法荧光定量分析,反应条件设置为95 ℃ 30 s,95 ℃ 5s,60 ℃ 1min延伸,40个循环,每个样本设置3个技术重复孔, 扩增用引物序列见表2。

表2 引物设计Table 2 The primer sequences
2.7 Western-blotting(WB)检测
BMSCs以2×104细胞/孔种植到6孔板,应用含药血清分组干预,在第3、7天时每组各取3个培养孔细胞进行WB检测。应用RIPA液裂解细胞提取各组细胞蛋白,离心获取上清蛋白后,应用BCA 法进行蛋白定量。以RIPA调整蛋白浓度,样品终浓度为4.0 μg/μL,加入 5×蛋白样品缓冲液,95 ℃ 5分钟。根据目的蛋白的分子量制胶,常规上样、电泳、转膜。 转膜后将膜完全浸没于5%BSA-TBST中水平摇床室温孵育6小时进行封闭。用 5%BSA-TBST 稀释一抗(FNDC5稀释为1∶1000,BMP2稀释为1∶1000,β-actin 1∶10000),4 ℃水平摇床孵育过夜。次日,TBST洗膜3次后相应二抗室温孵育 40分钟(1∶10000)。TBST洗膜3次后ECL显影,胶片曝光。

图3 7天时各组AKP染色情况Fig.3 AKP staining results in each group at the 7th day
3 统计学处理

4 结果
4.1 金匮肾气丸对BMSCs增殖、毒性的作用
CCK8法测定各组细胞各时间点的吸光度值可发现:随着时间的增加,从第1天到第7天,BMSCs增殖呈上升趋势,虽然第3~5天时略有下降,但下降值无统计学差异。且各组间增加程度无统计学差异。第7~10天,BMSCs增殖呈现下降趋势。详见图1。

图1 三组细胞生长增殖曲线Fig.1 Cell growth value curve groups of three groups
4.2 金匮肾气丸对BMSCs成骨活性的影响
如图2所示,AKP活性检测结果显示,培养3天时,SG组AKP活性高于CON组,差异有统计学意义(P<0.01),SD组AKP活性虽然与CON组比较无统计学差异,但SD组AKP活性高于CON组。7天时,SG、SD组AKP活性均高于CON组,差异有统计学意义(P<0.05)。

图2 三组AKP活性注:与CON组比较,*P<0.05;SG组与SG、CON组相比,**P<0.05Fig.2 AKP activity of the three groupsNote: *P<0.05,vs. CON group;SG Group vs.SD and CON Group,**P<0.05
4.3 金匮肾气丸对BMSCs成骨分化能力的影响
如图3所示,含药血清干预7天时,ALP染色结果显示,SG组和SD组ALP染色阳性率均高比CON组,说明金匮肾气丸含药血清干预两组成骨分化能力较CON组更强。而SG组ALP染色率高于SD组,说明SG组成骨分化能力强于SD组。
4.4 金匮肾气丸对BMSCs中 FNDC5、BMP2 mRNA表达的影响

图4 各组 FNDC5 mRNA和BMP2 mRNA表达注:与CON组比较,*P<0.05; 与CON组比较,**P<0.01;SD组与SG组相比,#P<0.05Fig.4 The expression results of FNDC5 mRNA and BMP2 mRNA of BMSCs in different groupsNote:*P<0.05, vs.CON group;**P<0.01, vs.CON group; SG Group vs.SD Group, #P<0.05
如图4所示,3天时,SD组FNDC5 mRNA表达显著高于CON组和SG组(P<0.01),SG组和CON组虽无统计学差异,但SG组有高于CON组趋势;SG组和SD组BMP2 mRNA表达显著高于CON组,差异有统计学意义(P<0.01)。7天时,SG组FNDC5 mRNA表达均高于CON组,差异有统计学意义(P<0.05),SD组FNDC5 mRNA表达高于SG组,差异有统计学意义(P<0.05);SG组和SD组BMP2 mRNA表达均显著高于CON组(P<0.01),但SG组和SD组BMP2 mRNA表达无明显差异。
4.5 金匮肾气丸对BMSCs FNDC5、BMP2蛋白水平的影响
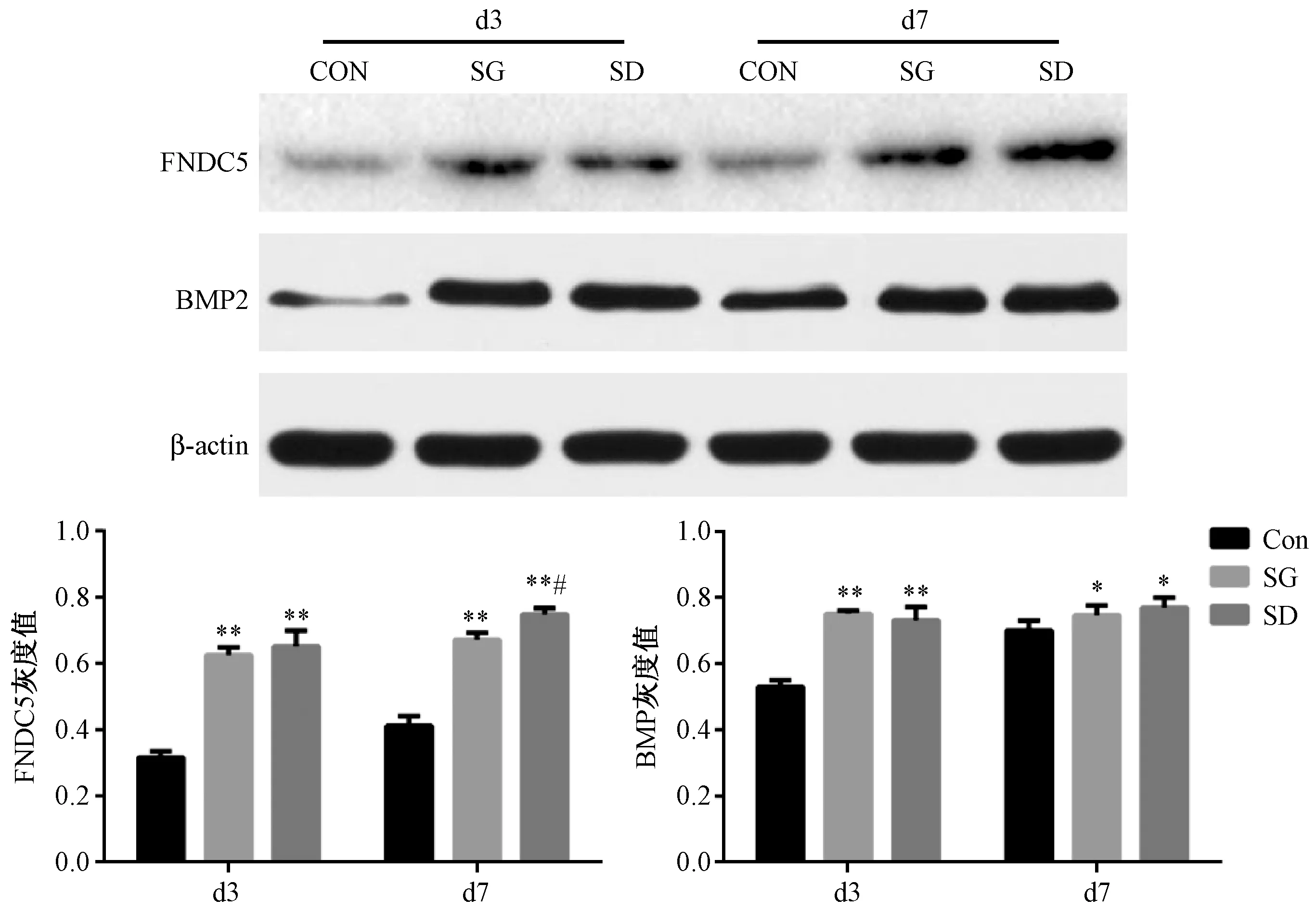
图5 各组第3、7天FNDC5、BMP2蛋白水平情况注:与CON组比较,*P<0.05; 与CON组比较,**P<0.01;SD组与SG组相比,#P<0.05Fig.5 The levels of FNDC5 and BMP2 protein at the 3th and 7th day in each groupNote:*P<0.05, vs.CON group;**P<0.01, vs.CON group; SG Group vs.SD Group, #P<0.05
如图5所示,3天时, SG组、SD组FNDC5、BMP2蛋白水平显著高于CON组,差异有统计学意义(P<0.01)。SG、SD两组无统计学差异。7天时,SG组、SD组FNDC5蛋白水平显著高于CON组,差异有统计学意义(P<0.01);且SD组FNDC5水平高于SG组,差异有统计学意义(P<0.05);SG组、SD组BMP2蛋白水平均亦高于CON组,差异有统计学意义(P<0.05),SG、SD两组之间的BMP2蛋白水平无统计学差异。
5 讨论
中医认为,肾藏精,主骨生髓。骨髓藏于髓腔内,滋养骨骼,骨的生长发育依赖肾气的滋养与推动。骨髓中的成体干细胞的分化能力与分化方向代表骨髓的功能,由“肾”主导,当前研究认为调节“肾”的阴阳可以调控BMSCs的分化功能。BMSCs成骨分化受多种转录因子调控,其中FNDC5和BMP2是特异性成骨细胞转录因子和关键调节因子[6-8]。补肾中药对BMSCs成骨分化作用的研究是目前探索中医药防治OP作用机制的热点之一。本研究通过对金匮肾气丸调控FNDC5、BMP2对BMSCs成骨分化的作用的研究,丰富补肾中药治疗OP起效的作用机制内涵。金匮肾气丸方中附子、肉桂、熟地、山药、山萸肉合用,有温阳暖肾,补肾填精,化肾气、行水之功效。泽泻、丹皮、茯苓以泻 助补。全方温而不燥,滋而不腻,阴中求阳,是补肾阳的经方,用于治疗肾阳不足证,也可用于骨质疏松的治疗[9,10]。
CCK8检测是检测细胞增殖和毒性的重要指标之一[11]。本研究中CCK8检测发现:随着时间的增加,从金匮肾气丸含药血清干预第1天到第7天,各组BMSCs增殖整体呈上升趋势,虽然第3~5天时略有下降,但下降值无统计学差异;各组增加程度无统计学差异。提示金匮肾气丸具有较强的促BMSCs增殖作用,起作用与空白组含药血清相当,且无明显毒性作用,说明金匮肾气丸是一种有潜力的促成骨分化药物。
碱性磷酸酶(alkaline phosphatase, ALP/AKP)是成骨细胞早期分化的标志[12]。AKP由成骨细胞分泌,其活性可反映成骨细胞功能的强弱。骨组织中含有丰富的AKP,集中于成骨细胞表面或周围,当成骨细胞增殖、分化时会出现血清AKP活性上升,因此,进行AKP活性检测和ALP染色能够敏感的评估骨髓间充质干细胞的成骨分化能力。本研究发现各组含药血清干预BMSCs第3、7天时,SG和 SD组AKP活性均高于CON组。ALP染色与CON组相比,可见SG和SD组均具有更高的染色阳性率,虽然干预第3天时SD与CON组AKP活性差异无统计学意义,但SD组显示出高于CON组的趋势,以上结果提示金匮肾气丸能够促进BMSCs成骨分化。
FNDC5即III型纤维连接蛋白域蛋白5(Human Fibronectin type III domain-containing protein 5,FNDC5),2002年首次提出frcp2 (即为FNDC5)主要为FNIII 家族中的一员,主要在骨骼肌、脑和肝脏中表达[13]。FNDC5是由骨骼肌分泌的一种薄膜蛋白[6,13],在能量代谢方面有一定的改善作用。研究发现,FNDC5含量与骨骼肌含量呈正相关[14]。此外,FNDC5在皮下脂肪和内脏脂肪中也表达这种蛋白[15]。FNDC5 被认为是用于治疗代谢性疾病的潜在靶点[6,13]。本研究中,含药血清干预3天时,SD组FNDC5 mRNA呈上调趋势,其表达高于CON、SG组,但SG、CON组无统计学差异;WB结果也提示SG、SD组FNDC5、BMP2蛋白水平均显著高于CON组(P<0.01)。含药血清干预7天时,SG、SD组FNDC5 mRNA表达较CON组上调(P<0.05)。同时期的WB结果也提示SG组、SD组FNDC5蛋白水平显著高于CON组(P<0.01)。FNDC5基因表达上调与金匮肾气丸促进BMSCs提示可能与FNDCs上调相关。
骨形态发生蛋白(Bone Morphogenetic Proteins, BMPs)是影响新骨形成的常见因子,对骨原细胞的分化起决定性作用,是促进成骨的主要因子[12]。BMPs家族有40多种成员,其中BMP2是转化生长因子fi (TGF-13)超家族中的多功能细胞因子,可促进细胞增殖,提高其AKP活性[12]。BMP2信号通路是与骨形成密切相关的通路,BMP2基因是公认的与成骨密切相关的基因[6-8],能促进成骨分化,有研究证明,BMP2对 BMSCs的成骨分化具有促进作用[16]。本研究中,各组干预BMSCs 3天时, SG、SD组BMP2 mRNA表达较CON组上调(P<0.05),且同时期SG、SD组BMP2蛋白水平显著高于CON组(P<0.01)。7天时,SG、SD组BMP2 mRNA表达均高于CON组。且同时期SG、SD组BMP2蛋白水平均高于CON组(P<0.05),SG、SD两组之间的BMP2蛋白水平无统计学差异。因此,BMP2基因和蛋白表达上调提示金匮肾气丸具有促进成骨分化的作用。FNDC5和BMP2在mRNA表达及蛋白水平上呈现上调趋势,均高于CON组,二者共同上调,提示二者可能通过协同作用促进成骨分化。
综上,本研究结果结果初步证明金匮肾气丸能促进BMSCs增殖,增加BMSCs成骨分化活性和分化能力。这有可能是通过上调FNDC5、BMP2基因的表达来实现的。FNDC5和BMP2二者共同上调,提示金匮肾气丸可通过上调FNDC5和BMP2促进BMSCs成骨分化。这一初步的结论尚需要进一步验证,并探讨其详细的调控作用与机制。FNDC5和BMP2的进一步研究在OP 的机制阐明及靶点预测方面具有重要意义。

