TNF-α在构建大鼠骨性关节炎模型中对内质网应激的影响探讨
刘军 甄平 周胜虎 田琦 陈慧 王伟 何晓乐 李旭升*
1.兰州军区总医院全军骨科中心关节外科, 甘肃 兰州 730050 2.宁夏医科大学,宁夏 银川 750000 3.第四军医大学西京医院老年病科,陕西 西安 710032
骨性关节炎(osteoarthritis, OA)是一种以关节软骨退行性变和关节周围骨质增生为病理性特征的慢性进行性骨关节病,临床表现以关节疼痛、僵硬、肿胀、畸形等功能障碍为主[1],易导致老年人疼痛和伤残,进而严重影响日常工作和生活。持续的软骨细胞凋亡、滑膜炎和骨破坏等致使OA患者病情进行性加重[2],OA发病时血清及关节液的多种炎症介质(白细胞介素、单核细胞趋化蛋白和肿瘤坏死因子等)明显增加,炎性因子的浸润在关节软骨的降解中贯穿始终[3]。基于以上理念,深入探讨OA病理过程中的发病机制对OA中早期的干预尤为重要。本研究通过观察不同剂量肿瘤坏死因子-α(tumor necrosis factor,TNF-α)在构建大鼠OA模型中对内质网应激的影响,初步探讨大鼠骨性关节炎发生过程中内质网应激的作用,以期为早期干预OA提供试验依据。
1 材料与方法
1.1 实验动物、药品和试剂
SPF级SD大鼠(雄性20只,体质量为221.50~252.90 g,平均230.60±12.00 g)由第四军医大学动物实验中心提供;DMEM 低糖培养液、胰蛋白酶购自美国Sigma公司;二甲亚砜(DMSO)和胰蛋白酶购自美国Sigma-Aldrich公司;肿瘤坏死因子-α、蛋白酶抑制剂和β-actin抗体购自美国Santa Cruz公司;HRP羊抗小鼠、羊抗兔和兔抗羊IgG二抗购自北京中杉金桥生物技术有限公司小牛血清购自杭州四季青生物工程材料有限公司;RIPA裂解液和蛋白上样缓冲液购自上海碧云天生物技术有限公司。
1.2 OA模型的制备和实验分组
将将20只SPF级SD大鼠雄性随机分为健康对照组、TNF-α 1ng/mL干预组、TNF-α 5ng/mL干预组和TNF-α 10ng/mL干预组,根据各分组要求,分别于第1天及第7天给予1 ng/mL、5 ng/mL和10 ng/mL浓度的TNF-α注射入大鼠关节腔。4周后用脱颈法处死所有小鼠。
1.3 软骨细胞的提取及培养
将四组分别分离的膝关节软骨组织置于培养瓶中,置于1 mg/mL胶原酶Ⅰ的HEPES液(硫酸镁溶液 0.8 mmol/L、氯化镁溶液 116.0 mmol/L、氯化钾溶液 5.4 mmol/L、磷酸氢钠溶液 10.0 mmol/L、葡萄糖 5.1 mmol/L、HEPES 20.0 mmol/L,酸碱度值7.3)中消化,重复消化三次,每次3~5 min。用含10%血清的DMEM溶液终止消化,置于低速离心机中离心,相对离心力为200×g,5 min。弃去上清液,用含10%血清和0.01 mmol/L的DMEM溶液重悬细胞。用200目的筛网过滤没有贴壁的细胞,去除未消化的组织块。收集过滤的细胞悬液,接种至培养瓶进行原代培养。然后,分别取部分原代培养细胞进行传代处理,收集第2、3、4、5代的细胞,分别以2×103个细胞每孔种于96孔板测生长曲线,根据细胞生长情况最终选取第3代的软骨细胞进行下一步处理。传代细胞使用前进行软骨细胞鉴定,具体操作为将传代细胞消化成细胞悬液,接种于放置有细胞爬片玻片的24孔板中,待细胞爬片48 h后用PBS冲洗并用4%多聚甲醛固定,然后用1%甲苯胺蓝染色30 min,无水乙醇漂洗后室温干燥,取下玻片置于载玻片并封片,在光学显微镜下观察细胞形态,确认其为软骨细胞,计数以确认软骨细胞纯度符合实验要求。
1.4 MTT法检测不同剂量TNF-α处理后软骨细胞活力
将原代软骨细胞按2×103个/mL接种于96孔板中,于37 ℃、5%CO2下培养24 h后吸出孔内培养液,分别加入上述不同浓度的TNF-α,对照组加入等量培养液,每浓度重复8孔。各组细胞孵育8 h后,弃去培养液,加入DMEM培养液(100 μL)和含0.5% MTT的培养液(10 μL),37 ℃、5%C02的培养箱内孵育4 h后,弃培养液,加入100 μL的DMSO原液,振荡10 min,待结晶完全溶解后拍照,酶标仪检测各孔OD值(λ=492 nm),记录结果,实验重复3次。
1.5 ELISA法检测内皮细胞粘附分子-1水平
按照ELISA试剂盒说明书要求测定sICAM-1水平变化。
1.6 TUNEL法凋亡检测软骨细胞凋亡率
取大鼠膝关节股骨外髁靠髁间窝同一部位组织,置于4%多聚甲醛中固定24 h;软骨细胞则直接用4%多聚甲醛中固定30 min后PBS洗3遍,进行打孔;软骨组织常规脱水、包埋、切片、脱蜡。软骨细胞爬片用4%甲醛固定30 min。上述处理后的软骨组织或细胞用PBS振荡洗片,5 min,3次。滴加Triton X-100(0.1%)打孔3 min后PBS振荡洗片,5 min,3次。然后严格按照Roche公司TUNEL检测试剂盒操作,1号和2号液按照1∶9配置,避光37 ℃孵育1 h,PBS振荡洗片,5 min,3次。DAPI染细胞核2 min,PBS振荡洗片,5 min,3次。50%甘油封片,荧光显微镜照相,其中TUNEL染的凋亡细胞核发绿光,DAPI染的所有细胞核发蓝光。以绿色荧光的细胞数与蓝色荧光细胞数的百分比(%)表示凋亡细胞数所占总细胞数的比例。
1.7 蛋白印迹法检测MMP9、ICAM1、IRE1、p-IRE1及GRP78的表达水平
蛋白印迹法测定软骨细胞中MMP9、ICAM1、IRE1、p-IRE1及GRP78的含量,聚丙烯酰胺凝胶电泳(SDS-PAGE)进行电泳分离,半干法将蛋白转移至硝酸纤维素膜,封闭,洗膜,加入1∶600稀释的兔抗大鼠MMP9、ICAM1、IRE1、p-IRE1及GRP78一抗,4 ℃下过夜,用洗膜液漂洗后加入1∶1000稀释的二抗,摇床1 h,TBST冲洗三遍,每次5 min,后用电化学发光(electrochemical luminescence,ECL)液进行曝光显影,Bio-Rad照相系统拍照,上机检测用所带电脑软件进行条带灰度值的分析。
1.8 统计学方法

2 结果
2.1 不同剂量TNF-α 处理对OA软骨细胞活力的影响
与Control组相比,TNF-α 1ng/mL干预组、TNF-α 5ng/mL干预组和TNF-α 10ng/mL干预组对细胞活力无显著影响(P>0.05)。TNF-α 1ng/mL干预组、TNF-α 5ng/mL干预组和TNF-α 10ng/mL干预组之间两两比较,无统计学差异(P>0.05)。如图1。
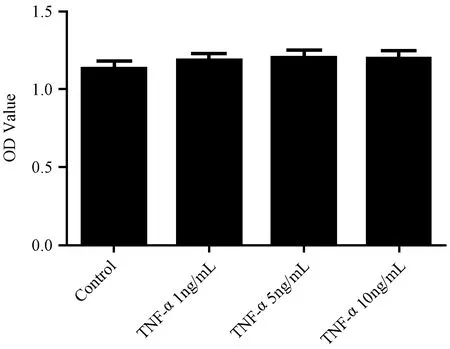
图1 不同剂量TNF-α处理对OA软骨细胞活力的影响。注:结果用mean±SEM,n=8,TNF-α:肿瘤坏死因子-α;OD value:吸光值。Fig.1 The effect of different doses of TNF-α on OA chondrocyte viability.The results are mean±SEM, n=8.TNF-α: tumor necrosis factor-α; OD value: optical density value
2.2 ELISA法检测各组软骨细胞sICAM-1水平变化
与Control组相比,TNF-α 1ng/mL干预组、TNF-α 5ng/mL干预组和TNF-α 10ng/mL干预组sICAM-1含量表达水平均有统计学差异(P<0.01),且呈浓度依赖性升高;TNF-α不同浓度组之间两两比较,差异均有统计学意义(P<0.01)。提示TNF-α干预后可使软骨细胞炎性因子表达水平增高,其中当TNF-α浓度为10ng/mL增高最为明显。如图2。
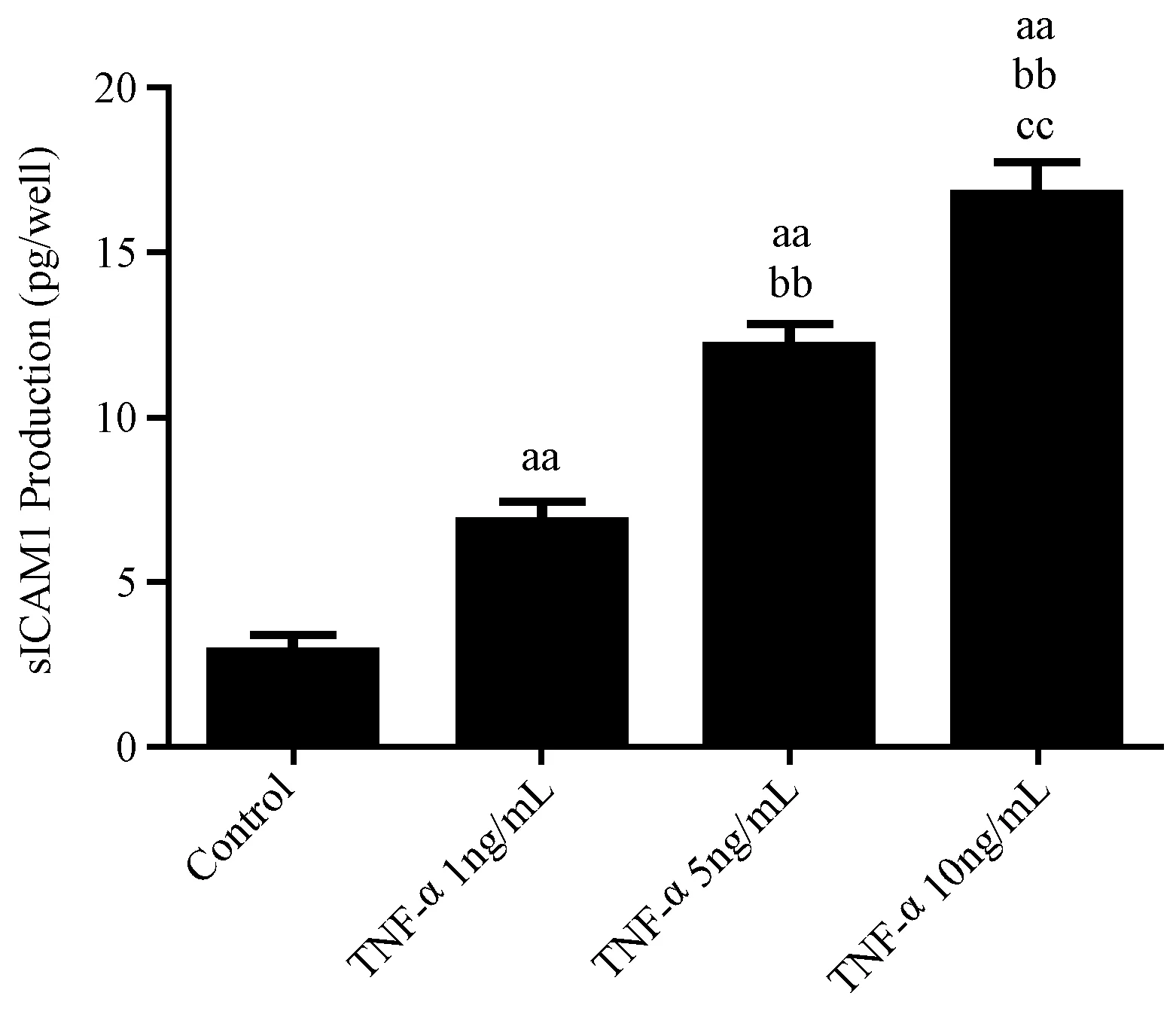
图2 不同剂量TNF-α处理组软骨细胞sICAM-1水平变化aaP<0.01 vs.对照组,bbP<0.01 vs.1ng/mL组,ccP<0.01 vs.5 ng/mL组Fig.2 The effect of different doses of TNF-α on sICAM-1 levels of OA chondrocytes.aaP<0.01 vs.Control group,bbP<0.01 vs.1ng/mL group,ccP<0.01 vs.5 ng/mL group
2.3 不同剂量TNF-α处理对OA软骨细胞凋亡率的影响

图3 不同剂量TNF-α处理对OA软骨细胞凋亡率的影响上图为各组软骨细胞处理后典型TUNEL染色照片,蓝染为细胞核,绿染为凋亡细胞。下图为细胞凋亡率统计分析图。结果用mean±SEM,n=8,aaP<0.01 vs.对照组,bbP<0.01 vs.1ng/mL组,ccP<0.01 vs.5 ng/mL组。TNF-α:肿瘤坏死因子-α;Apoptotic index:凋亡率。Fig.3 The effect of different doses of TNF-α on the apoptosis rate of OA chondrocytesThe figure on top shows the photos of each group of chondrocytes treated with typical TUNEL staining, blue dye for the nucleus, green staining for apoptotic cells.The picture at bottom shows the statistical analysis of apoptosis rate.Values are mean±SEM, n=8, aaP<0.01 vs.control group, bbP<0.01 vs.1 ng/mL group, ccP <0.01 vs.5 ng/mL group.TNF-α: Tumor necrosis factor-α; Apoptotic index: Apoptosis rate.
TUNEL检测各组细胞凋亡率,如图所示,与Control 组(8.05±1.60%)相比,TNF-α 1 ng/mL处理可显著增高软骨细胞凋亡率至25.30±3.10%(P<0.01),TNF-α 5 ng/mL处理显著增高软骨细胞凋亡率至36.05±3.55%(P<0.01),TNF-α 10 ng/mL处理显著增高软骨细胞凋亡率至49.02±5.08%(P<0.01)。TNF-α不同浓度组之间两两比较,差异均有统计学意义(P<0.01)。提示TNF-α干预后可促使软骨细胞凋亡率增高,其中当TNF-α浓度为10ng/mL时促凋亡作用最为明显。如图3。

图4 不同剂量TNF-α处理组MMP9、ICAM1蛋白表达水平变化aaP<0.01 vs.对照组,bbP<0.01 vs.1 ng/mL组,ccP<0.01 vs.5 ng/mL组Fig.4 The effect of different doses of TNF-α on the protein expression levels of MMP9 and ICAM1aaP<0.01 vs.Control group,bbP<0.01 vs.1 ng/mL group,ccP<0.01 vs.5 ng/mL group
2.4 各组软骨细胞MMP9、ICAM1蛋白表达水平变化
与Control组相比,TNF-α 1ng/mL干预组、TNF-α 5ng/mL干预组和TNF-α 10ng/mL干预组中软骨细胞的MMP9、ICAM1蛋白表达水平变化均有显著统计学意义(P<0.01),且呈浓度依赖性升高;TNF-α不同浓度组之间两两比较,差异均有统计学意义(P<0.01)。提示TNF-α干预后可使软骨细胞的MMP9、ICAM1蛋白表达水平增高,其中当TNF-α浓度为10ng/mL增高最为明显。如图4。
2.5 各组软骨细胞内质网应激指标IRE1、p-IRE1及RP78的蛋白表达变化
与Control组相比,TNF-α 1ng/mL干预组、TNF-α 5ng/mL干预组和TNF-α 10ng/mL干预组中软骨细胞的IRE1、p-IRE1及RP78蛋白表达水平变化均有显著统计学意义(P<0.01),且呈浓度依赖性升高;TNF-α不同浓度组之间两两比较,差异均有统计学意义(P<0.01)。提示TNF-α干预后可使软骨细胞的内质网应激指标表达水平增高,其中当TNF-α浓度为10ng/mL增高最为明显。如图5。

图5 不同剂量TNF-α处理组IRE1、p-IRE1及RP78的蛋白表达变化aaP<0.01 vs.对照组,bbP<0.01 vs.1 ng/mL组,ccP<0.01 vs.5 ng/mL组Fig.5 The effect of different doses of TNF-α on the protein expression levels of IRE1, p-IRE and RP78aaP<0.01 vs.Control group,bbP<0.01 vs.1 ng/mL group,ccP<0.01 vs.5 ng/mL group
3 讨论
内质网在细胞生长、存活和功能行使方面起着重要的作用,内外环境中多种刺激因素: 炎症、组织低氧、氧化还原损伤、蛋白质包涵体和病毒性感染等均可引起内质网中未折叠蛋白积聚,破坏细胞内环境稳态,内质网功能发生紊乱,从而导致细胞内的应激反应,这个过程称为内质网应激(endoplasmic reticulum stress,ERS)[4]。ERS是引起细胞凋亡的一条重要通路,在有因素导致内质网应激时,未折叠蛋白反应可以减少未折叠蛋白和错误折叠蛋白在内质网内的聚集,从而减除内质网的压力,当这些变化不能缓解内质网应激的压力时,则会引起细胞凋亡[5]。ERS参与一系列生理和病理过程,包括糖尿病、肿瘤、神经退行性变等,并且和炎症通路也存在着交互调控。以及相应的未折叠蛋白反应(unfolded protein response,UPR) 涉及整个细胞周期,贯穿于机体的一系列生理、病理过程和多种疾病之中[6,7]。有学者通过对传代软骨细胞的低糖性损伤处理发现,与IRE1 相关的p38/MAPK信号通路能增强软骨炎症时的关节破坏[8]。IRE1 是ERS 和UPR的三条通路之一,分子量为100 kDa 的一种跨膜蛋白,具有丝氨酸苏氨酸结构域和核糖核酸内切酶结构域。UPR发生时,IREl 腔内结构域与GRP78 解离,IRE1 寡聚化,引起自身磷酸化从而激活许多与免疫、炎症和调亡相关的蛋白激酶[9]。炎性反应中多种细胞因子可对骨代谢发挥直接或者间接影响[10],如TNF-α可抑制成骨细胞分化,并通过Fas-FasL途径促进成骨细胞凋亡,以及IL-1、IFN-γ抑制成骨细胞的胶原合成[11]。
TNF-α是一种非螺旋、富含β-折叠的蛋白多肽,每个单体由反向平行的β-折叠组成,通常以二聚体、三聚体或五聚体的形式存在于体内,具有生物学活性的TNF-α分子是紧密连接的三聚体[12]。一方面它具有调节机体的免疫功能;另一方面则介导细胞因子分泌、表达黏附分子增殖炎症过程、组织损伤、休克等病理生理反应[13]。人类TNF-α基因大小为2.76 Kb, 由3个内含子和4个外显子组成, 与主要组织相容性复合物(MHC)紧密连锁, 定位于第6对染色体短臂上。鼠TNF-α基因定位于第17对染色体短臂上,大小为2.78Kb, 与人的结构非常相似[14]。
在骨科领域,TNF-α与绝经后骨质疏松(postmenopausal osteoporosis, PMOP)关系密切,TNF可刺激成骨细胞内的碱性磷酸酶活性, 诱导成骨细胞吸收骨质、促进软骨细胞进行软骨更新, 抑制新骨形成[15]。TNF-α基因是类风湿关节炎(rheumatoid arthritis,RA)发病遗传因素的一个重要基因,TNF增强子238 位GG 基因型与RA 进展性关节破坏程度相关且不依赖于DR4的存在。有研究发现,TNF 区域多态性可能与DR 等位基因存在交互作用从而影响疾病易感性[16]。动物关节模型、体外滑膜细胞的培养及RA的临床研究均证实,大量激活的T、B 淋巴细胞,单核巨噬细胞和成纤维样细胞浸润,并分泌大量的细胞因子及趋化因子[17],易导致关节腔内炎症反应及免疫损伤等发生。TNF-α具可刺激滑膜细胞产生前列腺素E2,增加软骨下骨的吸收,引起关节软骨Ⅱ型胶原的破坏。Singh等[18]研究显示2-羟基-苯甲酰胺抑制受肿瘤坏死因子α刺激的软骨细胞产生一氧化氮和诱导型一氧化氮合酶的表达,2-羟基-苯甲酰胺抑制肿瘤坏死因子α诱导的基质金属蛋白酶13的活性及肿瘤坏死因子α调节的Ⅱ型胶原和蛋白多糖的降解。
在骨关节炎(osteoarthritis, OA)中, 约50%患者的滑液中可检测到高水平TNF-α。动物实验表明, OA早期的滑液中即可检测出高水平TNF。体外滑膜细胞及滑液中单核细胞培养研究发现存在可自发分泌高水平TNF的现象, 并因刺激因素的存在而含量增高[19]。TNF-α转基因小鼠可持续表达TNF-α, 发生关节炎性病变, 抗TNF-α抗体能减轻转基因小鼠及胶原诱导模型小鼠的炎症。江锋及麦鸿飞等[20,21]研究小组分别就TNF-α在OA患者血清与关节液中含量加以对比研究发现,TNF-α水平随膝OA严重性指数的增加而升高,含量与关节病变的严重程度呈正相关(r=0.449,P=0.006),且丙二醛和TNF-α水平存在线性相关,相关系数为0.858(P< 0.01)。据于以上研究,目前国内外较为一致的观点为TNF-α是目前RA治疗的主要靶标之一。
本试验中我们通过观察不同剂量TNF-α在构建大鼠骨OA模型中对内质网应激的影响中发现:不同剂量的TNF-α处理对OA软骨细胞活力的影响无显著差异,TNF-α干预后可使软骨细胞sICAM-1表达水平增高,且其增高水平呈TNF-α浓度依赖性变化;在软骨细胞的凋亡检测中发现,随着TNF-α干预浓度的升高,软骨细胞的凋亡率随之增加;蛋白印记法检测结果提示,与对照组相比,软骨细胞的p-IRE1、IRE1、GRP78、MMP9及ICAM1的表达水平呈TNF-α浓度依赖性升高。本研究结果揭示TNF-α在OA病理过程中影响软骨细胞炎性因子、凋亡等方面的变化,其效应可能和作用于内质网应激过程相关,且当TNF-α浓度为10ng/mL时,其作用效果最为显著。析其作用机制可能为:①TNF-α受体(TNFR),尤其是TNFR I(CD120α)导致的促细胞凋亡活性、抗病毒活性、诱导Mn-SOD、ICAM-1 及IL-6等炎症因子的表达、激活NF-κB等多种生物活性物质的信号传递,最终诱导细胞凋亡[22,23];②TNFα可诱导eIF2α磷酸化,上调ATF4mRNA和CHOP蛋白的表达,激活内质网膜上的Ⅰ型跨膜蛋白PERK的激活,诱导UPR中PERK-eIF2α途径的活化[24]。③TNF-α可以上调XBP-1 mRNA及IREl、GRP78蛋白的表达,间接反映了TNFa可以诱导UPR中ATF6途径和IREI-XBP-1 途径的活化[25];④发生内质网应激的软骨细胞对II型胶原、蛋白聚糖和连接蛋白的mRNA表达明显受抑, 并随应激时间的延长进一步下降;最终ERS通过影响软骨细胞的功能和分化,诱导软骨细胞的凋亡, 从而导致各种软骨细胞相关性疾病。
综上,在TNF-α构建大鼠骨性关节炎模型中,炎症因子与内质网应激指标均发生显著改变,内质网应激可能在大鼠骨性关节炎的发生发展过程中发挥重要影响。但其上下游的其他作用分子或信号通路仍未揭晓,有待于我们进一步研究。

