基于JNK信号通路探讨豨莶草对痛风性关节炎影响
徐轶尔 于雪峰 陈水林 韩忠丽 孙贵才*
1.哈药集团药物研究院,黑龙江 哈尔滨 150025 2.南昌大学第四附属医院,江西 南昌 330003 3.哈尔滨医科大学附属第二医院,黑龙江 哈尔滨 150086
痛风性关节炎(gouty arthritis,GA)是由于血液中尿酸增高,尿酸盐结晶析出,沉积在滑膜、软骨、关节囊和骨质等关节组织,引起关节滑膜及周围组织病理性损伤和炎症反应[1]。随着人们饮食结构和生活方式的变化,痛风患者的比例逐年上升,致残率和致畸率较高,给人们的生活和健康带来不便。目前尚无确切的治疗方法根治GA,现在主要的治疗目的就是及时控制急性发作,并减低血液中尿酸,减少尿酸盐沉积,降低关节损伤等,临床上痛风性关节炎急性发作常用秋水仙碱治疗,然而秋水仙碱可导致严重的肝脏、肾脏和骨髓的损伤[2,3]。因此,寻找一种低毒、高效的治疗药物,仍是GA治疗应该急需解决的关键问题。
豨莶草味辛、苦、寒,具有祛风湿、利关节和解毒之功效,主要用于治疗风湿痹症,关节疼痛,筋骨无力,腰膝酸软等[4]。我们前期研究发现以豨莶草为主药的复方豨莶草胶囊能够明显降低痛风性关节炎模型大鼠血清中IL-1β和IL-6水平、明显降低炎性因子的释放,降低NF-κB的转录,明显改善痛风性关节症状[5,6]。以往的研究发现尿酸钠结晶沉积在关节后,能够激活多种信号通路参与GA炎症的发生发展,丝裂原激活的蛋白激酶(mitogen-activated protein kinase,MAPK)细胞信号通路激活白细胞,诱导前炎性细胞因子、生长因子和趋化因子等炎性因子的合成和释放[7]。c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)作为MAPK家族主要成员之一,参与多种生物学反应及疾病的发生发展,因此,本实验以JNK信号通路为基础,探讨痛风性关节炎的发生发展与JNK信号通路之间的关系及中药豨莶草干预机制影响。
1 材料与方法
1.1 实验材料与动物
豨莶草购于哈尔滨市同仁堂大药房;SP600125(JNK抑制剂)和尿酸钠(Uric acid sodium salt,U2875-5G) 购自美国Sigma 公司;大鼠白细胞介素IL-1、白细胞介素IL-8和肿瘤坏死因子TNF-α酶联免疫试剂盒购于美国R&D 公司;JNK和p-JNK购于英国abcam公司;PCR引物由上海生工生物工程有限公司合成;实验动物由黑龙江中医药大学实验动物中心提供。
1.2 豨莶草提取物制备
将豨莶草药材40 ℃烘干,粉碎成干粉,然后加入10倍水于80 ℃提取两次,每次提取30 min。过滤,弃去滤渣,合并滤液,过滤,将溶液浓缩至100 mL,离心2 000 r/min,10 min,取上清液,备用。
1.3 痛风性关节炎模型建立[8,9]及分组
将雄性SD大鼠随机分为正常组、模型组、SP600125组(JNK抑制剂)和豨莶草高(4 g/kg)、中(2 g/kg)、低(1 g/kg)组,各组分别给予生理盐水或药物5天,末次给药1 h后,大鼠膝关节腔注射尿酸钠0.2ml(20 mg/ mL),对照组膝关节腔注射生理盐水0.2 mL,各组大鼠造模后再继续灌胃给药2天[10]。
1.4 滑膜组织形态学检测
取各组大鼠滑膜组织,4 % 多聚甲醛固定, 梯度乙醇脱水, 二甲苯透明, 浸蜡, 石蜡包埋切片, 二甲苯进行脱蜡,梯度浓度的乙醇进行水化,Harris苏木精染色3~5 min,蒸馏水冲洗1 min,75%盐酸乙醇分化数秒钟,蒸馏水冲洗10 min至细胞核呈蓝色,0.5%伊红水溶液1 min,梯度浓度乙醇脱水,二甲苯透明,中性树胶封片,显微镜下观察并拍照。
1.5 痛风性关节炎大鼠血清中TNF-α,IL-1和IL-8含量测定
采集各组大鼠腹主动脉血液,3 500 r/min,离心15 min,收集血清,按照ELISA试剂盒说明书要求测定TNF-α,IL-1和IL-8含量。
1.6 实时定量PCR检测滑膜组织中c-Jun、AP-1和NF-κB mRNA表达
c-Jun、AP-1和NF-κB mRNA引物由上海生工生物工程有限公司合成,引物序列:c-Jun上游5′-TAC GCTGCCCAGTGTCACCT-3′,下游5′-CGT CTGCGGCTCTTCCTTCA-3′,AP-1上游5′-TGGGCACATCACCACTACA C-3′,下游5′-TCTGGCTATGCAGTTCAGCC-3′, NF-κB上游5′-GCTATGTGTGT GAAGGCCCA-3′,下游5′-TGCAAATTTTGACCTGTGGGT-3′。取各组滑膜组织100 mg,按TRIZOL法提取总RNA,并按照逆转录试剂盒说明将提取的总mRNA逆转录成cDNA,并应用cDNA用于实时定量PCR检测。
1.7 滑膜组织中JNK和p-JNK蛋白表达
取各组滑膜组织100 mg,加入组织裂解液提取滑膜组织总蛋白,经SDS-PAGE电泳分离,转移至PVDF膜上, 5%脱脂奶粉室温孵育2 h后,加入一抗工作液,4 ℃过夜, TBS-T缓冲液洗膜5次,10 min/次,加入二抗工作液,室温孵育1 h,TBS-T洗膜5次,10 min/次,采用ECL法显色。凝胶成像系统拍照并分析。
1.8 统计分析
2 结果
2.1 病理形态学观察
如图1所示,在显微镜下观察,对照组滑膜细胞间彼此排列疏松,滑膜细胞之间为胶原性间质,无炎性细胞浸润;模型组炎症明显,炎性细胞浸润,滑膜细胞增生,成纤维细胞及小血管增生, 纤维炎性蛋白渗出物;SP600125组和豨莶草高、中、低组炎性细胞浸润明显减少,滑膜细胞增生和成纤维细胞增生明显减轻,且豨莶草对滑膜组织的炎症影响呈剂量依赖性。
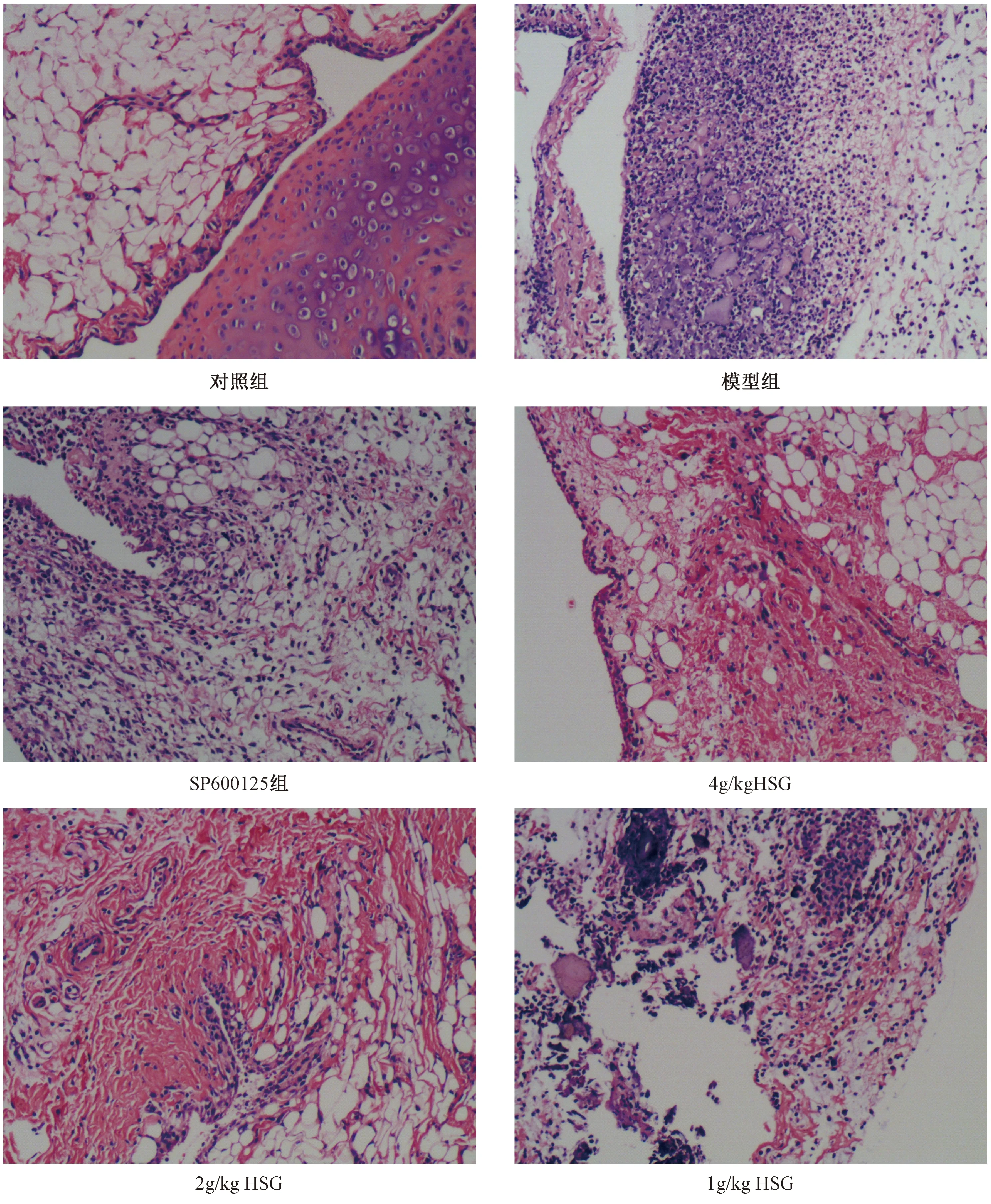
图1 痛风性关节炎大鼠滑膜组织病理变化(HE染色,原始图片放大100倍)Fig.1 Pathological changes of rat synovial tissue with gouty arthritis (stained with hematoxylin and eosin, original magnification×100)
2.2 大鼠血清中TNF-α,IL-1和IL-8含量测定
如表1所示,与对照组比较,模型组痛风性关节炎大鼠血清中炎性因子TNF-α,IL-1和IL-8含量明显增加(P<0.05);与模型组比较,SP600125组和豨莶草高、中、低组痛风性关节炎大鼠血清中炎性因子TNF-α,IL-1和IL-8含量明显降低(P<0.05),且随着豨莶草的剂量增加抑制炎性因子的释放明显。


组别IL-1(pg/mL)IL-8(pg/mL)TNF-α(pg/mL)对照组145.85±9.42394.22±15.4428.64±0.05模型组1563.62±36.84∗589.82±21.37∗85.87±0.16∗SP600125组1249.11±25.31#458.72±19.64#54.41±0.13#4 g/kgHSG406.81±26.16#429.59±18.55#32.87±0.14#2 g/kgHSG982.43±18.45#467.82±23.49#41.93±0.09#1 g/kgHSG1364.65±27.11#504.88±20.44#59.41±0.12#
与对照组比较,*P<0.05;与模型组比较,#P<0.05
Compared with the control group,*P<0.05;compared with the model group,#P<0.05
2.3 滑膜组织中c-Jun、AP-1和 NF-κB mRNA表达
如表2所示,与对照组比较,模型组滑膜组织中c-Jun、AP-1和 NF-κB mRNA表达明显升高(P<0.05);与模型组比较,SP600125组和豨莶草高、中、低组滑膜组织中c-Jun、AP-1和 NF-κB mRNA表达降低(P<0.05),在一定剂量范围内豨莶草对滑膜组织中c-Jun、AP-1和 NF-κB mRNA表达呈正相关。


组别c-jun/GAPDHAP-1/GAPDHNF-ΚB/GAPDH对照组1±0.091±0.081±0.12模型组8.89±0.57∗9.65±0.86∗10.62±0.97∗SP600125组4.38±0.29#4.62±0.53#4.97±0.33#4 g/kgHSG2.57±0.19#3.61±0.25#3.98±0.31#2 g/kgHSG5.68±0.43#6.05±0.56#6.14±0.49#1 g/kgHSG7.08±0.85#7.26±0.43#7.66±0.52#
与对照组比较,*P<0.05;与模型组比较,#P<0.05。
Compared with the control group,*P<0.05; compared with the model group,#P<0.05.
2.4 滑膜组织中JNK和p-JNK蛋白表达
如图2所示,与对照组比较,模型组滑膜组织中JNK和p-JNK蛋白的明显增加(P<0.05);SP600125组处理后痛风性关节炎大鼠滑膜组织中JNK和p-JNK蛋白显著降低(P<0.05);给予豨莶草高、中、低剂量后痛风性关节炎大鼠滑膜组织中JNK和p-JNK蛋白明显降低(P<0.05),随着剂量的增加对JNK和p-JNK的影响逐渐增大。
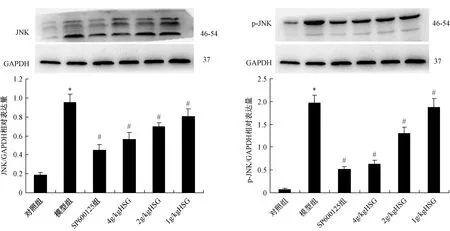
图2 不同浓度豨莶草对滑膜组织中JNK和p-JNK蛋白表达影响Fig.2 Effect of different concentrations of Herba Siegesbeckiae on JNK and p-JNK protein expression in synovial tissue
3 讨论
c-Jun氨基末端激酶(c-JunN-terminalkinase, JNK)是促分裂原活化蛋白激酶(MAPK)家族主要成员之一。JNK信号通路参与细胞增殖、分化、凋亡和恶变以及维持细胞形态和细胞骨架构建等多种生物学反应[11]。JNK信号通路可以被热休克、氧化损伤、细胞因子、表皮生长因子等多种因素激活,JNK信号通路功能异常可造成缺血再灌注损伤、慢性炎症和神经退行性病变等多种疾病。研究早期发现JNK被认为是一种特异性激活核内转录因子c-jun的活性,提高活化蛋白1(AP-1)的转录[12];最近研究发现核内转录因子ELK-1、P53和c-Myc及Bcl2家族(Bcl2、BAD)也是JNK的底物,表明JNK可以直接快速的发挥生物学效应[13-16]。因此,JNK有望成为临床上的一个潜在的治疗靶点,调节相关疾病的发生发展。
痛风性关节炎的发病机制复杂,研究证实痛风性关节炎的发生发展与炎性因子IL-1、IL-8和TNF-α释放及其相关信号通路激活,抗原呈递细胞活化,中性粒细胞凋亡和免疫球蛋白等有关[17]。其中炎性因子释放和相关信号通路异常激活,促进炎性因子的释放过程中NF-κB是炎性因子自分泌或/和旁分泌的中心环节,JNK对运行炎症的机制发挥重要的介导作用,因此,本研究以痛风性关节炎为研究基础,研究不同浓度的豨莶草提取物和JNK信号通路抑制剂SP600125痛风性关节炎炎性因子IL-1、IL-8、TNF-α和NF-κB影响,研究发现模型组中大鼠血清中IL-1、IL-8、TNF-α含量明显增加,滑膜组织中NF-κB的表达明显增加,灌胃给予不同浓度的豨莶草提取物和JNK抑制剂SP600 125发现大鼠血清中IL-1、IL-8、TNF-α含量明显降低,滑膜组织中NF-κB的表达明显降低,并且结合病理学结果可知模型组滑膜组织中滑膜细胞增生、成纤维细胞增生和炎症明显;给予不同浓度的豨莶草和JNK抑制剂SP600125炎性细胞浸润明显减少,滑膜细胞增生和成纤维细胞增生明显减轻,表明豨莶草和JNK抑制剂SP600125能够明显改善痛风性关节炎症状的发生发展和炎性因子的释放。
JNK信号通路的激活与许多疾病的发生发展密切相关,本研究发现模型组大鼠滑膜组织中JNK和p-JNK蛋白的表达明显增加,c-Jun、AP-1mRNA水平表达明显升高,说明痛风性关节炎激活JNK信号通路,给予不同浓度的豨莶草和JNK抑制剂SP600125能够明显降低JNK、p-JNK、c-Jun mRNA和AP-1 mRNA表达水平。
综上所述,以痛风性关节炎为研究对象,通过观察不同浓度豨莶草与JNK抑制剂SP600125对痛风性关节炎大鼠血清中IL-1、IL-8、TNF-α含量变化和滑膜组织病理学观察发现豨莶草和JNK抑制剂SP600125能够降低痛风性关节炎大鼠血清中IL-1、IL-8、TNF-α水平,降低滑膜组织中炎性因子的释放和浸润,改善炎症反应,同时研究发现痛风性关节炎滑膜组织中JNK和p-JNK蛋白及c-Jun mRNA和AP-1 mRNA表达增加,豨莶草和JNK抑制剂SP600125能够明显降低JNK和p-JNK蛋白和c-Jun mRNA和AP-1 mRNA表达,结果表明豨莶草能够明显改善痛风性关节炎大鼠炎性反应和滑膜组织损伤,可能的机制是通过改善JNK通路的异常激活,降低JNK通路介导的炎症反应,因此,豨莶草有望作为JNK信号通路抑制剂成为治疗痛风性关节炎药物。

