肌肉组织在骨修复中的作用
方幸 李世昌* 徐帅
1.华东师范大学 青少年健康评价与运动干预教育部重点实验室,上海 200241 2.华东师范大学 体育与健康学院,上海 200241
骨折对于人体来说是最常见的大型器官损伤。骨折愈合是一个复杂的过程,涉及许多类型的细胞、信号分子和生长因子的相互作用。炎症、修复和重塑是骨折愈合生理过程的三个阶段[1]。关于骨折的修复阶段,Einhorn等人[2]认为,骨修复是一种产后再生过程,其重现了许多胚胎期骨骼发育的生物事件。虽然大多数骨折都能愈合,但仍有10%-15%的骨折是延迟愈合或者不愈合。疾病(糖尿病、肥胖)、环境因素(吸烟)、以及一些遗传因素不利于骨折愈合[3,4]。而非常重要的局部因素是骨折位点周围的软组织情况,因为骨折除了骨骼损伤之外,还涉及相邻的肌肉、肌腱、血管、神经及其他软组织损伤。肌肉组织损伤严重程度与骨折不愈合的发生率高度相关,因此越来越多的研究者关注到肌肉组织对骨骼修复作用的重要性[5,6],并且也将骨折看作是肌骨系统中最常见的损伤之一[7]。
肌肉和骨骼都来源于中胚层,又相互邻近,在遗传学、生理学、解剖学上这两种组织之间存在不可分割的密切关系。过去常常将肌肉对骨骼的作用归因于机械作用,但最新研究发现肌肉和骨骼在生物合成和代谢上存在共存和适应关系[8]。大量临床数据表明肌肉质量的增加和骨密度的增加,与骨折风险的降低紧密相关[9];肌肉萎缩和骨质疏松可能是由共同的代谢信号导致[10];中医学提出“骨肉不相亲”与骨质疏松症有密切联系[11]。Pederse[12]、Kaji[13]和Hamrick[14]都发现肌肉组织作为内分泌器官分泌的肌肉因子(myokines)能够调节骨骼生长。此外,以黄宏兴为组长的专家们经过多次会议讨论后达成共识认为肌肉组织是调节骨骼潜在细胞与信号的重要来源,且肌肉组织的微环境对骨骼发育、修复和重塑会产生重要影响[15]。Davis等人[16]就以肌肉-骨骼之间的关系为研究方向证明了肌肉组织本身对于骨形成和骨修复具有积极作用,其中myokines对于骨折愈合具有重要意义。
1 肌肉是干细胞的重要来源
骨折治疗对于骨修复阶段的目标是确保骨折稳定性、骨折位点处的再血管化,并提供刺激使得损伤部位的骨祖细胞/骨骼干细胞(osteoprogenitors/Bone stem cells)能够分化形成成熟的成骨细胞,从而促进骨折修复。当骨骼干细胞被损坏或者缺乏,对骨修复的结果具有不利的影响。Shah等人[6]认为骨修复过程中的主要事件是骨折位点的骨祖细胞/骨骼干细胞募集、增殖、扩张和积聚,而骨骼干细胞来源丰富是骨再生必要的因素之一。
组织学研究发现,骨膜内的细胞会迅速对骨折信号作出反应,因为在损伤后24-48小时内可以检测到骨膜反应[17]。这种骨膜反应强烈会导致大的骨痂形成并且通过软骨内成骨来促进骨折愈合。目前的治疗范例都将骨膜中的干细胞活化、扩增和分化作为新血管形成、骨形成和骨重塑的必要环节。毋庸置疑,骨膜是骨骼干细胞的有效来源,在骨修复中扮演着极其重要的角色。但是除了骨膜外,还有其他潜在来源可能参与骨修复[6,18](图1),包括骨髓干细胞(bone marrow stem cells, BMSCs)、循环来源的干细胞(systemic circulation-derived stem Cells, SCDSCs)、血管内皮衍生的周细胞(vascular endothelium-derived pericytes, VEDPs)和肌肉来源干细胞(muscle-derived stem cells, MDSCs)。

图1 骨祖细胞/骨骼干细胞的潜在来源[17]Fig.1 The potential source of osteoprogenitors/bone stem cells
经研究表明,BMSCs在外部骨痂组织的形成中作用较小;SCDSCs能够被招募到骨折位点,但是细胞数量又相对较少,并且SCDSCs不是直接通过细胞对骨修复产生作用,而是通过旁分泌因子影响骨修复;VEDPs主要参与到骨重塑过程中发生的骨形成,而不是骨修复过程中的骨形成。 MDSCs虽然目前研究较少,但是已经成为近年来的研究热点[19]。
无论是身体创伤所致的结果(骨化性肌炎),还是遗传疾病(进行性骨化性纤维发育不全)所致,肌肉是异位骨形成最常见的位点之一。此外,在顽固性骨折愈合或牵张成骨的情况下,通常在肌肉附近可看到骨的形成。许多检查骨形态发生蛋白(bone morphogenetic proteins, BMPs)成骨潜力的研究结果已经报道了其在肌肉组织存在情况下的作用[20]。Jackson等人[21]对在战争中经历过爆炸创伤的病人进行肌肉活检,发现他们的BMP-1 mRNA和蛋白水平很高。爆炸创伤伴随异位骨化的发生率很高,因此这似乎意味着BMPs与肌原细胞分化成成骨细胞有着密切的关系。而在细胞体外培养中也证明了这个猜想,克隆的成肌细胞系和原代肌细胞容易在BMPs存在的情况下下调肌肉基因的表达,上调骨性标志物的表达[5]。与此相一致的是,在BMPs存在下,肌细胞能够分化成表达骨性标志物的细胞[22],卫星细胞衍生的成肌细胞在BMPs给药的情况下可以分化成成骨细胞。Hashimoto 等人[23]已观察到卫星细胞表达成肌细胞标志物(Pax7, MyoD)和成骨细胞标志物(ALP, Runx2),并且能够自发地分化成成骨细胞。众多研究认为,肌源细胞对BMPs的成骨反应比其他类型细胞更好。在骨折愈合方面很多新兴的方法是利用BMP-2修饰肌细胞从而促进其分泌BMP-2[16]。这些方法中经常利用离体基因治疗法迫使培养的成肌细胞表达BMPs,再将它们植入实验动物后可以导致新骨形成。
在骨折模型中,Kaufman等人[24]通过使用硝酸纤维素膜(此膜仅能使3.5kDa到50kDa孔径范围内的分子从肌肉穿过到达骨骼,而阻止细胞通过)将肌肉层和骨折位点分离,最终阻止了骨修复。类似的,Harry等人[25]利用聚合物将胫骨骨折模型的肌肉层和骨折位点阻隔,结果明显破坏骨折的愈合效果。但是在此模型中发现骨折位点再血管化数量多,并且该物理膜能够对生长因子和细胞因子渗透。因此,对于肌肉阻隔导致骨修复破坏的可能解释是MDSCs的缺乏。在大量临床骨科治疗中发现严重损伤的骨折会损坏骨膜的完整性,或者因手术后管理会耗尽骨膜中关键骨骼干细胞的情况,但是骨修复仍然可以发生,该情况隐含的反映了骨骼干细胞有补偿性的第二种系统的存在。而Liu等人[5]表明该系统是与骨骼紧密相关的肌肉组织,并且提出肌肉是骨修复的“次要骨膜(secondary periosteum)”,从而表明骨骼干细胞的潜在重要替代来源是肌肉组织。
2 肌肉组织是骨修复的重要元件
肌源性干细胞在骨修复过程中为募集骨骼干细胞提供了很大贡献,但是肌肉组织自身对于骨修复也是极其重要的。早期致力于大鼠骨折模型研究的Utvag团队,从1998年以来就得到了很多有价值的结论:1)骨膜和肌肉完好的连接对骨折愈合很重要[26];2)骨折发生后早期肌肉-骨膜界面的完整性是骨膜骨痂形成的重要前提条件[27];3)肌肉覆盖不良可延缓大鼠的骨折愈合,较大范围的肌肉组织缺损可能对早期骨折愈合有负面影响[28];4)切除大肌肉片段明显损害胫骨骨折愈合[29]。一些临床研究表明肌肉对于骨折愈合的效果优于皮肤组织,并把这归因于肌肉组织中血管比皮肤组织高。Harry等人[30]将小鼠胫骨骨折模型分成两个试验组,比较肌肉组织和皮肤组织覆盖在骨折位点上的愈合效果,以及在愈合过程中的血管密度。实验结果发现,在骨折愈合所有时间点中,虽然皮肤组织具有较高的血管密度,但是肌肉组织却能够加速骨折愈合。该实验恰好证明了肌肉组织促进骨折愈合的最重要原因并不是血管密度高,而可能是上述提到的MDSCs的作用。
另外,Hao等人[31]利用大鼠股骨骨折模型将股四头肌通过肉毒杆菌毒素A毒素使其暂时性的萎缩,结果发现骨折愈合效果不理想。Aboukhalil等人[32]也发现小鼠肌肉衰减退化或营养不良并伴有慢性炎症会延迟骨再生,继而造成骨折风险升高。骨折愈合的复杂程度与周围肌肉组织创伤的严重程度有关,而创伤引发的炎症情况是肌肉骨骼健康和再生的主要决定因素,所以骨折延迟愈合和不愈合的发生,将部分原因归因于肌肉创伤诱发的局部炎症反应是合理的[33]。最近,Pollot等人[34]也表明肌肉损失会影响邻近骨的骨折愈合效果。综上所述,完整无损的肌肉组织是骨修复的重要元件,甚至在骨折愈合中扮演着不可或缺以及不可替代的角色[35]。
3 肌肉因子对骨修复的作用
肌肉与骨骼关系密切,很多研究者将肌肉和骨骼视为一个“单元(unit)”或“系统(system)”。肌肉不仅包含高度骨诱导型细胞群体[36],还能够分泌细胞因子及生长因子,从而对骨骼生长进行调节。Pedersen等人[12,37]研究认为骨骼肌为内分泌器官,并将其分泌的肌源性因子定义为myokines;肌肉分泌的myokines包括胰岛素样生长因子1(Insulin-like growth factor-1, IGF-1)、成纤维细胞生长因子 2(Fibroblast growth factor-2, FGF-2)、肌肉生长抑制素(Myostatin)、白介素6(Interleukin-6, IL-6)、骨甘氨酸(Osteoglycin,OGN)、基质金属蛋白酶(Matrix metalloproteinase-2, MMP-2)、鸢尾素(Irisin)以及富含半胱氨酸的酸性蛋白(Secreted Protein, Acidic and Rich in Cysteine, SPARC)等其他分泌因子,共同调节骨代谢[13](图2)。Myokines能够穿过骨膜浅表的纤维层到达骨膜深面的生发层,作为存在于骨膜生发层中成骨细胞的信号分子,调节骨形成。肌肉和骨骼之间存在的生化“串扰(crosstalk)”已经成为研究热点,而深入了解肌肉和骨骼之间的相互作用关系,对于发展有效的骨修复新战略至关重要[38]。
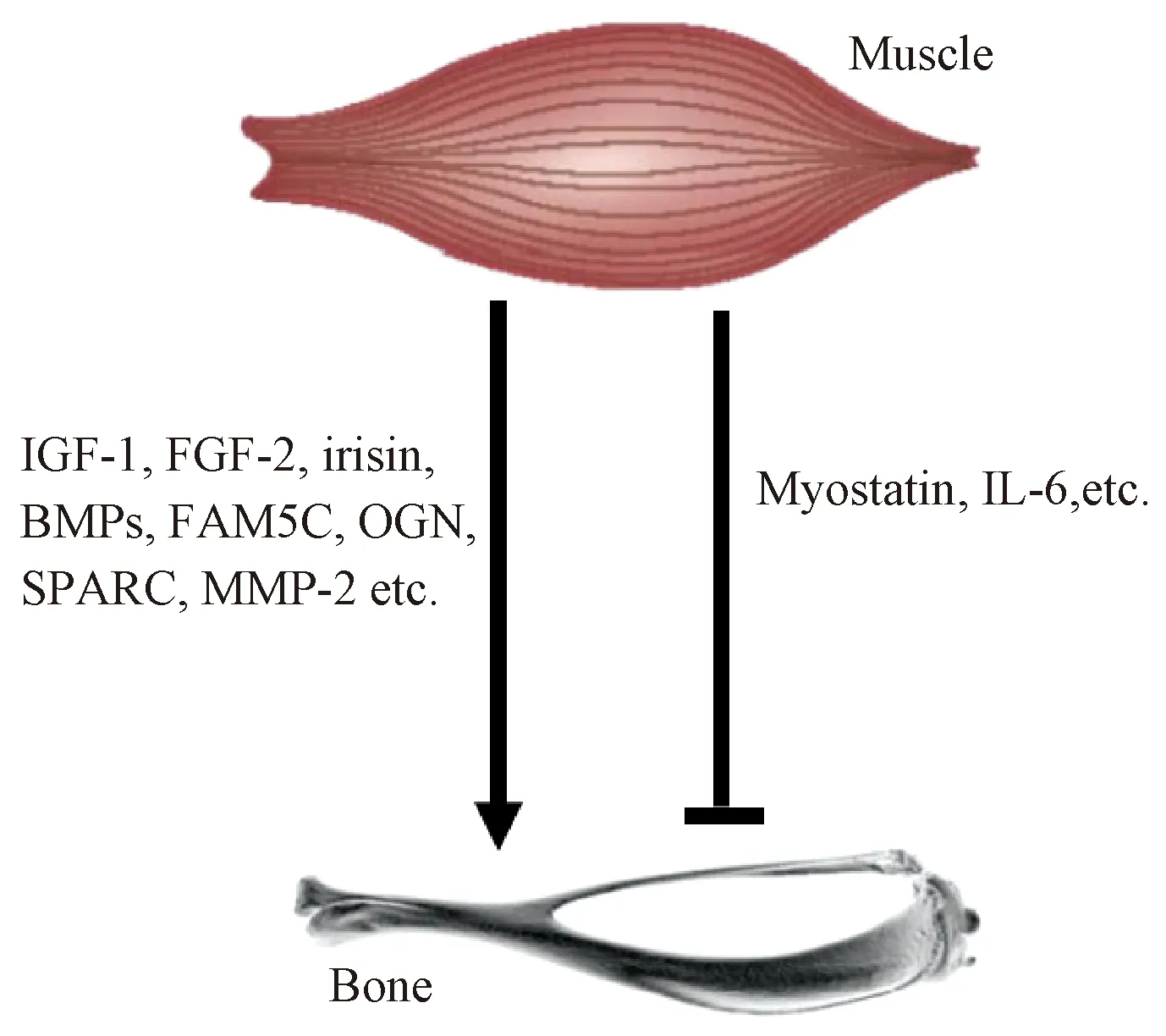
图2 肌肉因子对骨形成的作用[13]Fig.2 The effects of myokines on bone formation
IGF-1和FGF-2作为两个重要的生骨因子[14],由肌管分泌且在肌肉组织中含量丰富。Hamrick等人[39]运用免疫组织化学技术和 ELISA 技术发现在骨骼肌肉交界面上,肌纤维直接附着在骨膜表面;IGF-1和 FGF-2在交界面上可被检测到,同时IGF-1受体和FGF-2受体在骨膜上也被检测到。小鼠肌肉中过表达IGF-1会导致肌肉质量增加和皮质骨骨量增加;而与正常小鼠相比,IGF-1只在肝细胞中表达的基因敲除小鼠表现出骨小梁减少[40]。早期研究已证实,通过全身或局部给予FGF-2可增加生长发育中的大鼠骨膜内骨形成,而FGF-2通过经典的胞吐作用从细胞内输出,因此在体内和体外通过机械诱导肌肉细胞膜破裂,使得FGF-2释放是其中的一种机制[14]。
Myostatin主要由肌肉组织分泌,对肌肉的生长具有负调节作用。Elkasrawy等人在体外研究中发现,Myostain抑制BMSCs的增殖和软骨细胞的分化,并且发现肢体创伤导致肌纤维损伤使得Myostatin表达增加[41]。局部使用外源性的Myostatin会加剧肌肉纤维化,而抑制骨骼修复[42]。
体外实验发现受到机械刺激后肌管会通过释放IL-6促进破骨细胞形成、刺激骨吸收作用[43],这可能会有利于骨折愈合最后阶段的骨重塑。OGN由成肌细胞产生,能够提高成骨细胞骨形成相关参数的表达[44]。FAM5C在肌管中过表达会使得Osterix、ALP和OCN mRNA水平增加,而抑制FAM5C的表达会阻止骨形成标志物的产生[45]。与SPARC 相似, MMP-2存在于肌肉和骨骼中,对肌骨修复起重要作用[46]。Irisin是新发现的运动介导调控能量代谢的肌肉因子,其表达水平下降与骨质疏松性骨折的发生具有相关性[47]。
其他能够作用于骨骼的候选myokines还有白血病抑制因子(Leukemia inhibitory factor, LIF)、脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)、肌肉素(Musclin)等[13]。目前,关于肌肉作为分泌器官对骨骼作用的研究越来越多,寻找myokines并了解其生理生化作用是一个有趣的研究方向。因此,进一步探讨关于myokines对骨代谢作用的更多内容可能为骨修复研究领域提供新的视角。
4 结论
骨折愈合取决于高度协调的一系列组织、细胞和分子事件。肌肉是骨骼的“邻居”,虽然两者作为运动系统在机械力学上关系紧密,但是在生理生化上的联系同样也很密切。肌肉无论是作为骨骼干细胞来源、作为内分泌器官还是其组织本身来说对于骨修复发挥着独特的作用。在军事创伤中,经常遇到邻近骨折的肌肉组织体积的损失并且骨膜也受到粉碎性的损坏,以至于可能导致终身残疾。然而肌肉组织包含高度骨诱导型细胞群体,加上成肌细胞容易被遗传修饰,所以若能够通过基因治疗和组织工程对这类相邻骨膜及肌肉都被破坏的机械性骨折进行治疗,那么这可能会帮助患者骨折愈合避免残疾。因此,了解肌肉在组织、细胞及分子水平上对于骨形成和修复中的作用,将为指导外科手术治疗严重的骨骼损伤提供新的研究领域。

