CIK细胞干预非小细胞肺癌的临床观察
刘 冰,武文平,韩 冰,申方臣,刘建瑞,佟 瑞
(秦皇岛市中医医院,河北 秦皇岛066000)
CIK细胞干预非小细胞肺癌的临床观察
刘 冰,武文平,韩 冰,申方臣,刘建瑞,佟 瑞*
(秦皇岛市中医医院,河北 秦皇岛066000)
目的 观察CIK细胞治疗中晚期非小细胞肺癌的临床疗效。方法 54例患者分成两组,研究组28例(化疗+CIK治疗),对照组26例(单纯化疗),观察两组患者治疗前后的临床疗效、毒性反应、生活质量、生存分析、免疫功能等指标,并进行统计学分析。结果 研究组有效率(RR)和疾病控制率(DCR)分别为35.7%与78.6%,高于对照组30.8%与69.2%,但差异无统计学意(P>0.05);研究组KPS评分提高率为46.4%(13/28),明显高于对照组23.1%(6/26),差异有统计学意义(P<0.05);研究组在CIK细胞治疗前后及与对照组治疗后相比,外周血CD3+、CD4+及CD4+/CD8+绝对计数明显增加,差异有统计学意(P<0.05);CIK细胞治疗期间,患者无明显毒副反应。结论 CIK细胞治疗可改善非小细胞肺癌患者的生活质量,提高患者免疫功能,且无明显毒副反应。
非小细胞肺癌;CIK细胞;临床疗效
非小细胞肺癌( non-small cell lung cancer,NSCLC) 是我国常见恶性肿瘤之一,占肺癌总数的80%左右,大部分患者确诊时已属晚期,失去手术治疗的机会,生存率低,生存期短[1]。放疗和化疗虽仍是目前治疗中晚期非小细胞肺癌的主要手段,疗效被临床所肯定,但其毒副作用较大,对机体的免疫功能有一定的损伤[2],影响患者的生存质量[3,4]。肿瘤的生物免疫治疗抗瘤活性高、毒副作用小,已广泛应用于临床。CIK细胞( cytokine-induced killer cells,细胞因子诱导的杀伤细胞)具有在体外可以大量扩增、对肿瘤细胞直接杀伤作用以及能调节宿主免疫功能等优势,被认为是新一代抗肿瘤过继免疫治疗的首选方案[5]。本研究选取河北省秦皇岛市中医院肿瘤科中晚期非小细胞肺癌患者28例进行CIK治疗,并与26例对照组进行疗效对比分析,旨在研究探讨CIK治疗中晚期非小细胞肺癌的临床效果。
1 资料与方法
1.1 研究对象的纳入标准
纳入标准:所有患者均经组织病理学或细胞学检查证实确诊;预计生存期≥3个月,KPS≥60分;全身状况良好,无严重的重要脏器损害,无不可控制的感染;无严重过敏体质及哺乳期和妊娠期患者;所有患者均为自愿接受CIK细胞治疗,并签署治疗知情同意书。
1.2 一般资料及分组
收集2014年3月至2015年12月我院肿瘤科符合纳入标准的中晚期非小细胞肺癌患者共54例,其中男30例,女24例,年龄39-76岁,中位年龄52.5岁。其中临床分期IIB期4例,IIIA期11例,IIIB期15例,IV期24例。组织学分型腺癌18例,鳞癌23例,混合癌8例,大细胞癌5例。所有患者均对本次研究知情同意,并根据是否接受CIK细胞治疗分为研究组28例与对照组26例。两组患者一般资料比较具有均衡性,差异无统计学意义(P>0.05)。
1.3 CIK细胞制备及治疗方法
研究组患者在化疗结束72 h后,于清晨安静状态下肝素钠抗凝管抽取外周血50-100 ml,送至我院生物治疗中心实验室进行单个核细胞(PBMC)分离、纯化后,加入细胞培养液(所用CIK培养试剂均购自北京五康生物公司)并置于37℃、5%CO2培养箱内培养扩增。至14天左右,当CIK细胞总数达到5×109个以上,检测细胞内毒素、细菌、真菌、支原体等指标均为阴性且台盼蓝染色计算细胞活率大于95%后,收集CIK细胞冻存备用。研究组患者在化疗结束72 h后开始CIK细胞回输治疗。无菌操作下,将复苏的CIK细胞用生理盐水洗涤2-3次,加入20%人血白蛋白5 ml,再重悬于200 ml生理盐水。患者每日输一次,每次细胞数量1×109左右,连续输5天为一个疗程,每次细胞发出后确保2 h内回输完毕。对照组仅接受常规化疗方案。
1.4 观察指标
1.4.1 疗效评价 所有患者均在接受2个疗程以上治疗后进行疗效评价。按照实体瘤疗效评价标准(RECIST)分为完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、稳定( stable disease,SD)和进展(progressive disease,PD)。有效率(response rate,RR)=(CR+PR)/总例数×100%,疾病控制率(disease control rate,DCR)=(CR+PR+SD)/总例数×100%。
1.4.2 安全性评价 对比观察CIK细胞回输过程中及回输后患者有无不良反应,如发热等。并在一个疗程完成后分别检测2组患者的血常规、肝肾功能等指标。
1.4.3 生活质量评价 应用卡氏评分(KPS)对比观察研究组(CIK治疗组)与单纯化疗组患者生活质量改善情况。
1.4.4 生存分析 对比分析研究组与对照组的无进展生存期(PFS)。PFS指从纳入研究开始到疾病出现进展或死亡时间。
1.4.5 免疫指标 应用流式细胞仪检测2组患者治疗前后的T细胞亚群改变,并对比分析。
1.5 统计学分析
2 结果
2.1 临床疗效评价
两组患者在治疗2个疗程后进行临床疗效评价,研究组有效率(RR)和疾病控制率(DCR)分别为35.7%与78.6%;对照组为30.8%与69.2%。经统计学分析,两组有效率与疾病控制率差异无统计学意义(P>0.05),详细比较见表1。
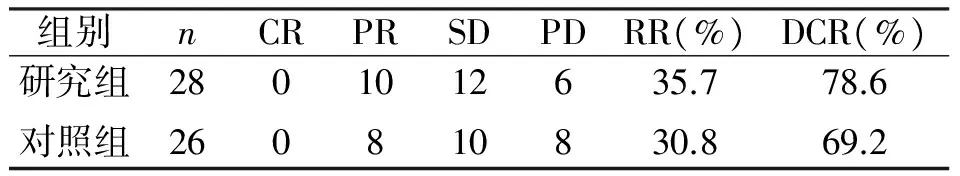
表1 研究组与对照组临床疗效对比
2.2 安全性分析
两组患者的主要毒性反应为骨髓抑制及胃肠道反应,表现为中性粒细胞减低、食欲下降、乏力、恶心、呕吐等,研究组与对照组无明显毒性反应差异。CIK细胞治疗组的患者常见不良反应主要是发热,研究组28例患者在治疗期间出现发热3例(10.7%),但体温均<38℃,经过对症处理后恢复正常。两组患者均在一个疗程结束后抽取静脉血检测血常规、肝肾功能,无明显异常。
2.3 生活质量评价
研究组KPS评分提高10分及以上者13例,稳定10例,下降5例,提高率为46.4%(13/28),明显高于对照组23.1%(6/26),差异有统计学意义(P<0.05)。同时对比治疗后两组患者的精神状态、睡眠质量、乏力、疼痛等指标改善情况,研究组改善情况均显著高于对照组,结果表明CIK细胞治疗可以提高和改善患者的生活质量。
2.4 生存分析
研究组和对照组患者中位PFS分别为6.8个月和6.2个月。研究组的PFS略长于对照组,但两组差异无统计学意义(P>0.05)
2.5 免疫指标变化
流失细胞仪检测结果显示,开始CIK细胞治疗前两组间T淋巴细胞亚群水平无显著差异(P>0.05)。研究期间,对照组进行化疗后T淋巴细胞亚群水平无明显变化(P>0.05)。研究组在CIK细胞治疗前后及与对照组治疗后相比,T细胞亚群有明显变化,表现为外周血CD3+、CD4+及CD4+/CD8+绝对计数明显增加,差异有统计学意义(P<0.05)。CD8+绝对计数无明显变化(P>0.05),见表2。
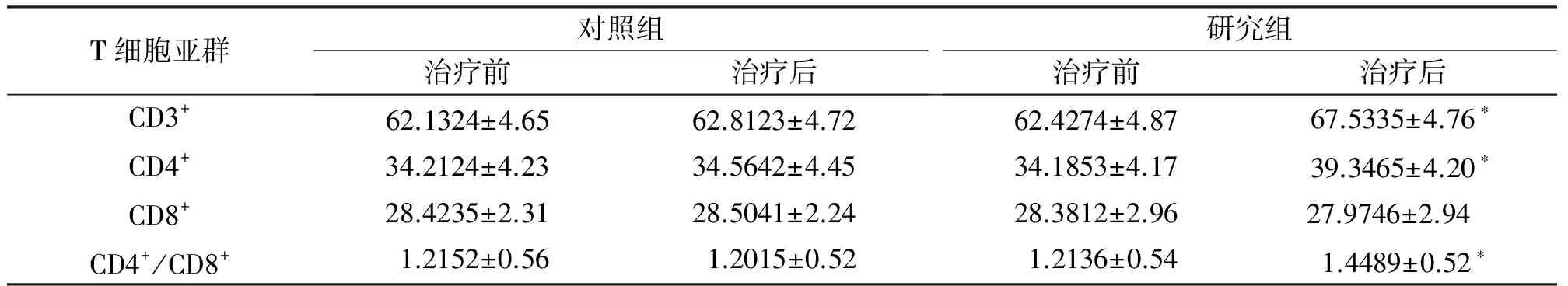
表2 两组患者CIK治疗前后T细胞亚群变化
注:对照组仅单纯化疗,研究组为化疗+CIK治疗;与对照组相比,*P<0.05
3 讨论
非小细胞肺癌(NSCLC)以高发病率、高死亡率、低生存期[6]为特点,对患者的身体、心理和社会均造成严重打击。因NSCLC发现确诊已多为中晚期,故目前针对NSCLC患者的治疗主要是放化疗,但毒副反应严重。生物治疗是继手术、放疗、化疗后的第四种治疗模式[7],近年来越来越受到人们的重视。CIK细胞目前被认为是新一代的抗肿瘤过继细胞免疫治疗的首选方案[8]。CIK细胞是将人体外周血单个核细胞(PBMC)在体外用IL-2、抗CD3单抗、IFN-γ等多种细胞因子诱导培养增殖后获得的异质性细胞群,同时具有T淋巴细胞抗瘤生物活性和NK细胞的非MHC限制性杀瘤特点[9,10]。CIK细胞体外培养增殖速度快、杀瘤活性高、具有提高机体抗肿瘤免疫应答、降低肿瘤负荷、防止肿瘤复发等功能。其作用机制主要是CIK细胞被抗原或细胞因子刺激后,胞内丝裂原活化蛋白激酶/细胞外调节蛋白激酶(MAPK/ERK)通路和信号传导及转录激活因子(STAT)通路被激活后可分泌IL-2、IFN-γ 、TNF-α等多种细胞因子,可直接抑制肿瘤细胞增殖,并可通过调节Tregs细胞等增强机体免疫功能间接杀伤肿瘤细胞[11-13];其次CIK细胞表面的NCR3等受体可与肿瘤细胞表面相应抗原分子结合,CIK细胞活化后胞外分泌毒性颗粒,穿透、裂解肿瘤细胞,从而发挥杀伤作用[14-16]。
本研究从两组(研究组与对照组)的近期临床疗效、安全性、生活质量及免疫指标变化等方面进行对比分析,结果显示研究组(化疗+CIK治疗)的临床有效率及疾病控制率均高于对照组;研究组的KPS评分显著高于对照组(P<0.05),表明CIK治疗可明显改善患者的生活质量;研究组在CIK细胞治疗后T细胞亚群有明显改变,外周血CD3+、CD4+及CD4+/CD8+绝对计数明显增加,表明CIK治疗可提高改善患者的免疫功能,且治疗期间并无明显毒副作用。这与国内外相关研究报道结果相符[17,18]。
基于本次研究,对于中晚期的NSCLC患者,可采用化疗联合CIK治疗方案,改善患者的生活质量,具有良好的临床应用前景。
[1]Chang A.Chemotherapy,chemoresistance and the changing treatmentlandscape for NSCLC[J].Lung Cancer,2011,71(1):3.
[2]Shi L,Zhou Q,Wu J,et al.Efficacy of adjuvant immunotherapy with cytokine- induced killercells in patients withlocally advanced gastric cancer[J].Cancer Immunol Immunother,2012,61(12):2251.
[3]Auperin A,Le Pechoux C,Rolland E,et al.Meta-analysis ofconcomitant versus sequential radiochemotherapy in locallyadvanced non-small-cell lung cancer[J].J Clin Oncol,2010,28(4):2181.
[4]Rowell NP,O′ rourke NP.Concurrent chemoradiotherapy innon small cell lung cancer[J].Cochrane Database Syst Rev,2014,14(7):2140.
[5]明浩,李翀.CIK细胞治疗非小细胞肺癌的研究进展[J]中国医药生物技术.2015,10 (4):316.
[6]Chang A.Chemotherapy,chemoresistance and the changing treatment landscape for NSCLC[J]Lung Cancer,2011,71(1):3.
[7]Blattman JN,Greenberg PD.Cancer immunotherapy:a treatment for the masses for the masses[J].Science,2004,305(5681):200.
[8]张 曼,杨 涛,石 洋,等DCs-CIK细胞免疫治疗联合化疗对晚期非小细胞肺癌疗效及安全性的影响[J].肿瘤,2014,34(4):361.
[9]Jiang JT.Cytokine induced killer cells antitumor mechanism andapplication[J].Chin J Clin Lab Sci,2012,30(10):837.
[10]Jiang J,Wu C,Lu B.Cytokine-induced killer cells promote antitumorimmunity[J].J Transl Med,2013,11(1):83.
[11]Kornacker M,Moldenhauer G,Herbst M,et al.Cytokine-inducedkiller cells against autologous CLL:direct cytotoxic effects andinduction of immune accessory molecules by interferon-gamma[J].IntJ Cancer,2006,119(6):1377.
[12]Pan Y,Tao Q,Wang H,et al.Dendritic cells decreased theconcomitant expanded tregs and tregs related IL-35 incytokine-induced killer cells and increased their cytotoxicity againstleukemia cells[J].PLoS One,2014,9(4):e93591.
[13]Deng QI,Bai X,Lv HR,et al.Anti-CD20 antibody induces theimprovement of cytokine-induced killer cell activity via the STAT andMAPK/ERK signaling pathways[J].Exp Ther Med,2015,9(4):1215.
[14]Mehta BA,Schmidt-Wolf IG,Weissman IL,et al.Two pathways ofexocytosis of cytoplasmic granule contents and target cell killing bycytokine-induced CD3+CD56+killer cells[J].Blood,1995,86(9):3493.
[15]Pievani A,Borleri G,Pende D,et al.Dual-functional capability ofCD3+CD56+CIK cells,a T-cell subset that acquires NK function andretains TCR-mediated specific cytotoxicity[J].Blood,2011,118(12):3301.
[16]Verneris MR,Karami M,Baker J,et al.Role of NKG2D signaling inthe cytotoxicity of activated and expanded CD8+T cells[J].Blood,2004,103(8):3065.
[17]罗 虎,宫 亮,陈永峰,等.CIK维持治疗中晚期肺癌的临床观察及影响因素分析[J].第三军医大学学报,2013,35(6):569.
[18]Han R X,Liu X,Pan P,et al.Effectiveness and safetyof chemotherapy combined with dendritic cells co-culturedwith cytokine-induced killer cells in the treatment of advanced non-small-cell lung cancer:a systematic reviewand meta-analysis[J].PLoS One,2014,9(9):e108958.
河北省秦皇岛市科技局科研计划项目(201401A121)
1007-4287(2017)07-1155-03
R734.2
A
2016-06-26)
*通讯作者

