拓扑异构酶2α受抑癌基因p53的调控并调节前列腺癌细胞的增殖能力
梁婷婷,王永坤,王 尧
(1.吉林大学第一医院 肿瘤中心,吉林 长春130021;2.吉林大学中日联谊医院 a骨科;b泌尿外科)
拓扑异构酶2α受抑癌基因p53的调控并调节前列腺癌细胞的增殖能力
梁婷婷1,王永坤2a,王 尧2b*
(1.吉林大学第一医院 肿瘤中心,吉林 长春130021;2.吉林大学中日联谊医院 a骨科;b泌尿外科)
目的 观察TOP2α对前列腺癌细胞增殖能力的影响以及抑癌基因p53对TOP2α的调控能力。方法 以Lipofectamine2000试剂转染针对p53和非特异性对照组的siRNA,干扰前列腺癌细胞C4-2中p53 的表达,采用Real-time PCR和Western Blot检测细胞内TOP2α的mRNA和蛋白水平表达变化;采用质粒转染法在293T细胞中过表达p53后检测TOP2α蛋白水平的变化,明确p53对TOP2α表达的影响;采用BrdU标记法计算并检测干扰或过表达TOP2α表达后对前列腺癌细胞增殖能力的影响,明确TOP2α对前列腺癌细胞增殖的调节能力。结果 干扰p53表达后细胞内TOP2α mRNA的表达明显升高,说明p53可以调节TOP2α的转录水平,进一步检测干扰p53表达后,TOP2α的蛋白水平表达明显升高;在细胞内,过表达p53后检测TOP2α的蛋白表达水平明显下降;在C4-2细胞中干扰目标基因TOP2α的表达后,增殖细胞的百分比从(21.54±1.443)%下降至(13.78±0.4736)%(P<0.05)。同时,在C4-2细胞中过表达TOP2α后,增殖细胞的百分比从(20.84±2.082%)上升至(33.36±3.244)% (P<0.05)。结论 在前列腺癌细胞中,p53可以在mRNA和蛋白水平调节TOP2α的表达,TOP2α具有调节前列腺癌细胞增殖的能力。
肿瘤;前列腺癌;p53;TOP2α
(ChinJLabDiagn,2017,21:1261)
DNA拓扑异构酶2α(TOP2α)在细胞DNA复制和转录过程中维持染色体的空间结构具有重要的作用。研究表明,TOP2α可能参与调控了癌症细胞的凋亡和增殖,其与肺非小细胞肺癌的脑转移可能呈相关性,TOP2α的表达升高可以预测乳腺癌患者对于表阿霉素为主化疗方案的反应性等[1]。TOP2α可能在前列腺癌的发展过程中发挥重要的作用,高表达TOP2α的前列腺癌细胞表现出更强的侵袭性和增殖能力[2],但其在前列腺癌细胞内的具体作用机制尚不清楚。
p53是一个重要的抑癌基因,其在调控细胞的增殖、凋亡、DNA损伤修复等方面发挥了重要的作用[3]。超过70%的晚期前列腺癌患者的组织标本中出现p53基因的表达缺失[4]。p53是一个重要的转录因子,调控大量下游基因的表达进而发挥生物学作用,其在前列腺癌细胞中调控的重要效应因子是目前的研究热点之一。本研究旨在检测前列腺癌细胞中p53的表达和TOP2α表达的关系,以及TOP2α在前列腺癌细胞中的生物学作用。
1 材料与方法
1.1 细胞培养
前列腺癌细胞系C4-2用含有10%牛胎血清、100 U/ml青霉素和100 mg/L链霉素的RPMI-1640培养基,293T细胞用含有上述抗生素的DEME培养基,在37℃、5%CO2的培养箱中培养。
1.2 RNA干扰目标基因的表达
C4-2细胞在六孔板中均匀铺板,24h后按照Lipofectamine2000试剂(购自美国Invitrogen公司)说明书进行干扰实验,对照组(siCont)和实验组siRNA剂量均为100pmol。对照组和TOP2α的siRNA购自Santa Cruz公司(sc-36695),p53 siRNA购自IDT公司,序列为:5-AGUGUUUCUGUCAUCCAAAUACUCCAC。
1.3 细胞转染实验
293T细胞铺板生长24 h后,按照PolyJet转染试剂(购自SignaGen公司)说明书转染目标质粒48 h,收集细胞并进行后续试验。
1.4 Western blot实验
收集细胞后进行裂解并检测蛋白浓度,制备成1 mg/L的蛋白样品。取适量样品加入聚丙烯酰胺凝胶中进行电泳分离,转膜后,5%脱脂牛奶封闭30 mins,4℃一抗孵育过夜,PBST冲洗10 min×3次,室温下二抗孵育2 h,PBST冲洗10 min×3次,加入化学发光试剂(ECL)发光液后,暗室显影并洗片保存。 P53抗体购自Santa Cruz公司(sc-6243),TOP2α抗体购自Santa Cruz公司(sc165986)。
1.5 BrdU标记法检测细胞增殖能力
C4-2细胞铺板于24孔板,RNA干扰实验干扰目标基因表达后48 h。加入10 μmol/L BrdU孵育2 h,-20℃下Carnoy’s固定液固定20 min,加入2 mol/L HCl和0.1 mol/L Boric酸性液后,3%过氧化氢处理10 min,10%山羊血清封闭1 h,4℃ BrdU一抗(购自Sigma公司,B2531)孵育过夜,37℃ 二抗(购自Life Technologies公司,A10521)孵育1 h。SYTOX Green(购自Life Technologies公司, S7020)染色20min。荧光显微镜下观察并计数。
1.6 统计学分析
2 结果
2.1p53调控了TOP2α在前列腺癌细胞中转录水平的表达
在前列腺细胞C4-2中干扰p53的表达后,利用Real-timePCR技术检测TOP2α的表达变化,可见TOP2α的表达明显升高(P<0.05)。说明p53可以抑制TOP2α在转录水平的表达。
2.2p53调控了TOP2α在前列腺癌细胞中蛋白水平的表达
在前列腺细胞C4-2中干扰p53的表达后,利用WesternBlot检测TOP2α在蛋白水平的表达变化,可见TOP2α的表达明显升高。说明p53可以抑制TOP2α在蛋白水平的表达,见图1。
2.3 在293T细胞中过表达p53可以抑制TOP2α的蛋白表达
在293T细胞中,转入2.0μgGFP-p53后,利用WesternBlot检测TOP2α在细胞中的表达变化,发现TOP2α的表达明显受到抑制。说明p53的过表达可以抑制细胞中TOP2α的表达。本实验中同时转入0.5μgmyc-空载体作为表达对照。
2.4TOP2α调控了前列腺癌细胞C4-2的增殖能力
在C4-2细胞中干扰目标基因TOP2α的表达后,检测到增殖细胞的百分比从(21.54±1.443)%下降至(13.78±0.4736)%(P<0.05)。同时,在C4-2细胞中过表达GFP-TOP2α的表达后,检测到增殖细胞的百分比从(20.84±2.082%)上升至(33.36±3.244)% (P<0.05)。说明,TOP2α具有调控前列腺癌细胞增殖能力的功能,见图2。
3 讨论
前列腺癌严重威胁男性的生殖健康[5]。随着普查力度的提高,在我国前列腺癌发病率的提升引人瞩目。前列腺癌发病隐匿,常常无症状,在没有大范围普查的情况下,我国超过60%患者诊断为前列腺癌时已经进入癌症的中晚期,治疗手段少并且常伴随癌症的转移[6]。尽管近些年来,对于前列腺癌的系统治疗进展迅速,放疗、化疗包括手术治疗等方式一定程度缓解了患者疾病的进展程度,但总体治疗效果依然有限[7]。
TOP2α在很多生物学过程中发挥重要的作用,例如DNA的复制、转录、修复和染色体的结构维持与重建[8]。体外实验显示在细胞复制过程中TOP2α常高表达,可以作为增殖性标志物之一[9]。

A:在前列腺癌细胞C4-2中干扰p53的表达后,TOP2α的mRNA水平表达明显上调(与对照组比较,*,P<0.05); B:在前列腺癌细胞C4-2中干扰p53的表达后,TOP2α在蛋白水平的表达明显上调;C:在293T细胞中,通过质粒转染过表达p53后,TOP2α的表达明显降低;
图1 在前列腺癌细胞中,p53在mRNA和蛋白水平调节了TOP2α的表达
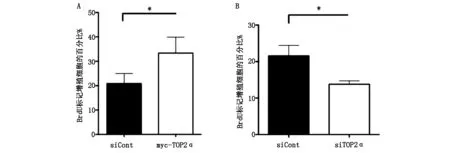
A:在前列腺癌细胞C4-2中,过表达TOP2α后,检测到细胞的增殖能力明显升高(与对照组比较,*,P<0.05) B:干扰目标基因TOP2α的表达后,检测到细胞的增殖能力明显降低(与对照组比较,*,P<0.05)
图2 TOP2α调节前列腺癌细胞的增殖能力
TOP2α表达的异常经常和染色体结构不稳定相关[8]。有报道认为TOP2α的高表达可能和细胞的侵袭性相关并发现其在多种恶性肿瘤中表达增高,包括前列腺癌,TOP2α的表达水平和前列腺癌的Gleason评分呈正相关[10]。
p53是一个重要的抑癌基因和转录因子,在多种肿瘤内出现功能缺失[11],超过70%的晚期前列腺癌出现p53 的功能缺失,但其发挥的重要作用尚不清楚。作为转录因子,p53可以调控多种基因的表达。前期研究发现,p53的缺失可以诱导前列腺内PIN的发生(一种癌前病变),以上研究结果说明p53可能调控了前列腺癌细胞的增殖能力并促进了前列腺癌的发生与发展。本研究结果显示p53可以在mRNA和蛋白水平调控TOP2α在前列腺癌细胞中的表达,说明TOP2α可能是p53所调控的下游蛋白之一。
本研究结果表明,在前列腺癌细胞C4-2中干扰p53的表达,TOP2α在mRNA和蛋白水平表达会明显升高,过表达p53后细胞内的TOP2α蛋白表达会明显减弱,TOP2α是p53所调控的下游基因之一。同时,干扰TOP2α的表达后增殖的前列腺癌细胞明显减少,而过表达TOP2α后增殖细胞的数量明显增强,说明,TOP2α在前列腺癌细胞中可以调控细胞的增殖能力。本研究结果表明,p53可能通过调节目标基因TOP2α在前列腺癌细胞中的表达调控了细胞的增殖。
[1]Schaefer-Klein JL,Murphy SJ,Johnson SH,et al.Topoisomerase 2 Alpha Cooperates with Androgen Receptor to Contribute to Prostate Cancer Progression[J].PLoS One,2015,10(11):e0142327.
[2]Hughes C,Murphy A,Martin C,et al.Topoisomerase II-alpha expression increases with increasing Gleason score and with hormone insensitivity in prostate carcinoma[J].J Clin Pathol,2006,59(7):721.
[3]Charni M,Aloni-Grinstein R,Molchadsky A,et al.p53 on the crossroad between regeneration and cancer[J].Cell Death Differ,2017,24(1):8.
[4]Karanika S,Karantanos T,Li L,et al.DNA damage response and prostate cancer:defects,regulation and therapeutic implications[J].Oncogene,2015,34(22):2815.
[5]Roubaud G,Liaw BC,Oh WK,et al.Strategies to avoid treatment-induced lineage crisis in advanced prostate cancer[J].Nat Rev Clin Oncol,2017,14(5):269.
[6]张 双,刘立杰,孟 玮,等.男性肺恶性结节患者血清性激素水平的变化及意义[J].中国实验诊断学,2016,(09):1504.
[7]王国民,武睿毅.我国前列腺癌实验研究的现状和展望[J].中华实验外科杂志 ,2005,22(9):1031.
[8]Yu X,Davenport JW,Urtishak KA,et al.Genome-wide TOP2A DNA cleavage is biased towards translocated and highly transcribed loci[J].Genome Res,2017.pii:gr.211615.116.doi:10.1101/gr.211615.116.[Epub ahead of print].
[9]Wang TL,Ren YW,Wang HT,et al.Association of Topoisomerase II (TOP2A) and Dual-Specificity Phosphatase 6 (DUSP6) Single Nucleotide Polymorphisms with Radiation Treatment Response and Prognosis of Lung Cancer in Han Chinese[J].Med Sci Monit,2017,23:984.
[10]Karnes RJ,Cheville JC,Ida CM,et al.The ability of biomarkers to predict systemic progression in men with high-risk prostate cancer treated surgically is dependent on ERG status[J].Cancer Res,2010,70(22):8994.
[11]Reinhardt HC,Schumacher B.The p53 network:cellular and systemic DNA damage responses in aging and cancer[J].Trends Genet,2012,28(3):128.
TOP2α,a novel p53 target gene,regulates proliferation of prostate cancer cells
LIANGTing-ting,WANGYong-kun,WANGYao.
(CancerCenter,TheFirstClinicalHospitalofJilinUniversity,Changchun130021,China)
Objective To investigate whether Topoisomerase (DNA) II alpha (TOP2α) promote prostate cancer cells proliferation and regulated by p53.Methods After inhibiting expression of p53 by interfering RNA (RNAi) in C4-2 cells using Lipofectamine2000,the mRNA and protein expression level were assessed by Real-time PCR and Western Blot.After transfecting GFP-p53 in 293T cells by according to the manufacturer’s instruction,the expression level of TOP2α was assessed by Western Blot.After knockdown TOP2α by RNAi in C4-2 cells,proliferation was tested by Bromodeoxyuridine incorporation assay (BrdU).Then,the BrdU assay was repeated after transfecting GFP-TOP2α.Results The mRNA and protein level were significant increased after transfection of siRNA against p53.Moreover,proliferation was further decreased from (21.54±1.443)% to(13.78±0.4736)% (P<0.05).At the meantime,after transfectiong GFP-TOP2α,proliferation was further increased from (20.84±2.082%)to(33.36±3.244)% (P<0.05).Conclusion Our findings suggest that p53 regulates the mRNA and protein level of TOP2α,and TOP2α could regulates proliferation ability of C4-2 cells.
Cancer;Prostate Cancer;p53;TOP2α
国家自然科学基金(81241027)
1007-4287(2017)07-1261-04
R737.25
A
2017-03-26)
*通讯作者

